基于网络药理学、分子对接技术及体外实验验证探讨龙葵治疗乳腺癌的作用机制
2023-11-02胡锦航宋忠兴
温 馨,胡锦航*,程 敏,2*,宋忠兴
1陕西中医药大学 陕西中药资源产业化省部共建协同创新中心 秦药特色资源研究开发国家重点实验室(培育)陕西省创新药物研究中心,咸阳 712083;2商洛学院,商洛 726000
乳腺癌是全球女性中最常见的恶性肿瘤之一[1],也是女性癌症相关死亡的主要原因[2]。乳腺癌的患病风险与很多因素有关,如年龄,遗传,生殖因素以及肥胖等[3]。目前,激素疗法、手术、化疗和放疗是乳腺癌治疗的主要策略,然而,由于乳腺癌是一种复杂且高度异质性疾病,多药耐药和严重的副作用限制了这些治疗方法的治疗效果,因此,迫切需要开发更有效、更安全的抗乳腺癌药物[4,5]。在癌症治疗中,中药和天然产物具有多层次、多途径、多靶点、高效且副作用小等优势,展现出良好的抗肿瘤效果[6,7]。而中药及其活性化合物抗乳腺癌具有疗效确切,毒副作用小、靶点丰富及机制多样等特点,中药来源的抗乳腺癌药物具有良好的开发和应用前景。
龙葵(SolanumnigrumL.)是茄科的一种药用植物,广泛分布于欧洲、亚洲和美洲。龙葵具抗癌、抗炎,抗氧化、抗菌和抗癫痫等作用,其主要的生物活性成分包括甾体皂苷、生物碱、酚类和多糖[8,9]。现代研究表明,龙葵及其活性成分(主要为甾体类、有机酸类、木脂素类及其他类)可用于治疗不同类型的癌症,如肝癌[10]、宫颈癌[11]、胰腺癌[12]、乳腺癌[13]等。龙葵甲醇提取物可诱导乳腺癌细胞MDA-MB-468发生自噬和凋亡[14],龙葵水提物和乙醇提取物对乳腺癌细胞MCF-7具有细胞毒性,并诱导MCF-7细胞发生凋亡和周期阻滞[13,15],除此之外,龙葵也可通过表观遗传调节发挥抗乳腺癌的作用[16]。薯蓣皂苷元是一种来源于薯蓣属植物的天然甾体皂苷元,具有较好的抗肿瘤活性,研究表明薯蓣皂苷元可通过抑制Vav2活性抑制MDA-MB-231乳腺癌细胞的迁移,并影响细胞的迁移行为,揭示薯蓣皂苷元可能具有抗转移潜能[17]。尽管上述研究取得了一定的进展,但龙葵抗乳腺癌的物质基础、作用靶点及详细的分子机制尚不完全明确。本研究基于网络药理学和分子对接相结合的技术方法,构建多层次、多角度的“药物-靶标-通路-疾病”网络关系,并结合体外细胞实验进行验证,明确了龙葵有效成分薯蓣皂苷元可抑制乳腺癌细胞MDA-MB-231的增殖并诱导细胞发生凋亡,初步探讨了薯蓣皂苷元的作用分子机制,为龙葵治疗乳腺癌的进一步研究提供参考。
1 材料与方法
1.1 龙葵活性成分筛选及作用靶点获取
采用TCMSP(http://tcmspw.com/tcmsp.php)数据库以药物口服生物利用度(oral bioavailability,OB)≥ 30%、类药性(drug-likeness,DL)≥ 0.18[18]为筛选依据,获得龙葵的活性成分。此外,通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库和SwissTargetPredicition(http://www.swisstargetprediction.ch/)数据库[19]收集龙葵有效成分及其作用靶点,筛选后利用UniProt数据库(https://www.uniprot.org/)进行蛋白靶点矫正。
1.2 收集乳腺癌相关靶点
使用GeneCards(https://www.genecards.org/)数据库以 “breast cancer” 为关键词进行检索,去重后得到乳腺癌的相关疾病靶点。
1.3 收集龙葵活性成分治疗乳腺癌潜在靶点
将挖掘到的乳腺癌相关疾病靶点和龙葵活性成分相关靶点导入线软件VENNY 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)进行分析,筛选映射获取交集得到龙葵治疗乳腺癌的潜在作用靶点,并绘制维恩Venn图。
1.4 蛋白质相互作用(PPI)网络的构建
将龙葵治疗乳腺癌作用映射的交集靶点输入STRING 10.5在线软件(https://string-db.org) 构建蛋白相互作用网络,然后将PPI网络数据导入Cytoscape 3.8.0进行拓扑分析,并通过插件MCODE聚类分析共同靶点的度值大小筛选出核心靶点。
1.5 GO 功能分析和 KEGG 通路富集分析
利用生物学信息注释数据库(DAVID,https://david.ncifcrf.gov/summary.jsp,Version 6.8)将潜在作用靶点Symbol录入,Identifier选择为“OFFICIAL_GENE_SYMBOL”,物种选择为“Homo sapiens”,列表类型选择为“Gene List”,进行GO功能分析和KEGG通路富集分析。根据P值筛选得到GO生物学功能分析结果和KEGG通路富集分析结果,并将获得的结果通过微生信分析平台(http://www.bioinformatics.com.cn/)绘制成气泡图进行可视化。
1.6 “药物-活性成分-靶点-疾病”网络构建
将龙葵中药物-活性成分-靶点网络与KEGG富集的代谢通路的结果相整合,在 Cytoscape 3.8.0中构建“药物-活性成分-靶点-通路”网络图。网络中各节点(node)分别代表活性成分和关键靶点基因;网络中边(edge)用来连接活性成分与关键靶点基因;连接到网络的节点以度值(degree)为单位进行表示。网络中节点度值越大,表明该有效成分发挥的作用越强。
1.7 分子对接
将筛选得到的龙葵核心成分与乳腺癌疾病关键靶点进行分子对接,分析来计算网络中关键枢纽的亲和力。配体的三维(3D)结构从PubChem数据库下载。利用RCSB数据库(http://www.rcsb.org/)获得受体的三维结构。配体和受体由mgltools_win32_1.5.6软件修复,并保存为PDBQT文件。AutoDock Vina 1.1.2软件(http://vina.scripps.edu/)用于测试关键活性成分和目标蛋白质之间对接的亲和力。
1.8 实验细胞
人乳腺癌细胞株MDA-MB-231购自江苏凯基生物技术股份有限公司。细胞株用含10% 胎牛血清的L15培养液培养,并置于37 ℃,100%空气,饱和湿度条件下恒温培养。
1.9 主要试剂
薯蓣皂苷元(批号:S229101,纯度为100%,Selleck生物科技有限公司),用1.205 9 mL的乙醇将50 mg纯度为100%的薯蓣皂苷元溶解,终浓度为100 mmol/L,-20 ℃保存;Annexin V-FITC/PI 试剂盒(批号:A211-01,南京诺唯赞生命科技股份有限公司);MTT(批号:906M501,北京索莱宝科技有限公司)、SDS-PAGE凝胶配制试剂盒(批号:P1200-2,北京索莱宝科技有限公司)、Hoechst 33342(批号:20211015,北京索莱宝科技有限公司);蛋白Marker(批号:91227189,Thermo公司);BCA蛋白浓度测定试剂盒(批号:PA115,天根生化科技有限公司);ECL化学发光底物(批号:180-5001,上海天能生命科学有限公司);兔抗p-AKT1单克隆抗体(批号:9018S,Cell Signaling Technology);兔抗AKT1单克隆抗体(批号:N12151652,沈阳万类生物科技有限公司)、兔抗EGFR单克隆抗体(批号:N08180628,沈阳万类生物科技有限公司);鼠抗Bax单克隆抗体(批号:10005017,武汉三鹰生物技术有限公司)、鼠抗Bcl-2单克隆抗体(批号:10022354,武汉三鹰生物技术有限公司)、鼠抗β-action单克隆抗体(批号:10021787,武汉三鹰生物技术有限公司)、HRP标记的山羊抗兔IgG(批号:20000258,武汉三鹰生物技术有限公司)、HRP标记的山羊抗鼠IgG(批号:20000374,武汉三鹰生物技术有限公司)。
1.10 MTT法检测薯蓣皂苷元对三阴性乳腺癌MDA-MB-231细胞增殖的影响
将对数生长期的细胞接种于96孔培养板中,加入不同浓度的薯蓣皂苷元培养48 h,弃去上清,每孔加入180 μL无血清的培养基和20 μL 5 mg/mL的MTT溶液,继续培养4 h后,弃去上清,加入150 μL DMSO溶解MTT甲瓒沉淀,混匀后,使用酶标仪检测490 nm处的吸光度(A)。按公式计算肿瘤细胞生长抑制率:抑制率=(1-A样品/A对照)×100%,以细胞抑制率对药物浓度对数作图,计算出薯蓣皂苷元对MDA-MB-231细胞的IC50值。
1.11 Hoechst 33342检测细胞形态
将细胞接种至24孔板中,接种密度为1×105个/孔;细胞贴壁后用不同浓度的薯蓣皂苷元对细胞进行处理。用免疫染色固定液固定细胞,PBS洗3次,按照Hoechst 33342试剂盒中的说明书进行染色,使用荧光显微镜观察并拍照。
1.12 流式细胞术检测细胞凋亡率
将对数生长期的细胞接种于6孔培养板中,培养24 h后用不同浓度的薯蓣皂苷元进行处理,48 h后消化细胞并离心收集细胞。使用细胞凋亡检测试剂盒对细胞进行染色,利用流式细胞仪检测细胞的凋亡并用Flowjo软件分析。
1.13 Western blot 检测相关蛋白的表达
细胞处理同“1.12”,收集细胞,使用RIPA裂解液,提取细胞总蛋白。通过BCA定量法测定蛋白浓度,将等量的蛋白样品进行SDS-PAGE电泳。采用湿转电转移的方法,将蛋白转移至PVDF膜上,用5%的脱脂奶粉(TBST 配制)37 ℃封闭PVDF膜1 h,去除封闭液,孵育一抗(1∶2 000),4 ℃过夜,TBST洗膜三次,室温孵育二抗(1∶5 000)1 h,TBST洗膜三次后用ECL发光液显影,使用ChemiDoc XRS图像系统结合Image Lab软件进行图像采集以及数据分析。
1.14 统计分析
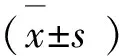
2 结果
2.1 龙葵活性成分筛选及作用靶点确定
通过TCMSP数据库,并结合相关文献报道,根据OB ≥ 30%和DL ≥ 0.18筛选出符合条件且剔除无对应靶点信息的龙葵活性成分共7个(见表1)。
2.2 龙葵治疗乳腺癌的潜在作用靶点预测
通过GeneCards数据库筛选获得乳腺癌相关靶点1 729个,利用在线软件Venny2.1对乳腺癌相关靶点和龙葵活性成分相关靶点进行映射,取交集后,获得共同靶点110个,即龙葵可能通过多个潜在作用靶点协同治疗乳腺癌(见图1)。
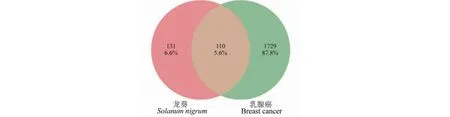
图1 龙葵活性成分相关靶点与乳腺癌相关靶点韦恩图
2.3 PPI 网络构建
将龙葵与乳腺癌的110个共同靶点输入STRING数据库,获得PPI网络,利用Cytoscape 3.8.0进行网络可视化(见图2)。该网络中涉及110个节点,1 096条边,其中节点表示靶基因,边表示靶基因间的相互作用关系。根据插件的网络拓扑分析结果显示,节点degree平均值为19.9。根据节点数值筛选ERBB2、EGFR、KIT、SRC、ESR1、AKT1、MAPK1、PIK3CA等关键靶点,并认为这些靶点对龙葵治疗乳腺癌起到关键作用。

图2 PPI网络互作图
2.4 靶点的GO富集分析
将龙葵 110 个交集靶点录入DAVID数据库中,共得到GO富集分析结果694个,其中包括499个生物过程(biological processes,BP)、63个细胞组分(cell composition,CC)和 132个分子功能(molecular function,MF)。各筛选出排名前10的GO富集结果绘制柱形图(见图3)。生物富集结果表明激酶活性正调节、蛋白酪氨酸激酶活性、结合蛋白丝氨酸/苏氨酸激酶活性、MAPK级联的正向调节、PI3K信号正向调节、锌离子结合、ATP结合等生物过程均在龙葵治疗乳腺癌过程中发挥着重要作用。
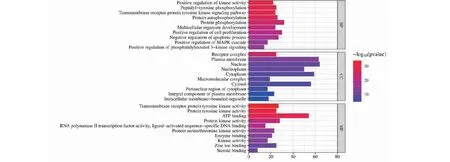
图3 GO功能富集分析
2.5 靶点的KEGG通路富集分析
KEGG通路富集分析中筛选得到137条信号通路,取排名前20的通路进行KEGG可视化,绘制气泡图(见图4)。与乳腺癌相关的通路主要有癌症通路、PI3K/Akt信号通路、EGFR酪氨酸激酶抑制剂耐药性信号通路、ErbB信号通路、MAPK信号通路、Ras信号通路和Rap1信号通路等。该结果提示龙葵通过作用于多条信号通路来发挥治疗乳腺癌的作用。

图4 共有靶点的前20条KEGG通路
2.6 “成分-靶点-通路”网络构建
采用Cytoscape软件构建“成分-靶点-通路”网络图(见图5),该网络共有138个节点,其中7个成分(橙色菱形)、110个靶点(蓝色四边形)、20条通路(绿色圆形),492条边。图中用度值(degree)预测出节点间的关联数,且度值越大表明该成分或该靶点越重要。

图5 龙葵-靶点-疾病及相关通路的互作网络
2.7 分子对接
根据龙葵抗乳腺癌互作网络的主要活性成分,选择基因网络中具有大多数靶点的五个组分和具有高度节点的蛋白质进行分子对接。
表2和图6为关键靶点的活动中心坐标以及对接的结合能,分子对接结合自由能越小,则代表受体与配体间的亲和力越大。取与每个蛋白质结合最强化合物进行可视化处理(见图7)。结果显示,所有化合物与蛋白对接的结合能均小于-6 kcal/mol,说明各化合物与各蛋白均能较好结合。为了验证上述结果,使用分子对接分析来计算网络中关键枢纽的亲和力。
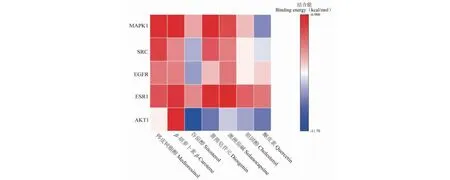
图6 龙葵活性成分与靶点蛋白结合能热图

图7 薯蓣皂苷元与关键靶点分子对接模式图

表2 活性成分与靶点蛋白结合能
2.8 薯蓣皂苷元对三阴性乳腺癌MDA-MB-231细胞增殖的影响
MTT实验表明,与对照组(0 μmol/L)相比,不同浓度(3.125、6.25、12.5、25、50、100、200 μmol/L)的薯蓣皂苷元对MDA-MB-231细胞增殖的抑制率均显著增高,说明薯蓣皂苷元可抑制MDA-MB-231细胞的增殖,并且抑制作用呈剂量依赖性(见图8)。计算薯蓣皂苷元抑制MDA-MB-231细胞的IC50为44.98±3.06 μmol/L,故后续实验采用 0、15、30、60 μmol/L薯蓣皂苷元处理MDA-MB-231细胞进行机制研究。
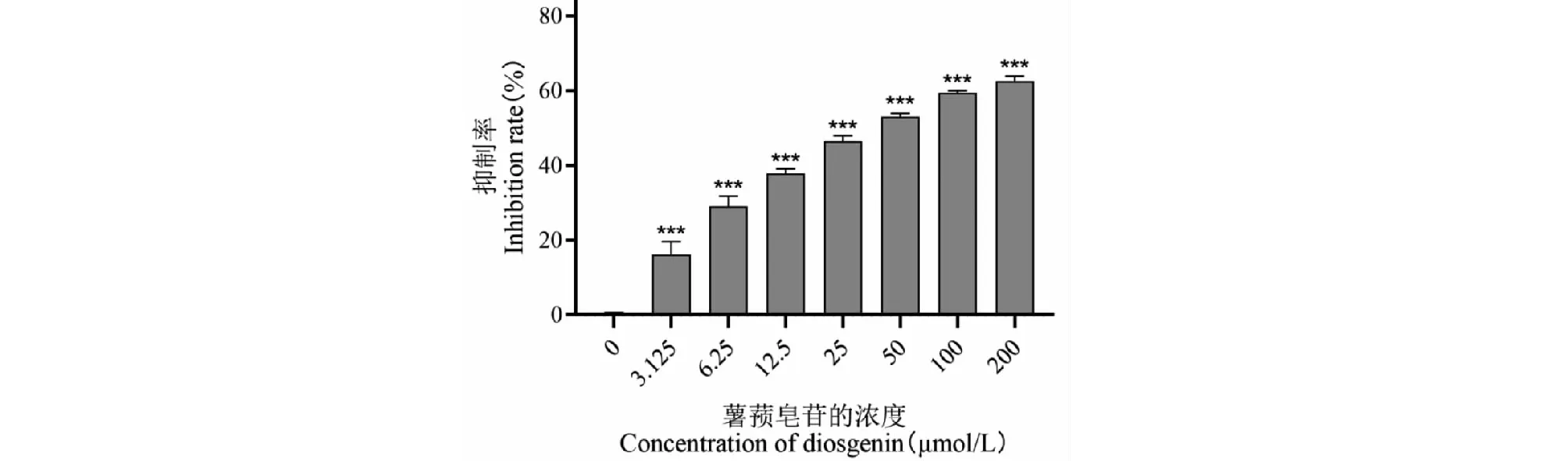
图8 不同浓度薯蓣皂苷元对MDA-MB-231细胞增殖的影响
2.9 薯蓣皂苷元对三阴性乳腺癌MDA-MB-231细胞凋亡的影响
Hoechst 33342染色,并采用荧光显微镜观察细胞形态。如图9所示,对照组细胞核被 Hoechst 33342染成均匀的蓝色,呈圆形或椭圆形,不同浓度薯蓣皂苷元处理组则出现典型的凋亡特征,包括不同程度的呈致密浓染的细胞核。
Annexin V-FITC/PI 双染法结果显示,与对照组相比,不同浓度(15、30、60 μmol/L)的薯蓣皂苷元均可诱导MDA-MB-231细胞凋亡(见图10)。
2.10 薯蓣皂苷元对MDA-MB-231细胞中AKT1、p-AKT1、EGFR以及凋亡相关蛋白表达的影响
Western blot检测MDA-MB-231细胞中EGFR、AKT1、p-AKT1、Bax、Bcl-2蛋白的表达,β-action 作为内参。实验结果显示,与对照组相比,薯蓣皂苷元可下调MDA-MB-231细胞中EGFR蛋白表达,同时上调AKT1蛋白表达,下调p-AKT1蛋白表达(见图11A)。与对照组相比,薯蓣皂苷元可上调MDA-MB-231细胞中Bax蛋白表达,同时下调Bcl-2蛋白表达(见图11B)。
3 讨论与结论
龙葵是我国传统中草药,现代药理学发现龙葵有多种生物活性,且大多数集中在抗肿瘤领域[20,21]。有研究表明其活性成分薯蓣皂苷元可通过调节多种细胞信号通路发挥抗肿瘤作用,且与细胞生长、分化、凋亡等众多重要的分子靶点密切相关[22,23]。
本研究通过网络药理学TCMSP数据库[24]分析,共筛选出梣皮树脂醇、β-胡萝卜素、谷甾醇、薯蓣皂苷元、澳洲茄碱、胆固醇和槲皮素7个有效活性成分,将挖掘到的龙葵活性成分相关靶点与乳腺癌疾病靶点导入线软件VENNY 2.1映射获取交集,同时PPI网络分析表明这些交集靶点间具有密切的联系。有研究表明,槲皮素、澳洲茄碱和谷甾醇具有抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡等药理作用[25-27]。薯蓣皂苷元可促进乳腺癌MCF-7细胞和Skp2细胞的凋亡[28]。由此可见,龙葵有效成分槲皮素、澳洲茄碱、谷甾醇和薯蓣皂苷元可发挥抗肿瘤作用。
化合物-靶点网络图可知,龙葵-疾病靶点取交集后共得到110个靶点,进一步筛选发现ERBB2、EGFR、KIT、SRC、ESR1、AKT1、MAPK1、PIK3CA等为龙葵有效成分治疗乳腺癌的靶蛋白。其中梣皮树脂醇、薯蓣皂苷元和槲皮素等都作用于AKT1和EGFR靶点,AKT(丝氨酸/苏氨酸激酶)和EGFR(表皮生长因子受体)在细胞增殖、迁移和代谢等方面具有重要意义。因此,靶向AKT和EGFR对乳腺癌来说是非常有吸引力的治疗策略[29,30]。本研究结果表明,在乳腺癌发展进程中AKT1和EGFR等靶点起着重要作用,并且可能是龙葵治疗乳腺癌的潜在作用靶点。GO富集分析可知,龙葵抗乳腺癌的靶基因涉及激酶活性正调节、结合蛋白丝氨酸/苏氨酸激酶活性、MAPK级联的正向调节、PI3K信号正向调节、ATP结合等生物过程,这些关键过程在龙葵治疗乳腺癌中发挥重要作用。KEGG结果显示,共富集137条信号通路,如癌症通路、PI3K/Akt信号通路、EGFR酪氨酸激酶抑制剂耐药性信号通路、ErbB信号通路、MAPK信号通路、Ras信号通路、Rap1信号通路等。
分子对接技术探究龙葵的关键活性成分和目标蛋白质间的亲和力,结果表明,槲皮素、谷甾醇和薯蓣皂苷元等作用成分与靶点AKT1、EGFR、ESR1、SRC和MAPK等有良好的结合活性,反映了龙葵主要活性成分薯蓣皂苷元、谷甾醇和槲皮素治疗乳腺癌的主要机制可能与以上作用成分和靶点关系密切,龙葵可能通过多靶点及多信号通路对乳腺癌具有一定治疗作用。
基于分子对接研究结果,选择龙葵主要活性成分薯蓣皂苷元进行抗肿瘤实验,并验证薯蓣皂苷元对其预测靶点EGFR、AKT1的调控作用。深入探讨薯蓣皂苷元抗乳腺癌潜在的作用机制。实验结果表明,薯蓣皂苷元可抑制MDA-MB-231细胞增殖并诱导MDA-MB-231细胞凋亡,薯蓣皂苷元可下调细胞中EGFR蛋白的表达,上调AKT1蛋白的表达,值得注意的是,薯蓣皂苷元可使AKT磷酸化水平下调,同时薯蓣皂苷元能上调促凋亡蛋白Bax表达、下调抗凋亡蛋白Bcl-2表达。
综上所述,本研究应用网络药理学数据平台分析筛选龙葵主要活性成分,同时分析了龙葵治疗乳腺癌的多成分、多靶点、多通路的作用机制,并在体外进行实验验证,结果表明龙葵可能作用于AKT1和EGFR等靶点发挥治疗乳腺癌的作用,为进一步深入研究龙葵治疗乳腺癌的相关作用机制及后续龙葵临床应用研究提供思路和依据。
