辣木叶多糖对小鼠溃疡性结肠炎的防治与机制研究
2023-11-02HosameldeenMohamedHusien彭伟龙刘明江伯若楠李金贵
Hosameldeen Mohamed Husien,彭伟龙,刘明江,伯若楠,李金贵*
1扬州大学兽医学院;2江苏省高校动物重要疫病与人畜共患病防控协同中心,扬州 225009;3布尔塔那大学兽医学院,Rufaa 999129
溃疡性结肠炎(ulcerative colitis,UC)是一种病因极其复杂的非特异性、复发性结肠炎症疾病,常导致患者结肠黏膜溃疡和溃烂,出现频繁的腹痛、腹泻、便血等一系列临床症状[1],因其反复发作,迁延难愈,严重影响了患者的正常生活,并且还会增加病人继发感染和患结肠癌的风险。Eric等[2]研究表明,UC发病机制与肠屏障功能的受损和肠道微环境的改变密切相关。当肠黏膜屏障受损时,肠道固有层中的免疫细胞暴露在外界抗原和病原体中,激活的免疫细胞在机体内产生炎症级联反应,引起T细胞亚群介导非特异性Th2免疫反应[3],同时TLR4与衔接蛋白MyD88进行信号传导,导致NF-κB的激活,促进白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等促炎因子的表达[4],破坏肠道免疫稳态,进一步损伤肠腔上皮细胞。同时,肠道菌群的组成对免疫系统发育和功能具有重要影响[5],当肠道内有益菌群和致病菌群数量比例失调时,导致毒素、肠腔细菌和抗原进入机体,加剧UC患者肠黏膜炎症和过度的氧化应激反应[6]。这提示针对炎性因子和肠道菌群进行干预是防治UC的有效靶点。
辣木(Moringaoleifera),原产于印度,其广泛种植于非洲、亚洲的热带和亚热带地区[7],近年来大面积种植于我国的云南广西地区,于2012年被中国卫生部批准认定为新资源食品,也是我国重要的药食两用的食品资源。辣木叶的营养价值极高,长期服用辣木叶食品可以提高人体免疫力,同时具有一定疾病预防的作用[8]。其主要的生物活性成分为多酚、黄酮和多糖类物质,并发挥着显著的抗炎[9]、抗氧化和抗肿瘤作用。目前国内外对辣木叶多糖(Moringaoleiferaleaf polysaccharide,MOLP)的相关报道较少,还局限于传统提取工艺的优化和化学组成分析,关于MOLP对肠炎的防治效果尚不明确。因此,本试验采用DSS诱导建立UC小鼠模型,观察MOLP对急性结肠炎小鼠体内炎症反应和肠道菌群的改善效果,旨在明确MOLP对UC防治作用机制,以期为MOLP的药理学研究和临床疾病治疗提供思路。
1 材料与方法
1.1 实验动物
体重为(20±2) g的SPF级雄性BALB/c小鼠50只,购于扬州大学比较医学中心,实验动物生产许可证号为SCXK[苏]2017-0009,实验动物使用许可证号为SYXK[苏]2017-0044,合格证编号为NO.202206249,动物饲养于SPF级动物饲养室,饲养环境温度为(24±2) ℃,相对湿度为(60±10) %,12 h明暗循环。试验过程中小鼠均饲喂商品鼠粮,自由采食与饮水,实验程序符合扬州大学兽医学院实验动物伦理委员会的批准(编号YZUDWLL-202206-008)。
1.2 药物与试剂
辣木叶(云南孺子牛生物科技有限公司,Lot NO:210523);DSS(MW:36 000-50 000,美国MP Biomedicals公司,Lot NO:S6132);HE染色试剂盒(北京索莱宝科技有限公司,Cat NO:G1120);RNA-easy isolation Reagent、HiScript II Q RT SuperMix for qPCR (+gDNA wiper)(Lot NO:11141ES60) 和ChamQTM SYBR?qPCR Master Mix(南京诺唯赞生物科技有限公司,Lot NO:11201ES08);透析袋(上海源叶生物科技有限公司,Cat NO:SP132594)髓过氧化物酶(MPO)试剂盒(南京建成生物工程研究所,Cat NO:A044-1-1);IL-1β(Cat NO:ck-E20174)、IL-10(Cat NO:ck-E20162)、TNF-α(Cat NO:ck-E20852)、HMGB1(Cat NO:ck-E20318) ELISA试剂盒(上海酶联生物科技有限公司);抗体TLR4(14358s)、MyD88(4283s)、P-IκBα(2859s)、IκBα(4812s)、P-p65(3033s)、p65(8242s)、β-actin(4970s)(Cell Signaling Technology公司);FITC标记羊抗兔(A0562)和Cy3标记的山羊抗兔二抗(A0516)(北京碧云天生物技术有限公司)。
1.3 主要仪器
RM2125RTS石蜡切片机(Leica公司);DM正置荧光显微镜(Leica公司);荧光定量PCR仪(Bio-Rad公司);恒温金属浴(卡尤迪生物科技有限公司);ChemiScope化学发光成像系统(上海勤翔科学仪器有限公司);超纯水系统(Merck Millipore公司);Epoch酶标仪(Biotak公司)。
1.4 方法
1.4.1 MOLP的制备
辣木叶按照Sharma等[10]研究报道的方法,将新鲜辣木叶超微粉碎后,在70 ℃条件下加去离子水以1∶10的比例提取辣木叶粗多糖三次,每次90 min,经4 000 r/min离心20 min,将上清液合并后经旋转蒸发仪减压浓缩至50 mL。随后用300 mL 95%乙醇沉淀多糖,并在4 ℃条件下静置过夜,将沉淀复溶于去离子水中,装入透析袋(截止分子量3 500 Da)中4 ℃透析2 d后使用Sevage法(Sevage试剂∶多糖水溶液=1∶4)除去蛋白,重复萃取10次直至茚三酮反应为阴性,最后冷冻干燥得到MOLP。经苯酚-硫酸法测得糖含量为64.8%。
1.4.2 动物分组、造模及给药
50只小鼠预饲养3 d后,称重并随机分成正常对照组(Con组)、模型对照组(DSS组)、MOLP 25 mg/kg、50 mg/kg、100 mg/kg组(MOLP-L、MOLP-M、MOLP-H组)。除Con组饮用蒸馏水外,其余各组均饮用4% DSS(W/V)溶液7 d,建立小鼠UC模型。药物处理组自造模第一天开始给予相应药液进行灌胃,每只0.2 mL/d,连续给药7 d。
1.4.3 小鼠一般状况及疾病活动指数(DAI)评分
每天观察记录小鼠的体质量、粪便隐血情况和粪便状态等一般状况,参照Coope等[11]介绍的方法进行DAI评分,详细DAI评分细则见表1,计算公式为:DAI=(体质量下降率+粪便性状得分+粪便隐血得分)/3,体质量下降率=(每日体质量-初始体质量)/初始体质量×100%;使用联苯胺冰醋酸法检测粪便是否隐血或带血,当DAI评分达到0.5分以上时表示小鼠UC模型造模成功。
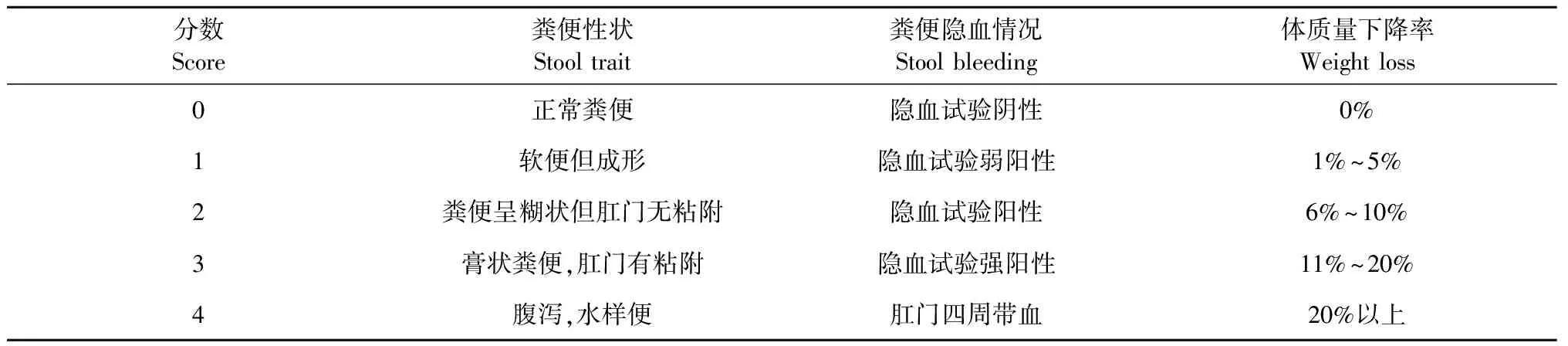
表1 疾病活动指数评分标准
1.4.4 样本采集
试验结束后,将小鼠通过异氟烷进行麻醉,从小鼠眼眶静脉丛采集血液于1.5 mL EP管中,3 000 r/min 离心10 min,吸取血清冷贮,用于后续ELISA试验。待完全麻醉后用脱颈椎的方式处死小鼠,剖开腹腔,剪取距肛门1 cm处带有回盲瓣的结肠,拍照观察结肠长度;剪取距肛门1 cm处结肠组织约2 cm于4% 多聚甲醛中固定,用于后续HE染色和免疫荧光试验;取Con、DSS、MOLP-H组小鼠结肠内的粪便至冻存管中,待提取粪便中细菌的DNA,以供肠道菌群检测;剩余各组结肠组织置于冻存管中,液氮保存,用于后续qPCR以及蛋白相关检测试验。
1.4.5 HE染色观察结肠组织病理学变化及病理损伤评分
取4% 多聚甲醛溶液中固定的结肠组织经脱水处理、透明、石蜡包埋、修蜡及切片等步骤经HE染色后置于显微镜下观察结肠组织病理形态学变化并拍照,参照Cai等[12]方法进行病理损伤评分,标准如下:(1)炎症严重程度:0分=无;1分=轻度;2分=中度;3分=重度。(2)损伤深度计分:0分=无;1分=黏膜;2分=黏膜及黏膜下层;3分=全层。(3)隐窝损伤评分:0分=无;1分=1/3基底部隐窝破坏;2分=2/3基底部隐窝破坏;3分=隐窝消失但上皮存在;4分=隐窝及上皮全部破坏。
1.4.6 血清中炎性因子的检测以及结肠组织中MPO含量测定
采用ELISA试剂盒检测各组小鼠血清中TNF-α、IL-1β、IL-10和HMGB1的含量,使用MPO试剂盒检测各组小鼠结肠组织中MPO含量。
1.4.7 结肠组织中炎性因子的mRNA表达水平
取冻存的小鼠结肠组织100 mg于EP管中,按照RNA提取试剂盒说明书的方法提取RNA,然后将其反转录成cDNA后,进行荧光定量PCR扩增,引物序列见表2。按照荧光定量试剂盒说明书预混20 μL反应体系,反应程序:95 ℃ 2 min预变性;95 ℃变性10 s,58 ℃反应30 s,进行40个循环;然后95 ℃反应15 s,60 ℃反应1 min,95 ℃反应15 s。该实验用β-actin为内参基因,采用2-△△Ct法对Ct值进行相对定量分析。
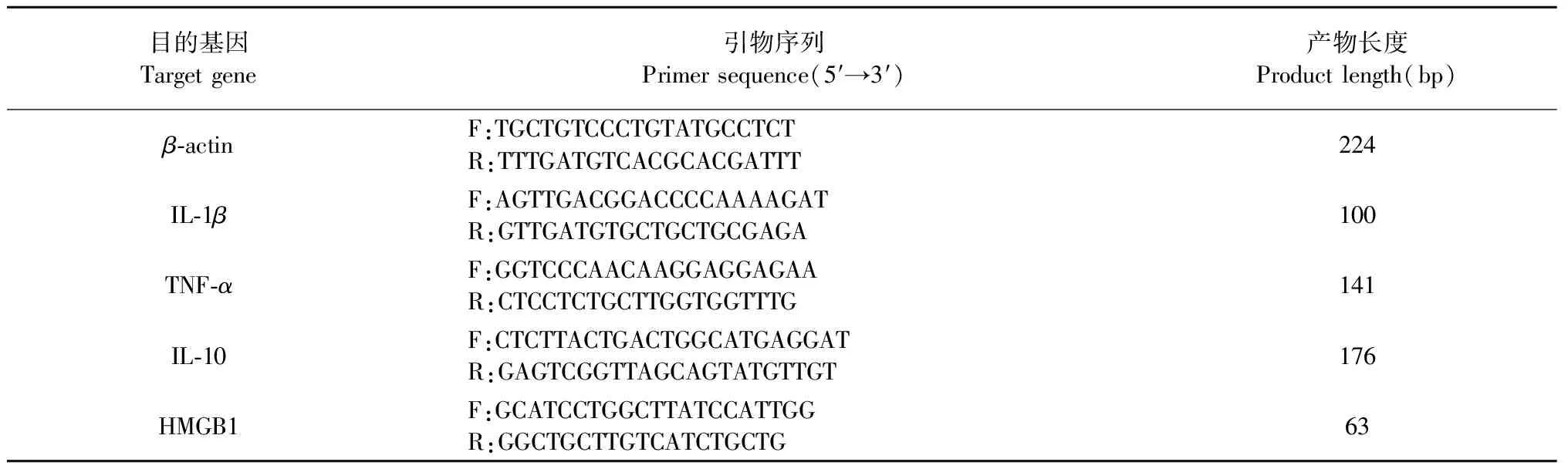
表2 qPCR引物序列
1.4.8 Western blot法检测结肠组织NF-κB信号通路相关蛋白表达情况
将100 mg冻存的结肠组织剪碎研磨后加入RIPA裂解液充分裂解,离心收集上清液,进行BCA蛋白浓度测定,然后将蛋白稀释至相同浓度后置于沸水中煮沸10 min使蛋白变性。每个样品取10 μL进行SDS-PAGE凝胶电泳,电转至PVDF膜后使用5%脱脂奶封闭2 h,随后分别使用TLR4、MyD88、P-IκBα、IκBα、P-p65、p65、β-actin抗体(稀释比例均为1∶1 000)4 ℃孵育过夜。次日加入二抗(稀释比例为1∶5 000)室温孵育2 h,经TBST洗膜三次后使用ECL显影仪检测蛋白表达情况。以β-actin为内参,利用Image J软件分析蛋白灰度值。
1.4.9 鼠粪便中细菌DNA的提取及测序
采用CTAB方法对各组小鼠结肠内容物样本的基因组DNA进行提取,利用1%琼脂糖凝胶电泳和超微量分光光度计检测DNA提取纯度和浓度,随后根据测序区域的选择,针对16S rRNA基因V4-V5可变区合成特异性引物并对引物进行PCR扩增。PCR扩增产物检测合格后,对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物,然后进行文库构建。构建好的文库经过Qubit和qPCR定量,文库合格后,使用NovaSeq6000进行上机测序。
1.4.10 数据统计学分析
采用GraphPad Prism′s one-way ANOVA检测进行统计分析,试验结果均用平均值±标准误表示,P<0.05表示差异具有统计学意义。
2 结果
2.1 MOLP对UC小鼠一般状况以及DAI评分的影响
Con组小鼠的饮食和状态正常,体重稳定增长,粪便呈麦粒状,DAI评分为0。DSS组小鼠在第3~4 d开始出现被毛粗乱、精神状态变差、体重下降、粪便黏稠并且出现轻微糊肛现象;第5~7 d粪便带血严重、肛门处粪便黏连、畏寒、体重下降,结肠长度和DAI评分与Con组相比显著升高(P<0.001)。各用药组腹泻和血便情况明显减轻,精神状态得到改善,体重有不同程度的增长,MOLP-M与MOLP-H组结肠长度和DAI评分与DSS组相比均显著降低(P<0.001),详见表3。

表3 各组小鼠平均体重变化率、疾病活动指数和结肠长度
2.2 MOLP对UC小鼠结肠组织病变及其形态结构的影响
图1A为小鼠结肠HE染色100×所显示图片,来观察小鼠结肠组织学改变情况。Con组的小鼠肠腺结构正常,杯状细胞数量多,隐窝完整、排列有序;DSS组小鼠黏膜下层明显水肿(黑色箭头所示位置),肠隐窝结构被破坏、变形、排序紊乱(※所示位置),黏膜层和黏膜下层有大量炎性细胞浸润,少数可达肌层(红色箭头所示位置);各剂量MOLP组能够改善炎症引起的组织学改变,但MOLP-L和MOLP-M组小鼠的结肠仍可见多处炎性细胞浸润,隐窝结构被破坏,MOLP-H组改善效果最为明显,肠绒毛形态完整,腺体层次清晰可见,溃疡症状减轻。

图1 各组小鼠结肠组织病理学观察
病理损伤评分情况:与Con组相比,DSS组小鼠结肠组织病理损伤评分显著升高(P<0.001);相比于DSS组,经MOLP处理后小鼠的结肠损伤状况得到明显改善,MOLP-M和MOLP-H组小鼠结肠损伤评分显著降低(P<0.001)。
2.3 MOLP对UC小鼠血清中炎性因子和结肠组织MPO含量的影响
如表4所示,与Con组相比,DSS组小鼠血清中IL-1β、TNF-α、HMGB1和组织中MPO含量显著上升(P<0.001),IL-10含量显著降低(P<0.001);与DSS组相比,MOLP处理组炎性因子和MPO的含量得到改善,尤其是MOLP-H组小鼠血清中IL-1β、TNF-α、HMGB1和组织中MPO含量相比于DSS组均显著下降(P<0.001),IL-10含量显著上升(P<0.001)。

表4 各组小鼠血清中IL-1β、TNF-α、IL-10、HMGB1和结肠组织MPO水平
2.4 MOLP对UC小鼠结肠组织炎性因子mRNA表达量的影响
DSS组小鼠结肠组织中促炎因子IL-1β、TNF-α、HMGB1的mRNA表达量与Con组相比均显著增加(P<0.001),抗炎因子IL-10的mRNA表达量则显著降低(P<0.001);使用MOLP干预后,IL-1β、TNF-α、HMGB1的mRNA表达量明显降低,IL-10的mRNA表达量也有升高,且随着MOLP剂量的增加,作用效果更显著,与DSS组相比具有显著差异(P<0.1,P<0.01,P<0.001)(见表5)。

表5 各组小鼠结肠组织IL-1β、TNF-α、IL-10、HMGB1 mRNA表达量
2.5 MOLP对UC小鼠结肠组织中NF-κB信号通路相关蛋白表达的影响
与Con组相比较,DSS组小鼠结肠组织中P65和IκBα的磷酸化增多并且p-P65/P65和p-IκBα/IκBα的比值显著增加(P<0.001),TLR4、MyD88蛋白表达量也显著上升(P<0.001)(见表6);与DSS组相比较,MOLP-M和MOLP-H组均能明显下调TLR4、MyD88蛋白的表达(P<0.1,P<0.001),其中MOLP-H组还可以显著下调p-P65/P65和p-IκBα/IκBα蛋白的比值(P<0.1)(见图2)。

图2 各组小鼠结肠组织TLR4、MyD88、P65、p-P65、IκBα、p-IκBα蛋白表达

表6 各组小鼠TLR4、MyD88、p-P65/P65和p-IκBα/IκBα蛋白表达量
2.6 小鼠结肠粪便16S rRNA测序及多样性分析
稀释曲线可以直接反映测序数据量的合理性并反映样本中物种的丰富程度,当曲线趋于平坦时,说明测序数据量渐进合理(见图3A)。采用Venn图分析OTUs(operational taxonomic unit)数量及不同组之间共有或特有的OTUs数量,Con组、DSS组和MOLP组特有OTUs分别为935、296、430个,总OTUs分别为3 109、2 628、2 714个,共有OTUs为1 526个,占总OTUs的18.06%。与Con组相比,DSS组小鼠肠道菌群物种丰度降低,经MOLP处理后丰富度有所改善(见图3B)。以Observed species和Shannon指数分析组间物种多样性差异是否显著,结果显示,DSS组Observed species和Shannon指数与Con组相比显著降低(P<0.05,P<0.01),经MOLP处理后则明显升高(P<0.1,P<0.001)(见图3C、3D)。
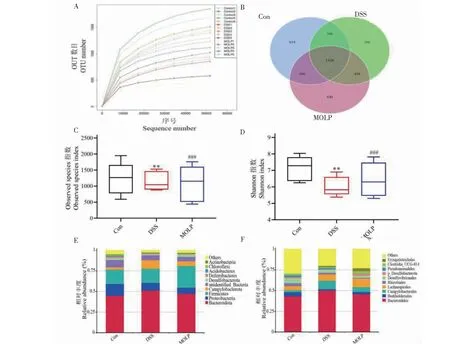
图3 各组小鼠肠道菌群多样性分析
选取在门(Phylum)水平上最大丰度排名前十的各组小鼠肠道菌群结构组成进行分析发现,DSS组弯曲菌门(Campylobacterota)相对丰度(10.49%)高于Con组(2.69%),经MOLP处理后则明显降低(5.58%);拟杆菌门(Bacteroidetes)相对丰度经MOLP处理后(48.05%)比DSS组(51.79%)低且接近于Con组(44.94%);而MOLP组厚壁菌门(Firmicutes)相对丰度(25.58%)明显高于Con组(17.51%)和DSS组(16.49%)(见图3E)。
在目(Order)水平分析各组小鼠的肠道菌群结构,拟杆菌目(Bacteroidales)的相对丰度最高,DSS组为50.76%,MOLP组与Con组接近,分别为46.39%和43.18%;弯曲菌目(Campylobacterales)的相对丰度在各组中占比趋势与拟杆菌目相似,经MOLP处理后(5.85%)相比于DSS组有所降低(10.49%),接近于Con组(2.69%);同时毛螺菌目(Lachnospirales)相对丰度(9.27%)明显高于Con组(4.58%)和DSS组(6.49%)(见图3F)。
3 讨论与结论
近年来,UC在全世界的发病率呈现逐年升高的趋势,相比于欧洲国家,中国的UC发病率增长更快。现代医学在临床治疗过程中多用糖皮质激素、水杨酸制剂和免疫抑制剂来对UC进行干预治疗[13],但停药后易复发和严重的药物副作用使其成为医学界棘手的问题。随着临床应用的不断深入,纯天然来源的植物多糖以其安全性、可及性、抗炎活性和高效的免疫增强功效受到关注[14]。辣木叶多糖作为辣木叶中有效活性成分之一,对它的功能活性研究主要集中在降血脂、降血糖、抗肿瘤和抗氧化[15]等方面,为了探究MOLP对肠炎的防治作用,本试验应用DSS建立UC模型并予以治疗。结果显示,造模后小鼠出现腹泻、血便、体重下降等症状,DAI评分升高,结肠长度变短等现象,提示造模成功,效果较为明显。经MOLP处理后可以显著改善UC小鼠的体重下降情况,降低DAI评分,减轻结肠黏膜受损和炎性浸润,下调小鼠血清和结肠中促炎因子IL-1β、TNF-α、HMGB1的水平,上调抗炎因子IL-10的水平,同时抑制P65和IκBα的磷酸化,防止TLR4/NF-κB信号通路的过度激活,维持肠道菌群稳态,通过抑制机体炎症反应和调节小鼠肠道菌群结构来发挥对UC的防治作用。
炎性细胞因子在UC发生发展过程中是不可缺少的一部分,它由免疫细胞产生,通过免疫细胞间的相关作用,刺激抗原特异性效应细胞的增殖以及介导局部和全身炎症[16]。正常情况下,巨噬细胞对炎症信号应答较弱,在免疫抑制的细胞中较少促进其产生[17],然而在UC发病期间,活化的巨噬细胞和树突状细胞分泌各种细胞因子如TNF-α、INF-γ、IL-1β、IL-10等用于调控炎症反应,这些细胞因子浓度的上调或者过度激活都会导致T细胞失调和Treg/Th1、Th2、Th17失衡[18],促进中性粒细胞在炎性部位的积累,减少上皮细胞中电解质的分泌,增加膜的通透性,进一步加剧炎症反应。用于治疗UC的药物和天然产物可有效的缓解炎性因子浓度和表达水平的失调,Xiao等[19]研究发现苦豆子总碱可通过调节UC小鼠体内促炎因子IL-1β、IL-23、IL-17水平,升高抗炎因子IL-10水平来缓解炎症。本研究通过对UC小鼠血清中IL-1β、TNF-α、HMGB1和IL-10的检测发现,MOLP可以明显抑制促炎因子的表达,上调抗炎因子的水平,同时通过实时荧光定量PCR技术对组织炎性因子的检测结果显示,MOLP还可有效缓解UC小鼠结肠组织中IL-1β、TNF-α、HMGB1 mRNA的表达,增加IL-10 mRNA的表达。此外MPO是中性粒细胞的特征性酶,由中性粒细胞或某些组织的巨噬细胞分泌的血红蛋白酶,是血红素过氧化物酶家族成员[20],我们可以通过检测小鼠结肠组织中MPO的活性来评判组织中中性粒细胞的浸润程度。结果显示MOLP可以显著抑制UC小鼠MPO的活性,减少中性粒细胞在结肠组织中的数量。上述炎性因子的生成和MPO活性的升高与TLR4/NF-κB信号通路的核心地位密不可分,TLR4在天然免疫中识别病原微生物和控制获得性免疫反应中起着重要的作用[21],当TLR4被激活后由衔接蛋白MyD88进行信号转导,诱导IκB磷酸化并泛素化和降解,释放NFκB p50/p65二聚体[22],活化的二聚体进入细胞核,立即启动多种细胞因子的转录,导致IL-1β、TNF-α等数量增加,使炎症持续并不断扩大。Zhang等[23]发现UC小鼠结肠部位NF-κB信号通路被过度激活,靶向抑制NF-κB信号通路激活的治疗方法来缓解UC是有效的。本研究发现,相比于Con组,DSS组小鼠结肠组织MPO活性明显升高,TLR4、MyD88蛋白表达显著增加,p-P65和p-IκBα蛋白上调,p-P65/P65和p-IκBα/IκBα的比值也随之增加,使用MOLP处理后上述异常表达情况得到有效抑制,这提示MOLP可以通过抑制TLR4/NF-κB信号通路的过度激活从而抑制炎症因子的异常表达来发挥对UC的防治作用。
在正常情况下,肠道具有完善的屏障功能,肠道菌群同肠上皮层、黏液层、肠道淋巴系统一起构成肠黏膜机械、化学和生物屏障[24],能防止肠腔内致病性抗原侵入机体,维持机体正常运行,当肠道发生炎症时,肠道菌群失调,肠屏障被破坏,肠道通透性增加,进而有害菌及其代谢产物内毒素等会被吸收入血,进一步加重黏膜上皮细胞的损伤和黏膜屏障的破坏,由此形成恶性循环,导致UC反复发作[25]。本研究通过16S rRNA基因测序探究MOLP对UC小鼠肠道菌群的影响,发现MOLP可以提高UC小鼠肠道菌群的多样性,恢复Campylobacterota和Bacteroidetes比例,调节不同菌群的相对丰度,促进肠道菌群结构向正常水平恢复。消化系统中最常见两大菌门为Firmicutes和Bacteroidetes,有研究发现肠炎小鼠Firmicutes和Bacteroidetes会明显减少[26],而经MOLP处理后则明显缓解了两大优势菌群失调的状态,这与Sun等[27]报道紫甘薯多糖可以缓解由于DSS造模引起的UC小鼠Firmicutes和Bacteroidetes比值降低的结果类似,提示增加该两种优势菌群的比例可能对肠炎小鼠有保护作用。进一步的研究分析表明,丁酸盐可提供肠道内的酸性环境从而抑制有害菌的生长,维持电解质的平衡,促进黏膜炎症的修复[28]。丁酸盐在体内主要由肠道中的Firmicutes细菌产生,增加Firmicutes的数量对肠道炎症具有保护作用,本研究发现MOLP可以促进UC小鼠中Firmicutes数量的增多,激发有益菌的微生物活性来抑制致病菌的生长。
本试验结果表明,在DSS诱导的UC小鼠模型中,MOLP可以明显缓解UC小鼠的结肠缩短、体重下降、DAI评分升高现象,降低UC小鼠血清和结肠组织中促炎因子IL-1β、TNF-α、HMGB1的水平,调节TLR4/NF-κB的过度激活并调节UC小鼠肠道菌群的多样性、组成和相对丰度,从而发挥对UC预防保护作用。今后下一步将会从化学屏障、免疫屏障等方面多角度探讨MOLP对UC的作用,本研究以期为辣木叶的开发利用以及MOLP的抗炎效果提供新的思路。
