PARP-1基因多态性与妊娠期高血压的相关性及潜在分子机制研究*
2023-11-02林开荣胡宏媛刘晓燕
林开荣,胡宏媛,刘晓燕
万宁市人民医院产科,海南万宁 571500
流行病学调查显示,妊娠期高血压(HDP)是导致全球孕产妇不良事件和新生儿不良结局的主要原因[1]。相关报道表明,HDP具有家族遗传倾向,许多遗传基因在HDP的发生发展中扮演者重要角色[2]。目前研究证实,包括一氧化氮合成酶(eNOS)、促红细胞生成素(EPO)及肿瘤坏死因子-α(TNF-α)等多种基因多态性与HDP进展密切相关[3-4],但HDP发生的潜在风险及分子机制仍需进一步研究。多聚ADP核糖转移酶(PARP-1)是PARP家族中的重要成员,其主要作用为DNA的损伤修复、调节细胞凋亡。有研究表明,PARP-1的不同位点的单核苷酸多态性变化与许多疾病的遗传易感性相关,特别是rs1805407、rs1805414、rs3219090 3个位点;然而,PARP-1与HDP的相关性及其在HDP中的调控机制尚鲜见报道[5]。有研究还显示,PARP-1可以在炎症反应中发挥中介效应,通过核因子-κB(NF-κB)信号通路介导组织炎症损伤、病理生理变化等过程[6]。作为一种核转录因子,NF-κB已经被证实参与了机体的免疫调节、基因转录和凋亡[7]。NF-κB信号通路的调节作用在肿瘤发生、炎症反应及自身免疫性疾病、重症感染方面发挥着重要作用[8]。由于HDP本身的特征也是机体的过度炎症反应,因此,NF-κB可能在PARP-1参与HDP发病中起到了一定作用。本研究拟探讨PARP-1基因多态性与HDP的相关性,同时基于NF-κB通路探讨其潜在的分子机制。
1 资料与方法
1.1一般资料 纳入2021年8月至2022年6月在本院就诊的80例HDP孕妇作为HDP组,以及同期80例健康孕妇作为对照组。纳入标准:(1)HDP诊断符合《妊娠期高血压疾病诊治指南(2020)》[9];(2)单胎妊娠;(3)无其他妊娠期并发症。排除标准:(1)妊娠前存在高血压及合并系统性红斑狼疮、干燥综合征、类风湿性关节炎等免疫系统疾病者;(2)恶性肿瘤及合并严重脏器功能障碍的患者;(3)人工授精、试管婴儿等辅助生殖技术受孕者;(4)存在交流障碍或精神类疾病者。本研究获得本院伦理委员会批准,符合赫尔辛基宣言,所有孕妇知情同意,并签署书面文件。
1.2资料收集 收集两组孕妇年龄、体重指数(BMI)、孕周、胎次、家庭收入、受教育水平等一般资料。两组孕妇年龄、BMI、孕周等比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组一般资料比较或n)
1.3实验室指标检测 于孕中期(14~18周)时抽取孕妇静脉血5 mL,采用电化学发光免疫分析法检测两组孕妇血管内皮生长因子受体-1(sFlt-1)和胎盘生长因子(PLGF),计算sFlt-1/PLGF;(2)于孕22~26周时,结合产科三维超声检查测定孕妇子宫动脉搏动指数(UAPI),以两侧UAPI的平均值为衡量指标。
1.4PARP-1基因多态性分析 在禁食12 h后,采集孕妇肘静脉血5 mL,乙二胺四乙酸(EDTA)抗凝后分成3 mL和2 mL两份,2 mL血液标本用作提取DNA进行不同位点单核苷酸多态性检测,3 mL血液标本静置后置于4 ℃冰箱内保存,用以测定血清中PARP-1、NF-κB、髓样分化因子88(MyD88)和Toll样受体7(TLR7) mRNA蛋白表达情况。单核苷酸多态性检测方法如下:(1)取2 mL EDTA抗凝管血液,3 000 r/min离心5 min(离心半径7.5 cm)分离血浆,-70 ℃冰箱冷藏。(2)采用PCR-限制性片段长度多态性分析(PCR-RFLP)法测定PARP-1基因rs1805407、rs1805414、rs3219090 3个位点的单核苷酸多态性,具体操作步骤如下:①按常规酚-氯仿抽提方法提取外周血DNA。②应用Primer3软件设计3个基因不同位点引物,由美国AB公司设计合成。rs1805407位点的上游引物序列为5′-TAGGGTTGGGTCTAGAGCTTG-3′,下游引物序列为5′-ACAGAGCAGAAACACCAAGAT-3′;rs1805414位点的上游引物序列为5′-TGCTTCCCTTGCTCCTGGTTC-3′,下游引物序列为5′-GGGGGCAAGGTCTGTTAGTGG-3′;rs3219090位点的上游引物序列为5′-TACGATCTATGCGACCTGAC-3′,下游引物序列为5′-CGAGTTCAGTTGCTGCATC-3′。探针序列为FAM-TATGCCAGTCTTACCTGCTG-MGB,HEX-AC TACTCTGAATGCAGCTGCT-MGB。③PCR反应体系:共25 μL,包括10 pmol/L引物1 μL,DNA模板约2 μL,200 μmol/L dNTPs 20 μL,1 U Taq聚合酶1 μL,1.5 mmol/L MgCl21 μL。PCR反应条件:96 ℃预变性 6 min,94 ℃ 40 s,52 ℃ 60 s,72 ℃ 50 s,共35个循环;72 ℃延伸7 min。采用琼脂糖凝胶电泳鉴定PCR扩增产物。④限制性内切酶MspⅠ、CviQ Ⅰ酶解。⑤采用琼脂糖凝胶电泳鉴别基因型。⑥紫外光照相仪进行拍照。采用Bio-Rad C FX manager 3.0 软件进行基因型分析。采用Apaman探针实时荧光PCR技术检测3个位点的基因型。
1.5PARP-1基因和NF-κB通路蛋白及mRNA表达水平检测
1.5.1实时荧光定量PCR(qPCR)检测PARP-1、NF-κB、MyD88、TLR7的mRNA表达水平 取3 mL血液标本采用密度梯度离心法分离出单个核细胞(PBMC),分别装在100 μL EP管中,-70 ℃保存;然后用胰蛋白酶消化细胞质,保留细胞核。采用Trizol试剂盒提取外周血PBMC中的总RNA,采用逆转录试剂盒将其逆转录为cDNA,然后采用PCR仪进行PCR反应。PCR反应体系为10 μL:100 ng/μL的cDNA 0.5 μL,SYBR Green Master Mix 5 μL,10 μmol/L的上、下游引物各0.4 μL,RNase-Free H2O 3.7 μL。PCR反应条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 20 s,共40个循环。采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。Trizol试剂盒由瑞士Roche公司提供,PCR仪由美国Bio-Rad公司提供,SYBR Green Master Mix试剂盒由赛默飞世尔科技(中国)有限公司提供,PCR引物由上海科瑞生物科技有限公司提供,引物序列见表2。

表2 PCR引物序列
1.5.2Western blotting法检测PARP-1、NF-κB、MyD88和TLR7蛋白表达 采用BCA试剂盒检测蛋白浓度。将HDP组患者的单核巨噬细胞培养于含10%胎牛血清(四季青公司)的培养基中,置于37 ℃、5%CO2培养箱中培养,24 h后胰酶消化。使用细胞裂解液裂解并收集蛋白样品,取总蛋白20 μg,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,然后将蛋白电转至PVDF膜上。采用质量分数为5%的脱脂奶粉室温封闭2 h,加入1∶500稀释的一抗[兔抗人PARP-1、NF-κB、MyD88和TLR7单克隆抗体(美国Santa Cruz公司),鼠抗人β-actin单克隆抗体(北京中杉金桥生物技术有限公司)],4 ℃孵育过夜;TBST洗膜,加入辣根过氧化物酶(HRP)标记的羊抗鼠二抗(1∶1 000),室温孵育2 h;TBST洗膜后,使用ECL化学发光试剂避光反应15 min。应用Tanon 4600全自动化学发光图像分析系统进行蛋白显影,应用Image J图像分析软件对条带进行分析。以β-actin为内参,获得PARP-1、NF-κB、MyD88、TLR7蛋白相对表达量。同时,分别在3、6、12、24 h 4个细胞培养时间点检测PARP-1蛋白表达情况。实验均重复3次,取平均值作为最终结果。

2 结 果
2.1两组孕妇实验室指标、PARP-1基因多态性和相关基因表达情况比较 HDP组sFlt-1、sFlt-1/PLGF水平,PARP-1 mRNA、TRL7 mRNA、MyD88 mRNA和NF-κB mRNA相对表达量,以及PARP-1、TRL7、MyD88和NF-κB蛋白相对表达量均高于对照组,PARP-1基因rs1805414位点CC基因型频率高于对照组,差异均有统计学意义(P<0.05),见表3、4及图1~3。
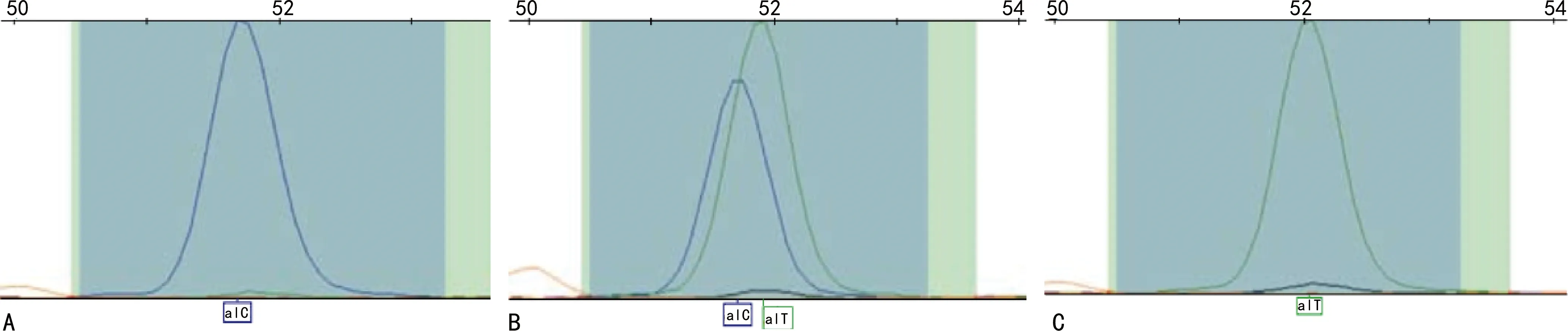
注:A为CC基因型;B为TC基因型;C为TT基因型。图1 rs1805414多态位点基因型分布
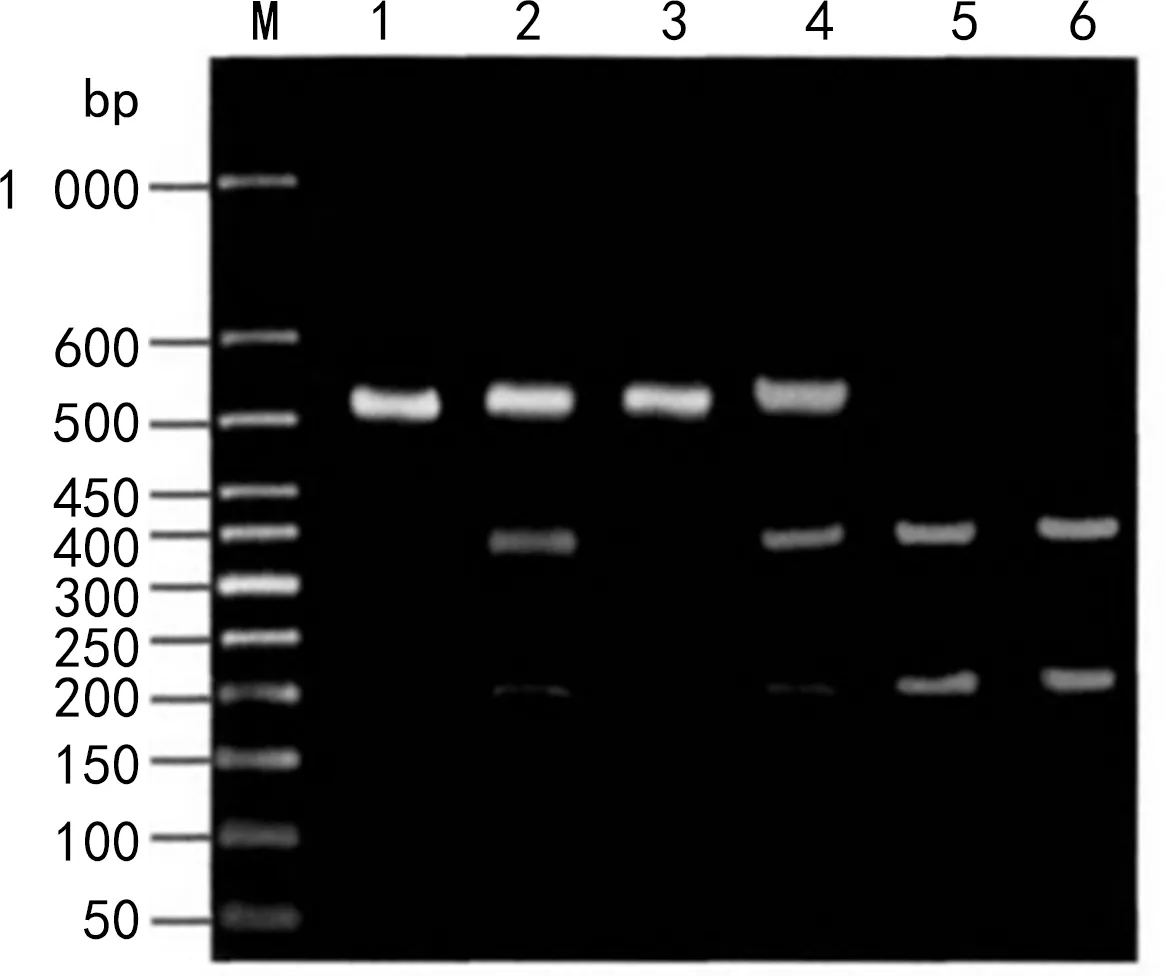
注:M为marker,1、3为CC基因型,2、4为TC基因型,5、6为TT基因型。图2 rs1805414多态性位点PCR-RFLP法酶切电泳图

注:A为HDP组随着培养时间的增长,PARP-1 mRNA相对表达量逐渐增加,在6、24 h最为明显;B为HDP组PARP-1蛋白表达量逐渐增加,但是这种增加与mRNA在变化时间上并不完全一致;C为HDP组蛋白酶激活受体(PAR)蛋白表达量逐渐增加。图3 PARP-1蛋白表达和PAR蛋白修饰

表3 两组实验室指标、PARP-1基因多态性比较或n)
表4 两组PARP-1、NF-κB、MyD88和TLR7 mRNA和蛋白表达情况比较
2.2影响HDP发病风险的Logistic回归模型分析 Logistic回归模型分析显示,sFlt-1/PLGF(OR=1.236)、PARP-1 mRNA(OR=107.998)及PARP-1基因rs1805414位点CC基因型(OR=3.788)是HD患者发生子痫前期(PE)的独立危险因素(P<0.05)。见表5。
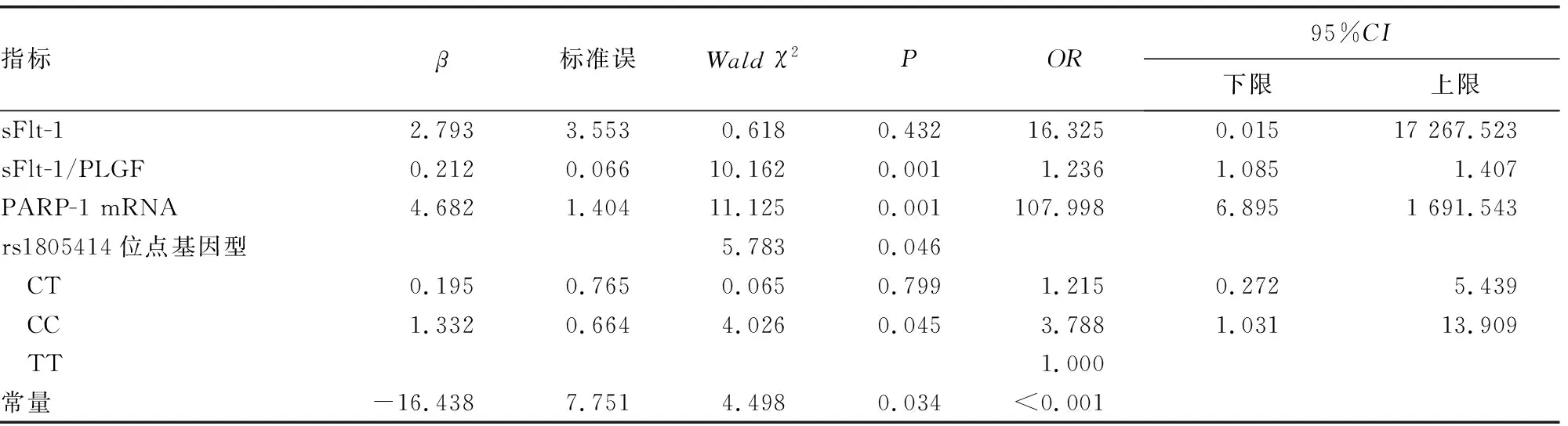
表5 影响HDP发病风险的Logistic模型回归分析
2.3PARP-1表达与NF-κB通路关键蛋白及mRNA相对表达量的相关性 Pearson相关性分析显示,PARP-1 mRNA与TRL7、MyD88和NF-κB mRNA相对表达量呈正相关(r=0.782、0.688、0.903,均P<0.001);PARP-1蛋白相对表达量与TRL7、MyD88和NF-κB蛋白相对表达量呈正相关(r=0.833、0.845、0.907,均P<0.001)。
3 讨 论
目前,关于HDP疾病的病因机制研究尚不明确,现有的证据表明机体免疫状态的失衡对于HDP的发生发展起着至关重要的作用[10]。另外,由于HDP存在遗传倾向,这种被证实是通过HDP易感基因之间相互作用和表观遗传学功能改变的途径来发挥作用的[11]。而关于HDP易感基因的研究主要是通过分析其基因表达情况和不同位点的单核苷酸多态性来实现的[12],通过分析不同人群中其基因频率的区别判断某个基因与某种疾病的关联性。基因学研究对于揭示HDP深层次的病因学具有一定的作用。
本研究结果显示,HDP组sFlt-1、sFlt-1/PLGF水平,PARP-1、TRL7、MyD88、NF-κB mRNA水平,以及PARP-1、TRL7、MyD88、NF-κB蛋白相对表达量高于对照组,PARP-1基因rs1805414位点CC基因型高于对照组,且经Logistic回归模型分析显示,sFlt-1/PLGF、PARP-1 mRNA及PARP-1基因rs1805414位点CC基因型是发生PE的独立危险因素。分析原因:(1)关于sFlt-1 、PLGF 、sFlt-1/PLGF与HDP的相关性有研究证实,且已被指南推荐用于早期预测[13]。胎盘生长因子具有调节滋养细胞和内皮细胞的功能,具有促进血管生成及扩血管的作用,对胎盘的正常生长发育具有重要作用;而与其高度特异性结合的受体是血管内皮生长受体-1,二者具有高度拮抗作用,健康孕妇血清sFlt-1、PLGF分泌呈峰形,到孕29~32周时达到高峰,二者呈正相关[14];而在HDP患者中存在sFlt-1分泌过多而PLGF分泌不足,导致血管生成失衡,滋养层侵袭不够,导致母体血管内皮功能障碍,最终导致HDP。(2)PARP-1作为真核细胞中多功能蛋白修饰酶家族的重要成员之一,在体内主要参与DNA修复、转录调控、信号转导等过程。近年来研究表明,PARP-1在重症感染时可出现高表达,并通过调控多效性转录调控因子NF-κB进入细胞核内,促进下游炎性因子的释放,形成细胞因子网络级联瀑布反应,导致全身炎症反应和多器官功能障碍[15]。相关研究还表明,炎症相关基因家族中的白细胞基因家族和PARP-1基因具有相关性[16],这种相关性使得PARP-1基因在机体氧化应激反应中的DNA修复、基因稳态等过程中发挥重要作用。(3)rs1805414位点作为PARP-1基因最为常见的位点,有研究指出,碱基T突变为C后导致编码的缬氨酸(Val)转换为丙氨酸(Ala),引起蛋白质结构改变进而影响PARP-1的生物学功能[17]。有研究表明,PARP-1基因rs1805414位点的CC基因型增多与许多癌症的发病风险增加有关,如胃癌、甲状腺癌、宫颈癌、口腔癌等,且该位点的SNP与癌症患者的预后也存在一定关联[18-20]。本研究结果也显示,PARP-1基因rs1805414位点CC基因型是发生PE的独立危险因素。
有研究表明,炎症反应发生发展中的一个重要过程为Toll样受体(TLRs)和其相关细胞内信号分子构成的信号通路,特别是TLR7与NF-κB信号分子是一个关键的受体信号[21]。相关研究显示,TLR7与NF-κB信号分子构成的信号通路在增加乳腺癌细胞侵袭力方面具有重要作用,TLR7的表达水平在乳腺癌细胞中急剧升高[22]。在炎症反应方面,TLR7通过MyD88依赖性或非依赖性途径(TRIF途径)启动下游信号转导,激活炎症信号。目前,MyD88在炎症介导方面的具体机制尚不清楚,但有研究显示,MyD88在乳腺炎性细胞、浆细胞中呈高表达,乳腺癌组织中的MyD88基因和蛋白表达水平也高于周围正常组织[23]。NF-κB作为一组真核细胞转录因子,几乎存在于所有有核细胞内,主要发挥调控细胞因子、黏附分子和炎症反应。一项不同HDP分期的研究中指出,重度PE患者体内NF-κB表达水平明显高于轻度PE和HDP[24],这可能是由于发生PE后胎盘局部组织发生缺血缺氧损伤,许多细胞因子、氧自由基在蛋白酶和蛋白激酶的作用下发生IKB激酶磷酸化,激活NF-κB信号通路,引起炎症反应,而炎症因子会进一步激活NF-κB信号通路形成恶性循环。本研究结果显示,PARP-1与TRL7、MyD88和NF-κB mRNA相对表达量呈正相关;PARP-1蛋白相对表达量与TRL7、MyD88和NF-κB蛋白相对表达量呈正相关。也就是说,PARP-1基因及其表达产物与NF-κB信号通路的3个关键蛋白TRL7、MyD88和NF-κB存在高度相关性,这为揭示PARP-1基因与HDP的关系提供了新的思路。有学者认为,PARP-1与NF-κB为共活化子,使用PARP-1抑制剂抑制PARP-1基因表达后也会降低促炎因子的表达[25]。也有数据表明,PARP-1与NF-κB基因的表达产物能够在体内形成一个稳定的免疫沉淀复合物[26]。动物研究表明,在心肌细胞中寄生的克鲁氏原虫能够诱导持续的PARP-1活化并与线粒体中的活性氧分子形成正反馈,导致细胞内持续的NF-κB进入细胞核,增强了NF-κB信号通路的促炎作用[27]。一项基础研究显示,采用脂多糖(LPS)作用于Ana-1细胞,LPS作用后能够促进NF-κB进入细胞核,而PARP-1抑制剂能够阻断这个过程,说明PARP-1的活化确实对NF-κB介导的信号通路起到了作用[28]。
本研究的局限性在于:仅评估了PARP-1基因3个位点的多态性及相关信号通路与HDP发病风险的关系,可能无法完全解释PARP-1基因多态性与HDP的关系,后期需要检查更多的基因位点以验证PARP-1基因多态性与HDP的关系。另外,由于HDP患者存在明显的种族差异和群体异质性,本研究对我国研究人群的参考意义较大,而对于国外其他人种的参考意义有所降低;限于样本量较小,本研究尚未对HDP不同严重程度的孕妇PARP-1基因多态性进行验证,后期需要增加样本量,针对不同严重程度的患者来论证。
综上所述,PARP-1基因表达水平及多态性与HDP发病密切相关,特别是rs1805414位点CC突变可作为HDP遗传易感性的敏感指标;NF-κB信号通路在PARP-1参与HDP发病中发挥了重要的作用。
