混合醇胺溶液耦合电石炉净化灰吸收-矿化CO2性能
2023-11-01冯敬武王毅斌马佳慧谭厚章
冯敬武,王毅斌,马佳慧,谭厚章
(西安交通大学 能源与动力工程学院, 陕西 西安 710049)
中国作为全球最大的能源生产国和消费国,2022年一次能源消费总量为54.1 × 108t 标准煤,居世界第一,其中碳排放因子最高的煤炭占比接近60%[1]。据国际能源署报道[2],2022 年中国CO2排放量已达到102 × 108t,约占世界CO2排放总量的27.7%。其中,发电供热和工业领域CO2排放量约占总量的84%,未来这些领域的碳减排任务非常具有挑战性[3]。醇胺溶液吸收法已经较为成熟且在燃煤电厂进行了成功应用[4],但该方法面临再生能耗较大的问题[5-6],未来仍需要发展高效低能耗的富CO2吸收液再生技术。
CO2吸收-矿化一体化技术(Ⅰntegrated CO2absorption-mineralization,ⅠAM)是一种极具前景的燃烧后捕集技术[7],其工艺概念见图1。首先,烟气中的CO2被吸收塔内的有机胺溶液吸收生成CO2富液,然后将CO2富液送至矿化反应塔中,在低温下与CaO 或富含CaO 工业固废反应生成CaCO3沉淀,同时有机胺溶液得到化学再生并被送回吸收塔内继续吸收CO2。ⅠAM技术采用化学再生的方式代替高温解吸,有效降低了CO2富液的再生能耗,并将CO2转化为性质更稳定的碳酸盐。
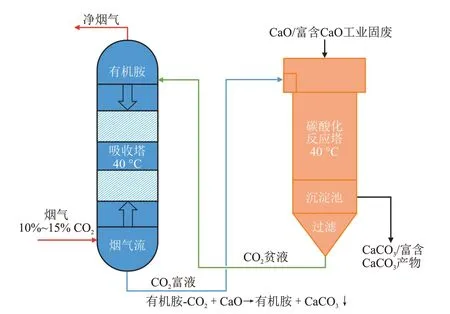
图1 CO2吸收-矿化一体化技术概念示意[7]Fig.1 Schematic diagram of integrated technology concept of CO2 absorption-mineralization[7]
目前,大部分学者主要开展了单一醇胺溶液中氧化钙(CaO)、氯化钙(CaCl2)或氢氧化钙(Ca(OH)2)的吸收-矿化一体化特性研究。ARTⅠ等[8]研究了CaCl2溶液对4种富CO2的醇胺溶液(乙醇胺(MEA)、二乙醇胺(DEA)、N-甲基二乙醇胺(MDEA)和2-氨基-2 甲基-1-丙醇(AMP))的解吸效果,发现利用CaCl2化学解吸率至少比热解吸高3 倍,但CaCl2没有实现醇胺的再生。马伟春等[9]研究了Ca(OH)2对MEA 富液中CO2解吸矿化的效果,发现Ca(OH)2对MEA富液的CO2解吸率最高可达86.62%,而且解吸后的MEA 溶液能够保留原液70%以上的吸收性能,远高于传统热解吸法(38%)。实际上,ⅠAM方法的总体动力学性能主要由胺的CO2吸收动力学特性决定[10]。单一醇胺溶液无法同时满足吸收速率快、吸收负荷大的要求[11-12],基于单一醇胺溶液的ⅠAM常常出现循环吸收-矿化CO2性能偏低的问题。然而,伯胺与叔胺的混合溶液能够克服上述缺点,提高醇胺溶液的吸收负荷和吸收速率,因此研究开始转向混胺溶液的吸收特性。ZHANG等[13]与王中辉等[14]研究了MEA + MDEA 混合醇胺溶液分别耦合CaO和Ca(OH)2后对CO2的吸收和矿化性能,发现混胺溶液经过5次吸收-矿化循环后仍具有稳定的CO2吸收性能,CaO 与Ca(OH)2对CO2富液的解吸率分别为77.40%与72.47%。利用CaO 或Ca(OH)2矿化解吸CO2富液仍然存在化学原料的消耗成本。我国电力、冶炼等领域每年会产生大量含碱固废,例如粉煤灰(750~1000 Mt/a)、电石渣(2.8 Mt/a)和钢渣(240 Mt/a)等[15-17],部分含碱固废中活性钙组分含量高。若这些含碱固废能够代替CO2吸收后混合醇胺溶液矿化再生阶段的化学原料,不但能够实现CO2富液的解吸[18-19],还能降低含碱固废的碱性并将CO2转化为固相碳酸钙,但是目前对于混合醇胺耦合碱性固废吸收-矿化CO2方面缺乏相关研究,含碱固废在富CO2混合醇胺溶液中的矿化性能与机理尚不够明确,有必要开展含碱固废对富CO2混合醇胺溶液的解吸与再生性能研究。
叔胺N,N-二甲基乙醇胺(DMEA)具有黏度低、化学碱度(pKa)高和再生热低等特点,作为CO2吸收剂在混合醇胺溶液中具有较大应用潜力[20-21]。因此,本研究以MEA/DMEA 混合醇胺溶液作为CO2吸收剂,以碱性固废电石炉净化灰作为CO2矿化原料,首先研究MEA/DMEA 混合醇胺溶液在不同配比条件下的CO2吸收和矿化性能,继而确定最优配比方式。在最优配比下,研究矿化反应时间和电石炉净化灰添加量对CO2解吸性能的影响,并对比电石炉净化灰与CaO、Ca(OH)2两种钙基物质的CO2矿化性能,结合X射线衍射仪(XRD)、场发射扫描电子显微镜(SEM)和傅里叶红外光谱仪(FT-ⅠR)等表征方式揭示3 种矿化产物的晶型与形貌及MEA/DMEA 混合醇胺溶液CO2吸收与解吸机理,最终验证混合醇胺溶液经净化灰解吸矿化的循环稳定性。
1 实验部分
1.1 实验材料
实验中使用的MEA、DMEA、CaO和Ca(OH)2均为分析纯,购自国药集团。实验所需MEA/DMEA混合醇胺溶液浓度分别为3.0 mol/L MEA、2.0 mol/L MEA + 1.0 mol/L DMEA、1.5 mol/L MEA + 1.5 mol/L DMEA、1.0 mol/L MEA + 2.0 mol/L DMEA及3.0 mol/L DMEA。不同浓度的MEA/DMEA混合醇胺溶液配制方法为:根据MEA/DMEA 混合醇胺溶液浓度和体积先计算出所需MEA 和DMEA 的质量,称取相应质量的MEA和DMEA,搅拌混合,然后由去离子水定容。1 mol/L 的硫酸溶液由质量分数为98%的浓硫酸(购自国药集团)配制。CO2吸附量滴定装置中指示剂为质量分数为1%甲基橙指示液,由分析纯级甲基橙(购自国药集团)配制。CO2气体(体积分数≥ 99.99%)与N2气体(体积分数≥ 99.99%)购自西安腾龙化工有限公司。采用的碱性固废为新疆某电石厂电石炉烟气净化装置收集的电石炉净化灰,其化学组成见表1。

表1 电石炉净化灰的化学组成[22]Table 1 Chemical composition of purified dusts from calcium carbide furnace[22]
1.2 实验装置
CO2吸收与矿化反应装置见图2,装置主体主要由CO2吸附量滴定装置、集热式磁力搅拌器、500 mL三颈烧瓶和冷凝管组成。CO2吸附量滴定装置由酸式滴定管、锥形瓶、量气筒和指示瓶组成。对于CO2吸收反应装置,由CO2气瓶、N2气瓶,以及气体对应的减压阀和质量流量计完成气体供应,并且在混合气体进入盛有混合醇胺溶液的三颈烧瓶前设有缓冲瓶。在线pH 计监测CO2吸收与矿化反应过程的pH变化。
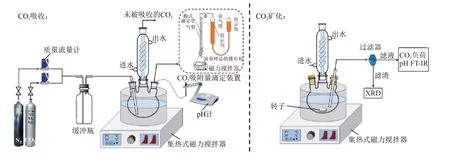
图2 CO2吸收-矿化实验装置示意Fig.2 Schematic diagram of experimental setup for CO2 absorption-mineralization
1.3 实验方法
MEA/DMEA混合醇胺溶液吸收CO2实验:先将300 mL 总浓度为3 mol/L 的混合醇胺溶液加入到500 mL三颈烧瓶中,利用集热式磁力搅拌器水浴加热至40 ℃并维持。然后持续通入体积分数15%CO2和体积分数85% N2混合而成的模拟烟气,通过质量流量计控制模拟烟气总流量为1 L/min。反应时间为180 min,前30 min每隔10 min取1 mL样品,后150 min 每隔15 min 取1 mL 样品,采用CO2吸附量滴定装置测定溶液中的CO2负荷[23],并记录溶液的pH值。
CO2吸收实验结束后,将吸收完CO2的MEA/DMEA混合醇胺溶液转移至CO2矿化反应装置中,根据不同n(CO2):n(Ca)加入钙源组分(Ca(OH)2、CaO或电石炉净化灰),设置磁力搅拌器的搅拌速率为500 r/min使电石炉净化灰与富CO2的MEA/DMEA 混合醇胺溶液充分混合反应,利用水浴加热保持反应温度为40 ℃,反应一定时间,完成CO2的解吸矿化。在反应进行至5 min、10 min、20 min、40 min 和60 min 时提取5 mL 浆液样品,先经离心机(5000 r/min)离心处理获得上清液,然后用0.2 μm 注射器过滤器过滤,对滤液采用酸式滴定和pH 计测得该时刻样品中CO2负荷和pH 值。电石炉净化灰对醇胺溶液的解吸性能采用CO2解吸率(η,%)评价,计算公式见式(1)[9,24]:
式中,c0指混合醇胺溶液初始的CO2负荷,mol/L;ct指矿化反应t时间后混合醇胺溶液的CO2负荷,mol/L。
矿化反应结束后,将剩余浆液过滤得到滤渣,用水洗去滤渣固体表面残留的醇胺溶液,烘干研磨,用于矿化产物成分与形貌分析。
1.4 分析方法
CO2吸收负荷滴定装置与Chittick装置相似,方法是通过加入过量硫酸(H2SO4,1 mol/L)溶液酸化定量样品(1 mL),然后用气体滴定管测量从样品释放的CO2体积(VCO2)。混合醇胺溶液的吸收性能采用CO2吸收负荷评价,基于式(2)计算出液体样品中的CO2负荷:
式中,c指混合醇胺溶液中CO2负荷,含义为单位体积的混合醇胺溶液中CO2的物质的量,mol/L;VCO2指所取液体样品中释放的CO2体积,mL;Vm指气体摩尔体积,22.4 L/mol;VL指所取液体样品的体积,mL;p和p0分别指实验室实际大气压力和标准大气压,Pa;T0指273.15 K;T指环境温度,K。
通过XRD(Bruker D8 advance)和SEM(JEOL 7800F Japan)确定电石炉净化灰与沉淀产物中存在的矿物相和形貌;XRD衍射条件为Cu靶,输出电压40 kV,输出电流40 mA,扫描角度10°~80°,扫描速率10 (°)/min。
使用衰减全反射-傅里叶变换红外光谱仪(ATR-FTⅠR,Nicolet iS50)测定了CO2矿化前后混合醇胺溶液中的成分与官能团,以揭示碱性固废矿化CO2同时实现混合醇胺溶液再生的机理;扫描范围为400~4000 cm-1,扫描次数为64次。
2 结果与讨论
2.1 混合醇胺溶液中MEA 与DMEA 配比对CO2吸收性能的影响
图3 给出了不同配比的MEA/DMEA 混合醇胺溶液(c(MEA):c(DMEA) = 3.0:0、2.0:1.0、1.5:1.5、1.0:2.0、0:3.0)在反应温度40 ℃条件下,CO2吸收负荷随吸收时间变化的趋势。
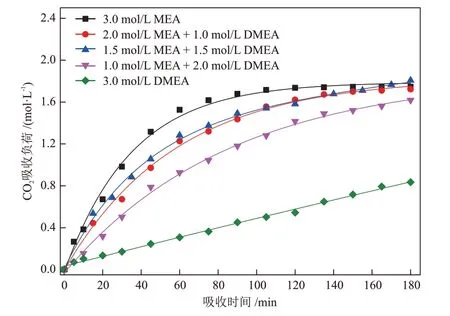
图3 不同配比的MEA/DMEA 混合醇胺溶液的CO2吸收负荷随吸收时间的变化Fig.3 Changes of CO2 absorption loads of different ratios of MEA/DMEA mixed alcohol amine solutions with absorption time
在吸收时间达到180 min 时,1.5 mol/L MEA +1.5 mol/L DMEA混合醇胺溶液表现出最大的CO2吸收负荷,约1.807 mol/L;而3.0 mol/L DMEA溶液的CO2吸收负荷仅为0.835 mol/L。此外,可发现3.0 mol/L DMEA 溶液的CO2吸收速率最慢,随着混合醇胺溶液中MEA浓度的增加,溶液对CO2的吸收速率得到提高[25]。这是因为三级胺DMEA不能直接与CO2反应,只能加速CO2的水解反应,导致较低的反应速率[26];而MEA 作为一级胺可直接与CO2反应,生成稳定的氨基甲酸根,所以加入MEA后CO2吸收速率得到提高[14]。
2.2 混合醇胺溶液中MEA 与DMEA 配比对CO2解吸性能的影响
在温度为40 ℃、搅拌速率为500 r/min、反应时间为60 min和电石炉净化灰添加量为n(CO2):n(Ca) = 1.0:1.0条件下,进行了不同配比(c(MEA):c(DMEA) = 3.0:0、2.0:1.0、1.5:1.5、1.0:2.0、0:3.0)的MEA/DMEA 混合醇胺溶液中CO2解吸实验,结果见图4。
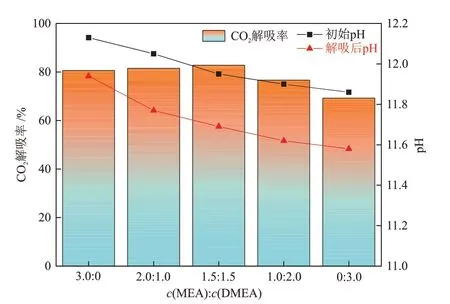
图4 MEA/DMEA 混合醇胺溶液的CO2 解吸率和pH 随c(MEA):c(DMEA)的变化Fig.4 Changes of CO2 desorption rate and pH with c(MEA):c(DMEA) of MEA/DMEA mixed alcohol amine solutions
由图4可知,电石炉净化灰可有效地将不同配比MEA/DMEA混合醇胺溶液中的CO2解吸,随着混合醇胺溶液中DMEA溶度增大,CO2解吸率呈现出先增大后减小的趋势。其中,1.5 mol/L MEA + 1.5 mol/L DMEA混合醇胺溶液表现出最高的CO2解吸率,为82.78%。这是因为该配比条件下CO2吸收负荷大,溶液中HCO-3与CO2-3浓度大,有利于矿化反应进行,这同ZHANG等[13]研究结果近似。此外,随着混合醇胺溶液中DMEA 浓度增大,溶液初始pH 逐渐降低,这是因为混合醇胺溶液中MEA浓度减少,而MEA 作为一级胺,氮原子上存在活泼的氢原子,碱性强[14]。解吸后的醇胺溶液pH 值与初始的醇胺溶液pH值相差小于0.30,经过电石炉净化灰解吸后基本恢复到初始状态。综上可发现,1.5 mol/L MEA +1.5 mol/L DMEA 混合醇胺溶液CO2吸收负荷高、CO2解吸率大。下面以该配比方式研究矿化反应时间与电石炉净化灰添加比例对醇胺溶液解吸性能的影响以及MEA/DMEA混合醇胺溶液吸收与解吸CO2机理。
2.3 不同矿化时间与电石炉净化灰添加量对CO2解吸性能的影响
图5 给出了在电石炉净化灰添加比例n(CO2):n(Ca) = 1.0:1.0条件下,1.5 mol/L MEA + 1.5 mol/L DMEA混合醇胺溶液的CO2解吸率随矿化反应时间的变化情况。由图5可知,加入电石炉净化灰后,反应进行5 min,CO2解吸率就达到了68.18%,说明电石炉净化灰中CaO 等碱性矿物在混合醇胺溶液中溶解速率高,溶液中CO2负荷快速降低,转化为CaCO3沉淀;90 min时CO2解吸率达到最大值,此时CO2解吸率与溶液pH值分别为82.96%和11.70。随着反应时间增加,电石炉净化灰中CaO等碱性矿物充分溶解,促进溶液中的CO2-3与HCO-3形成更多的CaCO3沉淀,溶液中质子化胺MEAH+/DMEAH+被再生为游离的醇胺,CO2解吸率与溶液pH 值逐渐增大;此后随着反应时间进一步增长,溶液中的Ca2+大部分已转化为CaCO3沉淀,并且生成的CaCO3沉淀会覆盖在电石炉净化灰颗粒表面,抑制剩余Ca2+的浸出和反应[19],导致CO2解吸率与溶液pH基本不变。
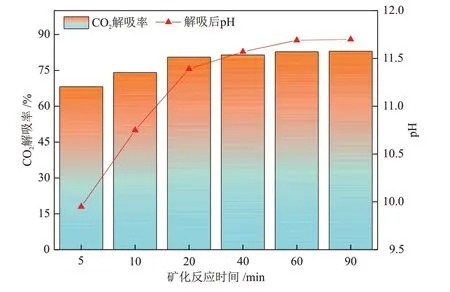
图5 1.5 mol/L MEA + 1.5 mol/L DMEA 混合醇胺溶液的CO2解吸率和pH随矿化反应时间的变化Fig.5 Changes of CO2 desorption rate and pH of 1.5 mol/L MEA + 1.5 mol/L DMEA mixed alcohol amine solutions with mineralization reaction time
图6为在不同电石炉净化灰添加比例(n(CO2):n(Ca))、矿化反应时间60 min下,1.5 mol/L MEA + 1.5 mol/L DMEA 混合醇胺溶液的CO2解吸率。可以看出,CO2解吸率随电石炉净化灰添加量的增大而提高,且在电石炉净化灰添加比例大于1.0:1.0 后趋于平稳,在电石炉净化灰添加比例为1.0:1.2时,CO2解吸率为83.23%;解吸后溶液的pH 值随电石炉净化灰添加量的增大而增大。在电石炉净化灰添加比例为1.0:0.8 时,矿化反应60 min 时CO2解吸率为75.79%,此添加比例下,参与反应的CaO 等碱性矿物较少,导致CO2解吸率低。随着电石炉净化灰添加量增大,解离出的Ca2+和OH-浓度增加,促进矿化反应正向进行,加速溶液中CO2-3与HCO-3转化为CaCO3沉淀,CO2解吸率进一步提高。当电石炉净化灰添加比例大于1.0:1.0 后,溶液中所能溶解的Ca2+有限,并且电石炉净化灰中不参与矿化反应的无效成分会大量溶解到溶液中,降低矿化反应速率[17],所以CO2解吸率不再明显提高。此外,电石炉净化灰添加比例为1.0:1.2时,解吸后的醇胺混合溶液pH值为12.02,大于该混合醇胺溶液的初始pH值11.95,这可能是因为电石炉净化灰添加量过大会引入更多电石炉净化灰中含量微弱的碱性物质,导致溶液的pH 值继续升高,但该类含碱物质不会增加CaCO3生成量[27]。
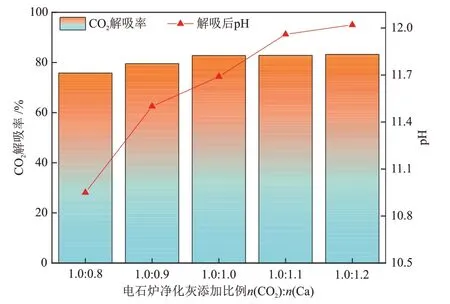
图6 1.5 mol/L MEA + 1.5 mol/L DMEA 混合醇胺溶液的CO2解吸率和pH随电石炉净化灰添加比例的变化Fig.6 Changes of CO2 desorption rate and pH of 1.5 mol/L MEA + 1.5 mol/L DMEA mixed alcohol amine solutions with adding ratio of purified dusts from calcium carbide furnace
2.4 电石炉净化灰与CaO、Ca(OH)2的CO2矿化性能对比
图7 给出了添加比例为n(CO2):n(Ca) = 1.0:1.0下,电石炉净化灰、Ca(OH)2和CaO 的CO2解吸率对比。由图7可知,解吸反应进行至5 min时,电石炉净化灰与CaO对CO2富液(1.5 mol/L MEA + 1.5 mol/L DMEA)的解吸率大于Ca(OH)2,这是因为由表1 和图8可知,电石炉净化灰中主要存在石灰(CaO)、氢氧钙石(Ca(OH)2),而Ca(OH)2属于微溶物质,矿化反应进程大大受限于溶解速率[9],所以在短时间内Ca(OH)2对富CO2溶液的CO2解吸率小于CaO 和电石炉净化灰。随着反应时间增长,三者的CO2解吸率进一步提高,反应时间为60 min时,Ca(OH)2、CaO和电石炉净化灰三者的CO2解吸率依次为80.18%、83.27%和82.78%。此外,CaO、Ca(OH)2和电石炉净化灰三者解吸后的溶液pH值随反应时间增加而增大,其中,CaO 解吸后的溶液pH 最大,碱性最强,Ca(OH)2次之,电石炉净化灰最低。
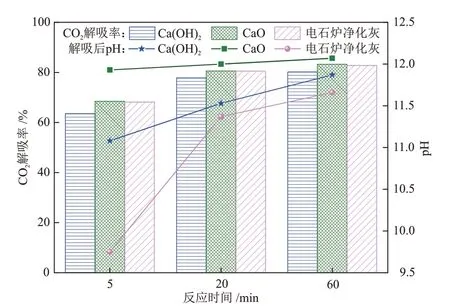
图7 相同添加比例下电石炉净化灰、Ca(OH)2和CaO 的CO2解吸率和pH的对比Fig.7 Comparison of CO2 desorption rates and pH of purified dusts from calcium carbide furnace, Ca(OH)2 and CaO at the same addition ratio
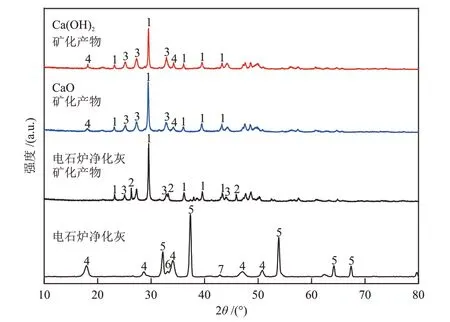
图8 电石炉净化灰及其矿化产物、Ca(OH)2矿化产物和CaO矿化产物的XRD谱图Fig.8 XRD patterns of purified dust from calcium carbide furnace and its mineralization products, Ca(OH)2 mineralization products and CaO mineralization products
图8 和图9 分别给出了电石炉净化灰、Ca(OH)2和CaO矿化产物的XRD谱图和SEM照片。电石炉净化灰矿化产物中CaCO3峰强度显著增加,表明电石炉净化灰通过矿化反应将醇胺混合溶液中吸附的CO2转化为CaCO3,其中以方解石晶型的CaCO3居多,此外还有少量的文石和球霰石晶型;形貌上出现棒状与立方体形状,表面光滑,为典型的方解石形貌[19]。与电石炉净化灰的矿化产物相比,Ca(OH)2和CaO矿化产物中没有文石型碳酸钙生成,主要为方解石与球霰石型碳酸钙,并且剩有未反应的Ca(OH)2。CaO 矿化生成的碳酸钙具有菱面体形状和光滑表面,是典型的方解石晶体特征,菱面体表面散落着球形的碳酸钙,是球霰石的典型形态[27];Ca(OH)2矿化生成的碳酸钙能看到有棒状与菱面体形状,表面光滑,为方解石型碳酸钙,并且与电石炉净化灰的矿化产物相比,Ca(OH)2和CaO 二者矿化产物的粒径较小。

图9 电石炉净化灰(a)及其矿化产物(b)、CaO 矿化产物(c)和Ca(OH)2矿化产物(d)的SEM照片Fig.9 SEM images of purified dust from calcium carbide furnace (a) and its mineralization products (b), CaO mineralization products (c) and Ca(OH)2 mineralization products (d)
2.5 MEA/DMEA混合醇胺溶液吸收与解吸机理分析
图10 给出了在电石炉净化灰添加比例为n(CO2):n(Ca) = 1:1条件下,1.5 mol/L MEA + 1.5 mol/L DMEA 混合醇胺溶液的初始溶液、吸收CO2后电石炉净化灰解吸前后的FT-ⅠR 谱图。可以看出,对于初始的混合醇胺溶液,在1027 cm-1处存在C—O 键的伸缩吸收峰,1076 cm-1处和1642 cm-1处分别存在C—N键的伸缩吸收峰和N—H键的弯曲吸收峰,这两个特征峰属于生成的质子化胺MEAH+/DMEAH+[28]。吸收CO2后溶液中出现了新的几个典型特征峰:包括1076 cm-1处C—N键的伸缩吸收峰偏移至1069 cm-1处,对应生成的质子化胺(MEAH+/DMEAH+);1324 cm-1处N—COO-键的伸缩振动峰,1483 cm-1处和1566 cm-1处COO-的对称伸缩峰和非对称伸缩峰,这3个特征峰属于反应生成的MEACOO-;1388 cm-1处的典型吸收峰对应CO23-,1360 cm-1处的对称伸缩峰对应HCO-3[24]。
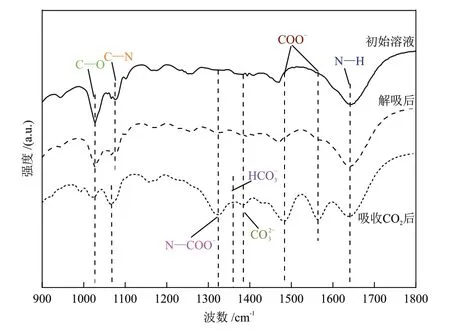
图10 1.5 mol/L MEA + 1.5 mol/L DMEA 混合醇胺溶液经电石炉净化灰解吸前后的FT-IR谱图Fig.10 FT-IR spectrum of 1.5 mol/L MEA + 1.5 mol/L DMEA mixed alcohol amine solutions before and after desorption with purified dusts from calcium carbide furnace
MEA/DMEA混合醇胺溶液吸收CO2的机理为:MEA 吸收CO2后生成含NH+2与COO-的两性离子[29],然后与另一个MEA 分子反应形成MEACOO-和MEAH+。 随 着CO2吸 收 量 增 加,溶 液 中MEACOO-的浓度增加,促进MEACOO-水解生成更多的CO2-3。DMEA作为三级胺,氮原子周围不存在氢原子,不能与CO2直接反应生成氨基甲酸根,而是起到催化剂的作用,促进CO2水解反应[30],化学反应方程见式(3)~式(9):
MEA 吸收CO2生成的两性离子可与DMEA 反应[25],化学反应方程见式(10),生成质子化胺DMEAH+和CO2-3,并再生MEA继续吸收CO2,从而使MEA/DMEA混合醇胺溶液吸收CO2的速率提高,并且能吸收更多的CO2。此外,混合醇胺溶液中含有较多的CO2-3有利于后续矿化反应进行。所以,与单一醇胺相比,MEA/DMEA混合醇胺溶液具有相对较高的CO2负荷和吸收速率。
由图10 可知,经过电石炉净化灰解吸后,MEACOO(-1324 cm-1、1483 cm-1和1566 cm-1)、CO23-(1388 cm-1)和HCO(-31360 cm-1)的峰强度下降,反映了溶液中这些物质的含量减少,表明MEACOO-和CO23-等物质参与了矿化反应。质子化胺MEAH+/DMEAH+在1069 cm-1处C—N 键的特征峰降低,解吸后的混合醇胺溶液与初始溶液的FT-ⅠR 结果基本一致,证明了MEA/DMEA 经电石炉净化灰解吸后获得再生。
综上,得到MEA/DMEA 混合醇胺溶液吸收CO2后经电石炉净化灰矿化CO2并再生MEA/DMEA 的机理:首先,电石炉净化灰中的CaO与Ca(OH)2溶解在混合醇胺溶液中,通过式(11)~式(12)所示化学反应提供Ca2+和OH-,与混合醇胺溶液中的CO23-和HCO-3反应生成CaCO3沉淀;其次,溶液中HCO-3含量减少会促进MEACOO-通过式(6)所示化学反应水解生成更多的HCO-3并再生MEA,使得MEACOO-间接参与再生过程;最后,电石炉净化灰释放的OH-通过式(15)~式(16)所示化学反应中和质子化胺MEAH+/DMEAH+,使MEA/DMEA 再生,并增加溶液的pH 值。这样以MEACOO-、CO23-和HCO-3形式吸收的CO2就从液相中转化为稳定的碳酸盐,将CO2封存并使醇胺得到再生。涉及的化学反应方程见式(11)~式(16):
2.6 MEA与DMEA混合醇胺溶液循环性能
在电石炉净化灰添加比例为n(CO2):n(Ca) = 1.0:1.0条件下,验证了混合醇胺溶液吸收CO2后经电石炉净化灰解吸矿化的循环稳定性,图11 给出了1.5 mol/L MEA + 1.5 mol/L DMEA 混合醇胺溶液4次吸收-矿化循环实验中的CO2负荷变化(图11(a),图中R指吸收CO2后的CO2富液,L指解吸后的CO2贫液)及混合醇胺溶液解吸后的FT-ⅠR谱图(图11(b))。从图11(a)中可以看出,随着循环次数的增加,吸收CO2后混合醇胺溶液的CO2负荷稳定在1.8 mol/L左右,但解吸后混合醇胺溶液的CO2负荷逐渐增大,说明解吸程度逐渐降低,经过4次吸收-解吸反应后解吸率由82.78%降至52.80%。由图11(b)可以看出,多次解吸后,1076 cm-1处质子化胺MEAH+/DMEAH+的吸收峰、1388 cm-1处CO2-3的吸收峰以及1324 cm-1和1566 cm-1处MEACOO-的吸收峰增大,表明溶液中存在大量质子化胺MEAH+/DMEAH+、CO2-3和MEACOO-,添加电石炉净化灰未将溶液中质子化胺MEAH+/DMEAH+和CO2-3最大程度转化为MEAH/DMEAH和碳酸钙,并且CO2-3的存在会影响MEACOO-通过式(6)所示化学反应水解再生MEA,导致溶液中MEA和DMEA浓度降低。原因为电石炉净化灰多次解吸后,净化灰中的其他离子会浸出到混合醇胺溶液中,杂质离子的累积会使电石炉净化灰释放的Ca2+和OH-减少[19],根据式(14)~式(16)所示化学反应,MEAH+/DMEAH+和CO2-3转化为MEAH/DMEAH 和碳酸钙受限;此外,矿化反应后,经离心过滤处理,滤渣会携带醇胺溶液,4次循环后混合醇胺溶液损失量达10%左右,导致混合醇胺溶液的吸收性能和解吸率下降。
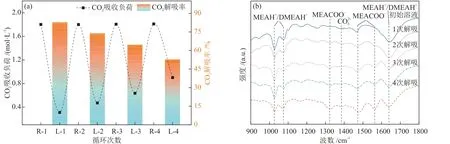
图11 1.5 mol/L MEA + 1.5 mol/L DMEA混合醇胺溶液经4次吸收-矿化实验后的循环性能(a)及4次循环中混合醇胺溶液的FT-IR谱图(b)Fig.11 Cyclic performance of 1.5 mol/L MEA + 1.5 mol/L DMEA mixed alcohol amine solutions after four absorption-mineralization experiments (a) and FT-IR spectra of mixed amine solution in four cycles (b)
表2给出了本研究结果与其他学者关于CO2吸收-矿化一体化技术研究结果的对比情况。可以看出,MEA + DMEA 混合醇胺溶液耦合电石炉净化灰在CO2吸收与解吸矿化上性能良好。4次循环后混合醇胺溶液的吸收性能虽有所下降,但仍有0.950 mol/L 的CO2吸收负荷,利用碱性固废电石炉净化灰化学解吸MEA + DMEA 混合醇胺溶液中的CO2是可行的。
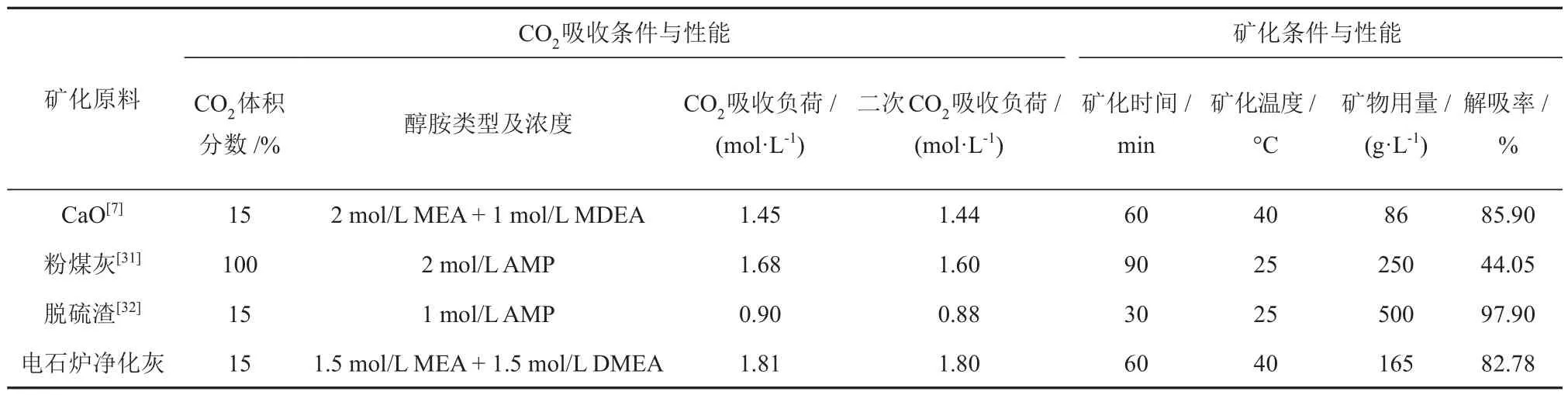
表2 不同醇胺溶液与矿化原料CO2吸收-矿化条件与性能比较Table 2 Comparison of CO2 absorption-mineralization condition and performance of different alcohol amine solutions and mineralized raw materials
2.7 混合醇胺溶液耦合电石炉净化灰吸收-矿化CO2经济性分析
混合醇胺溶液常规热解吸过程需要大量能耗,包括混合醇胺溶液和CO2间的吸收热、混合醇胺溶液升温的显热以及溶液蒸发的潜热等。传统的在120 ℃下热解吸时,再生负荷约为4.7 GJ/t,其中87%的能量用于CO2解吸和压缩,即解吸塔中的再沸器和CO2压缩机能量消耗[18]。根据LⅠ等[33]计算,能耗成本占醇胺吸收CO2工艺总成本的55%(不包括CO2运输和储存),混合醇胺溶液耦合电石炉净化灰吸收-矿化CO2工艺不需要热再生和CO2压缩,预计总成本将减少48%(55% × 87% ≈ 48%)。除能量消耗外,设备投资占醇胺吸收CO2工艺总成本的25%。若用于矿化的反应器成本与热解吸工艺中的汽提塔(包括塔和填充材料)的成本相当,则电石炉净化灰矿化解吸过程不需要用于CO2热解吸和压缩的设备(如再沸器、冷凝器、换热器和压缩机等),设备成本将降低48%[18],从而使总成本降低12%(25% × 48% ≈ 12%)。
由此可见,与常规热解吸相比,矿化解吸是一种能耗低、环境友好的解吸方法,可在室温下进行,能量消耗为0.5 GJ/t[32],其能量主要用于过滤器和泵进行固液分离,能耗明显降低。同时,CO2固定在矿化产物碳酸钙中,避免了CO2压缩和储存运输过程的能耗。
3 结论
本文主要研究了混合醇胺配比、矿化反应时间和电石炉净化灰添加比例对MEA/DMEA混合醇胺溶液耦合电石炉净化灰吸收-矿化CO2性能的影响,对比了电石炉净化灰与CaO、Ca(OH)2两种钙基物质的CO2矿化性能,并分析了MEA 与DMEA 混合醇胺溶液吸收与解吸CO2的机理,得到以下结论。
(1)MEA/DMEA混合醇胺溶液对CO2吸收效果优良,在5 种配比中,c(MEA):c(DMEA) = 1.5:1.5 的混合醇胺溶液表现出最大的CO2吸收负荷和CO2解吸率,分别为1.807 mol/L和82.78%;经过4次吸收-解吸循环后吸收性能虽有所下降,但仍有0.950 mol/L的CO2吸收负荷。
(2)随矿化反应时间的增长与电石炉净化灰添加比例的增大,CO2解吸率逐渐提高,在矿化时间大于20 min、电石炉净化灰添加比例超过1.0:1.0 后,继续增长矿化时间与增大电石炉净化灰添加比例对CO2解吸率的提升较小。
(3)电石炉净化灰可向混合醇胺溶液中释放Ca2+和OH-,与溶液中的CO2-3和HCO-3反应生成CaCO3沉淀,促进MEACOO-水解并中和质子化胺MEAH+/DMEAH+,实现矿化CO2和混合醇胺溶液的再生。添加比例n(CO2):n(Ca) = 1.0:1.0 下,电石炉净化灰、CaO 和Ca(OH)2三者的CO2解吸率依次为82.78%、83.27%和80.18%,电石炉净化灰解吸性能接近CaO 却优于Ca(OH)2,得到的矿化产物包括方解石、文石与球霰石型碳酸钙,并以方解石型为主。
