合平扫及增强CT影像组学特征预测亚实性肺结节浸润性的应用价值*
2023-11-01徐富阳刘杰克王璐李勇青浩渺何长久林礼波周鹏
徐富阳,刘杰克,王璐,李勇,青浩渺,何长久,林礼波,周鹏
637000 四川 南充,川北医学院 医学影像学院(徐富阳、王璐、周鹏); 610041 成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 影像科(徐富阳、刘杰克、王璐、李勇、青浩渺、何长久、林礼波、周鹏)
肺癌是对人类健康危害最大的恶性肿瘤之一[1]。肺腺癌是早期肺癌最常见的病理组织亚型[2]。2021 年《WHO 胸部肿瘤分类(第5 版)》将肺腺癌分为前驱腺体病变(precursor glandular lesions,PGL)[包括非典型腺瘤性增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinoma in situ,AIS)]、微浸润性腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌(invasive adenocarcinoma,IAC),这些均可在CT 图像上表现为亚实性肺结节(包括纯磨玻璃结节及部分实性结节)[3-4]。研究表明,PGL/MIA 术后5 年无病生存期(disease-free survival,DFS)接近100%,而IAC 由于生长模式不同,5 年DFS 为38%~93%[5-6]。由于不同类型肺腺癌的预后不同,对于可能为PGL/MIA 的亚实性肺结节患者,应进行定期随诊[7]。而对于怀疑为IAC 的患者,应进行早期临床干预[6]。因此,早期预测亚实性肺结节的浸润性(PGL/MIA vs IAC),对患者选择个性化的治疗策略有一定应用价值。
放射科医师常通过基于胸部CT 的影像学特征预测亚实性结节的浸润性。然而,传统影像学特征,如分叶、毛刺、胸膜反应、直径等定性和定量特征,其主观性太强且几乎完全依赖于放射科医生的经验诊断[8-12],导致不同研究的诊断效能有较大差异,其AUC 从0.71 到0.90 不等[11-16]。因此,仅仅依赖传统影像学特征可能不足以对亚实性肺结节的侵袭性实现早期精准诊断,需要进一步引入高通量的影像特征,深度挖掘其中的数字化信息[17-20]。既往研究表明,影像组学在评估亚实性结节的侵袭性方面显示出一定的应用价值[13-14,21]。然而,既往研究多基于胸部平扫CT 图像进行分析。研究表明,肿瘤的侵袭性与血管发生、微血管浸润密切相关[22-23],这些改变可能造成增强与平扫CT 图像组学特征的差异。
本研究拟基于平扫及增强CT 构建影像组学模型,评估其预测亚实性结节浸润性的诊断价值,并与传统影像学模型进行比较。
1 材料与方法
1.1 临床资料
本研究为回顾性研究,收集2019 年4 月至2020 年12 月在四川省肿瘤医院经完整肺结节切除手术的患者。本研究经四川省肿瘤医院伦理委员会批准。纳入标准:①亚实性肺结节;②术后病理证实为肺腺癌;③术前1 个月内在同次检查中同时行 CT 平扫和增强扫描。排除标准:①结节平均直径 > 3 cm;②特殊类型肺腺癌:如浸润性黏液腺癌、胶样腺癌、胎儿型腺癌或肠型腺癌;③由于呼吸或运动伪影导致图像质量差;④既往有恶性肿瘤或远处转移病史。经过筛选,本研究最终纳入192名患者,共计209 例亚实性肺结节,其中男性120名、女性72 名,中位年龄53(49,60)岁。本研究按照7∶3 的比例以及CT 检查时间顺序,自2019 年4 月至2020 年6 月共148 例亚实性肺结节入组训练集病例,其中包括61 例PGL/MIA 和87 例IAC;自2020 年6 月至2020 年12 月共61 例亚实性肺结节入组验证集病例,其中包括25 例PGL/MIA 和36 例IAC。
1.2 组织病理学评估
根据国际癌症研究机构于2021 年5 月出版的《WHO 胸部肿瘤分类(第5 版)》,重新评估了本研究所有纳入的病理标本[3]。
1.3 影像组学模型建立
①图像采集:采用荷兰 Philips Brilliance iCT 256 层螺旋 CT 机从肺尖到肋膈角对受检者进行全肺扫描,扫描时患者取仰卧位,双手上举。扫描参数:管电压120 kV,自动管电流调制、参考管电流200~250 mAs,螺距为0.915,机架旋转时间为0.4 s,图像采用迭代重建技术(iDose4,level 6,Phillips Healthcare)重建,层厚为0.625 mm,视野为350 mm × 350 mm,矩阵为512 × 512。增强扫描使用高压注射器以 3.0 mL/s 的流率将 90 mL 的非离子型碘对比剂 (碘普罗胺,含碘 370 mg/mL) 注入肘前静脉,监测肺动脉干层面升主动脉阈值,达到100 HU 后延迟45 s 行静脉期扫描;②图像分割:本研究将纳入的亚实性肺结节的平扫期和静脉期图像以DICOM 格式导入基于人工智能的联影智能科研平台(United Imaging Intelligence,UII),全自动完成肺结节感兴趣区(region of interest,ROI)的识别和分割。2 位分别具有6 年及11 年胸部放射诊断经验的中级医生已经评定了肺结节的勾画结果,勾画结果满意(图1)。因此,不对勾画结果进行人为调整,以避免观察者间的差异;③特征提取:利用基于Python 的PyRadiomics 软 件 包(https://pyradiomics.readthedocs.io)计算影像组学特征,包括形态学特征、一阶/直方图特征、纹理特征,其中纹理特征又包括灰度共生矩阵(gray level cooccurrence matrix,GLCM)、灰度相关矩阵(gray level dependence matrix,GLDM)、灰度游程矩阵(gray level run length matrix,GLRLM)、灰度连通区域矩阵(gray level size zone matrix,GLSZM)、局部灰度差分矩阵(neighborhood gray tone difference matrix,NGTDM)。本研究一共提取了104 个影像组学特征;④模型构建:首先对每个特征进行Z-score 标准化处理。为避免数据过度拟合,采用基于 L1 正则化的最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)选择最显著的预测特征,并将筛选的特征放入多因素Logistic 回归分析,最后采用逐步回归选择法(stepwise regression,SR)及赤池信息量准则 (Akaike information criterion,AIC)构建最终影像组学标签(Rad-score)。将筛选出来的特征进行线性加权,计算出每例亚实性肺结节的Rad-score。总共构建3 个影像组学模型:平扫模型(基于平扫CT 组学特征),增强模型(基于增强CT 组学特征)以及综合模型(基于平扫及增强CT组学特征)。

图1 不同病理类型结节的典型图像及联影自动分割结果。Figure 1.Representative Images and Segmentation Results of Different Histological Types of Nodules
1.4 传统影像学模型构建
本研究基于肺结节的定量及定性特征构建传统影像学模型。本研究纳入的定量特征为结节的平均直径。根据Fleischner 协会指南,平均直径=(轴位图像上的最大长径+其垂直径)/2[24]。由2 名具有6 年和11 年胸部放射诊断经验的中级医生在平扫CT 的标准肺重建(窗位:-600 HU;窗宽:1 500 HU)的轴位图像上测量结节的最大长径及其垂直径,并计算肺结节的平均直径。利用组内相关系数(intraclass correlation efficient,ICC)评估2 名诊断医师的测量肺结节平均直径的一致性。ICC > 0.85 说明一致性较高。本研究纳入的定性特征包括:形状(圆形/椭圆形或不规则)、边缘(平滑或粗糙)、分叶、毛刺、胸膜反应、空气支气管征、空泡征、血管类型、结节类型(纯磨玻璃或部分实性)、平均直径。血管类型包括低级别和高级别型。低级别型是指结节内未见血管穿行或者可见血管穿行但血管的形态、走形未见改变;高级别型指结节内穿行血管形态异常、走形扭曲[25]。由2 名分别具有6 年和11 年胸部放射诊断经验的中级医生在平扫CT 的标准肺重建的轴位及多平面重建(multi-planar reformatting,MPR)上完成所有肺结节定性特征的评估。若有争议,则协商讨论解决,如仍未达成一致,则由1 名具有26年胸部放射诊断经验的高级医生判定。在评估图像前,全部放射诊断医生均不知相应的病理组织学结果。将全部传统影像学特征放入单因素Logistic 回归分析中,以确定对IAC 的独立风险预测因子,并计算其OR 及95% CI。随后,将P < 0.05 的特征放入多因素Logistic 回归分析,采取SR 及AIC 构建最终传统影像学模型。
1.5 统计学方法
采用SPSS 软件(25.0 版)和R 软件(4.0.4 版)进行统计分析。采取 Kolmogorov-Smirnov 查验计量资料是不是符合正态分布,服从正态分布以 ±s 表示,并采取独立样本t 检验比较组间差异;不服从正态分布的用M(Q1,Q3)表示,并采用Mann–Whitney U 检验比较组间差异。计数资料采用卡方检验或者Fisher 精确检验。利用ROC 曲线的AUC 评估影像组学模型和传统影像学模型的诊断效能。根据约登指数确定ROC 曲线的最佳阈值,设定该数值为截断值,大于等于该数值诊断为IAC,反之则诊断为PGL/MIA。计算该数值对应的准确性、敏感性、特异性、阳性预测值及阴性预测值,并通过精确概率法计算各自的95% CI。采用Hosmer-Lemeshow 检验评价模型的拟合优度,并绘制该模型的校准曲线。
2 结 果
2.1 基线特征
211 例亚实性肺结节患者的临床及影像学特征见表1。其中形状、分叶、空气支气管征、空泡征、血管类型、结节类型、平均直径在训练集、验证集中的组间差异均有统计学意义(均P < 0.05);年龄、性别、边缘、胸膜反应在训练集中的组间差异均有统计学意义(均P < 0.05),但在验证集中差异无统计学意义(P = 0.224、P = 0.102、P = 0.164、P = 0.133);毛刺征在训练集和验证集中差异均无统计学意义(P = 0.081 和P = 0.640)。

表1 患者的临床和影像学特征Table 1.Clinical and Demographic Characteristics of Patients
2.2 影像组学模型
在训练集中,平扫及增强模型提取104 个组学特征,综合模型为平扫及增强模型的全部特征,共计208 个。3 个模型的筛选过程详见图2。最终筛选出综合模型4 个特征、增强模型3 个、平扫模型3 个,用于构建相应的组学模型。

图2 影像组学模型特征筛选流程图Figure 2.Selection Process of Radiomic Features
①综合模型公式:
ln(P/1-P) = 0.592 - 0.638 × CECT_Firstorder_Kurtosis - 1.222 × CT_Shape_Elongation + 2.318 ×CECT_GLSZM_ZoneEntropy - 0.636 × CT_NGTDM_Strength,其中P 为该模型预测IAC 的概率,截断值为0.593。
②增强模型公式:
ln(P/1-P) = 0.406 - 0.583 × CECT_Firstorder_Kurtosis - 0.526 × CECT_Shape_Flatness + 2.219× CECT_GLSZM_ZoneEntropy,其中P 为该模型预测IAC 的概率,截断值 为 0.522。
③平扫模型公式:
ln(P/1-P) = 0.113 - 1.015 × CT_Shape_Elongation - 2.851 × CT_GLSZM_SmallAreaLowGrayLevelEmphasis - 0.815 × CT_NGTDM_Strength,其中P为该模型预测IAC 的概率,截断值为 0.588。
为了在计算前进行Z-score 标准化,各模型相应特征的平均值和标准差详见表2。

表2 各模型特征的平均值和标准差Table 2.Means and Standard Deviations of Radiomic Features
2.3 传统影像学模型
两名诊断医师测量肺结节平均直径的一致性 较 高(ICC = 0.913),遂 选 取 具 有11 年 诊 断 经验医师的结果做后续分析。单因素Logistic 回归分析显示,预测亚实性肺结节浸润性的独立危险因子为:形状(OR: 4.881,95% CI: 2.404~9.913,P < 0.001);边缘(OR: 4.416,95% CI:1.701~11.463,P = 0.002);分叶(OR: 5.600,95% CI:2.024~15.493,P = 0.001);胸 膜 反 应(OR: 4.442,95% CI: 2.044~9.655,P < 0.001);空气支气管征(OR: 20.308,95% CI: 2.655~155.322,P = 0.004);血管类型(OR: 7.894,95% CI: 3.233~19.270,P < 0.001);结节类型(OR: 3.209,95%CI: 1.471~6.998,P = 0.003);直径(OR: 1.354,95% CI: 1.212~1.513,P < 0.001;表3)。根据多因素Logistic 回归分析,基于结节的形状、胸膜反应、结节类型及平均直径,用于构建传统影像学模型(表3)。公式为:ln(P/1-P) = - 4.109 + 1.337 × 形状(不规则)+ 1.041 ×胸膜反应(有)+ 1.460 × 结节类型(部分实性)+ 0.268 ×平均直径,其中P 为该模型预测IAC 的概率,截断值为0.583。
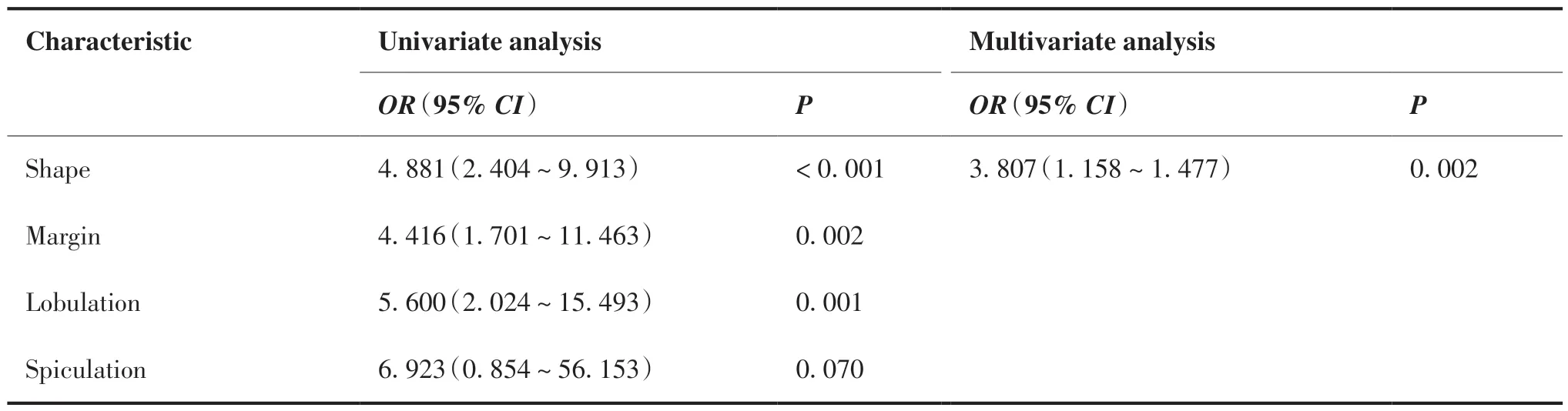
表3 传统影像学特征单因素和多因素Logistic 回归结果Table 3.Univariate and Multivariate Logistic Regression Analysis of Conventional Radiological Features
2.4 模型诊断效能比较
综合模型在训练集和验证集中预测亚实性肺结节浸润性的AUC 为0.925(95% CI: 0.871~0.962)和0.927(95% CI: 0.830~0.978);增强模型为0.890(95% CI: 0.828~0.935)和0.909(95% CI: 0.807~0.967);平扫模型为0.914(95% CI: 0.856~0.954)和0.922(95% CI: 0.824~0.976);传统影像学模型为0.864(95% CI: 0.798~0.915)和0.892(95% CI:0.786~0.957;图3)。各模型的AUC、灵敏度、特异度和准确度如表4 所示。校准曲线显示,无论在训练集还是验证集中,各模型的预测值和观察值之间均表现出良好的一致性,Hosmer-Lemeshow 检验结果显示差异均无统计学意义(均P > 0.05;图4)。
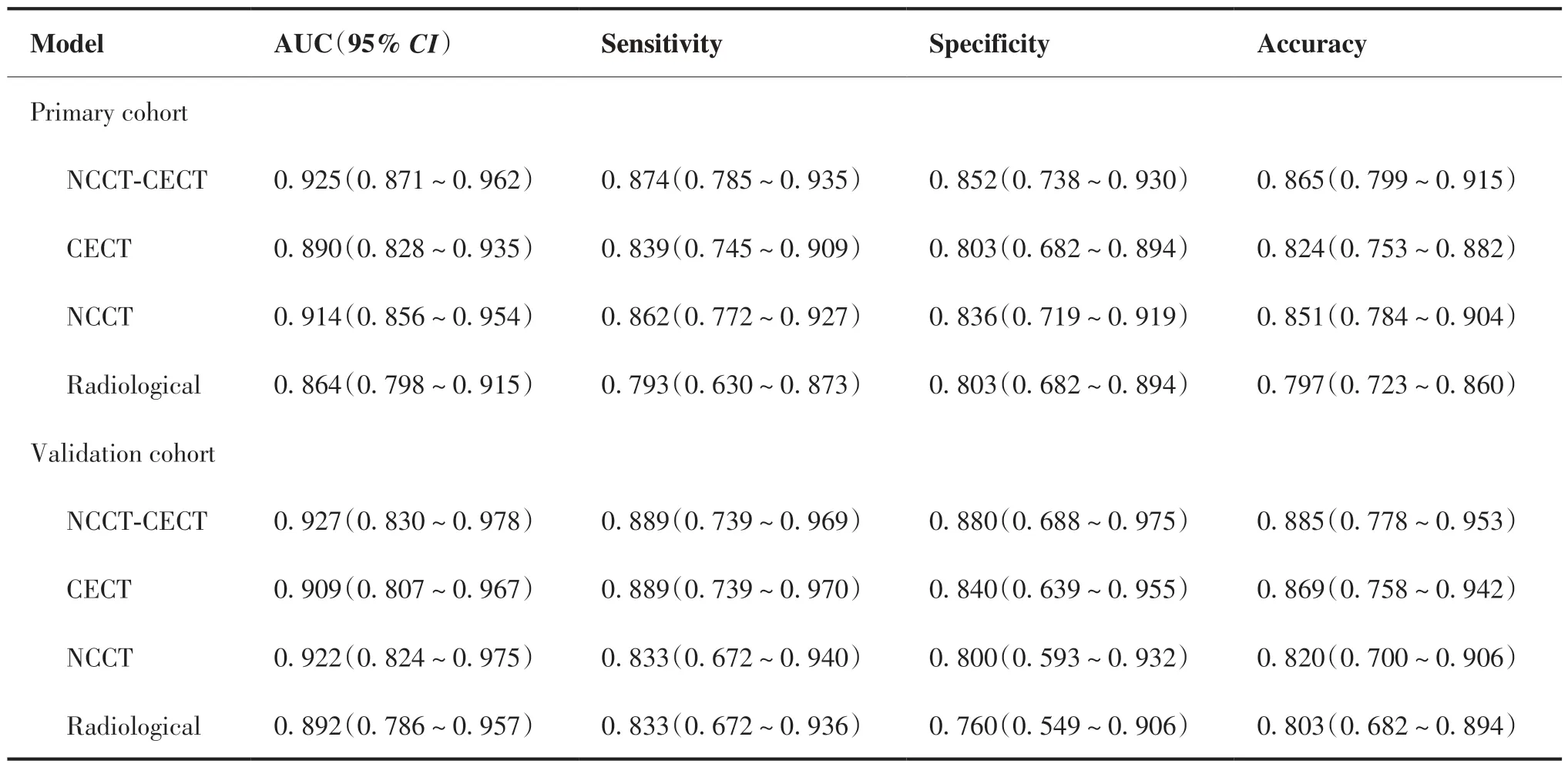
表4 各模型的诊断效能Table 4.Diagnostic Performance of the Models in the Primary and Validation Cohorts
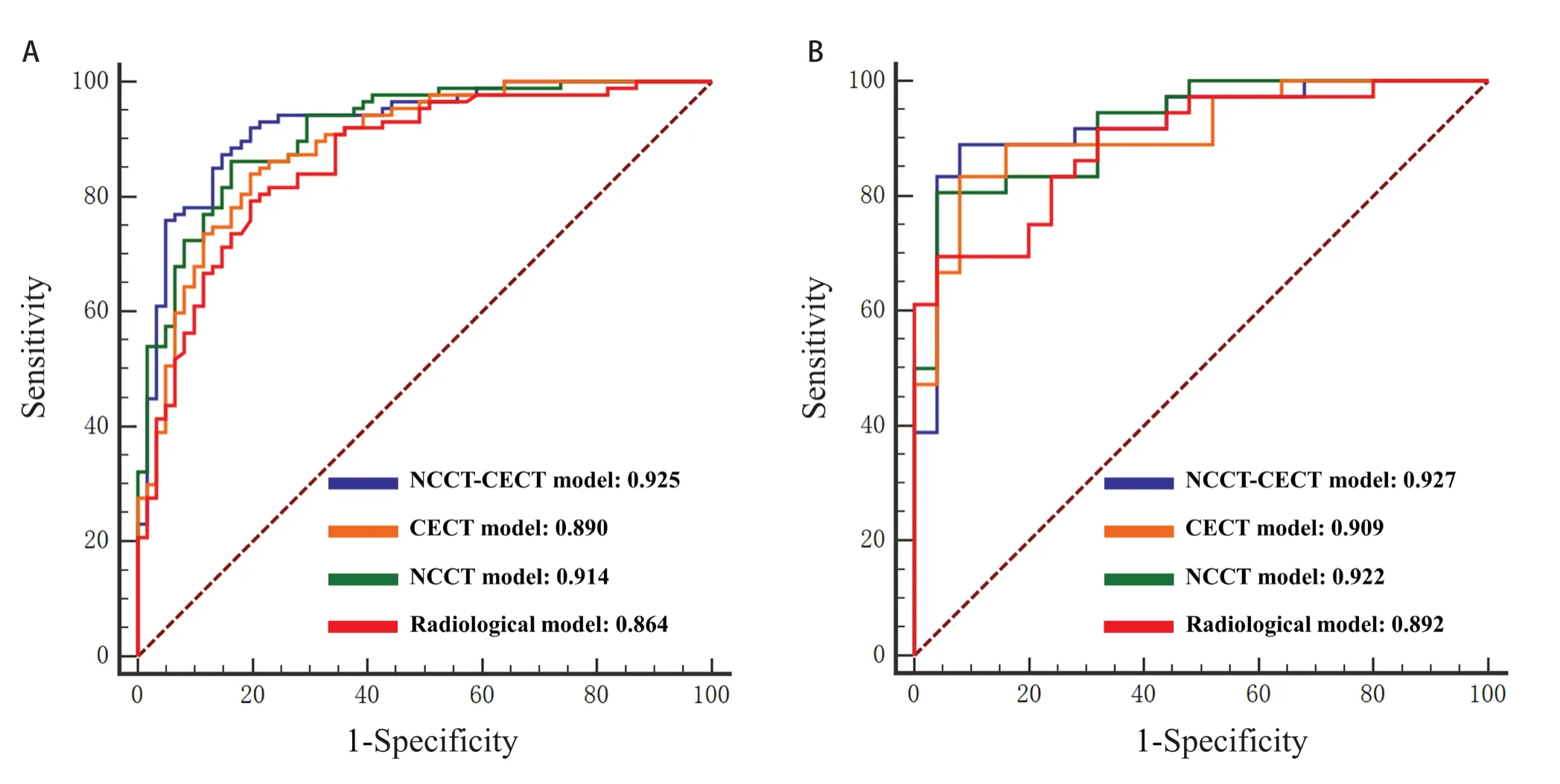
图3 各模型的受试者工作特征曲线。Figure 3.Receiver Operating Characteristic Curves of the Models

图4 各模型的校准曲线。Figure 4.Calibration Curves of the Models
3 讨 论
本研究构建和验证了综合、增强、平扫及传统影像学模型,以预测亚实性肺结节的浸润性,并评估了各模型的诊断效能。结果显示,在训练集和验证集中,综合模型的AUC 均高于其他模型,表明基于平扫和增强CT 图像构建的综合模型具有良好的诊断效能,有可能在术前预测亚实性肺结节的浸润性。
既往研究常使用结节的定量及定性特征来预测亚实性肺结节的浸润性[25-32]。本研究多因素Logistic 回归结果显示,形状(不规则)、胸膜反应(有)、结节类型(部分实性)、平均直径为亚实性肺结节浸润性的独立风险预测因子。结节形状主要与病变内的浸润性成分相关,PGL/MIA 没有或侵袭成分较少,多表现为圆形/椭圆形;当病变内浸润性成分增多时,肿瘤不同部位的癌细胞分化和生长速度不同,瘤内纤维化收缩致使形状不规则[25,29,31]。胸膜反应形成的病理基础也是由于病灶内部纤维化、瘢痕收缩,通过肺的纤维间质牵拉游离的脏层胸膜,引起凹陷所致[33],是肺结节的恶性征象之一[34-35]。此外,本研究根据病灶是否含有实性成分将病灶分为纯磨玻璃结节(pure ground glass nodule,pGGN)和混合磨玻璃结节(mixed ground glass nodule,mGGN),结果显示,IAC中mGGN 的出现率明显高于PGL/MIA 组(78.95%vs 47.37%,P < 0.001)。相比于结节的形状和是否伴有胸膜反应,结节类型更能预测亚实性结节的浸润性,其比值比为4.307(1.612~11.511)。其原因为伴随着肺腺癌浸润程度的增加,肿瘤细胞的数量逐渐增多,周围肺泡间隔增厚,肺组织的含气量减少,当增生肿瘤细胞逐渐充填肺泡腔时,在CT 上常表现为平均CT 值的增高[16,36-37]。结节类型在一定程度上反映了结节的平均CT 值,如Zhang 等[38]研究证明结节中实性成分的比例和CT 值之间具有高度相关性(R2= 0.98, P < 0.001)。然而,传统的平均CT 值测量通常采用一维测量法,只能反映结节某个层面的情况,难以代表结节整体特征。如陈韵羽等[39]研究中结节的平均CT 值是由两位医师分别测量3 次取均值所获得,其最终模型的AUC仅为0.62。这可能是由于磨玻璃结节(ground glass nodule,GGN)内包含的成分复杂,可能会有血管、支气管、空泡等成分的干扰,导致CT 值的测量不够准确。而结节类型在临床工作中影像医师更易于判断及获得,且在不同诊断医师之间有较高的一致性。故本研究在传统影像学模型中使用结节类型替代平均CT 值,并且获得了不错的诊断效能。结节的直径也是判断其浸润性的重要标准之一[40],Kitami等[32]指出区分PGL/MIA 与IAC 的最佳直径阈值为10 mm。然而,由于观察者内部与观察者间的差异,定量及定性特征在不同诊断医师之间的可重复性较低,导致传统影像学模型的可推广性、泛化性较低。
既往研究多数基于平扫CT 影像组学特征预测亚实性肺结节的浸润性,并显示出较大价值[41-43],但基于增强CT 的组学特征是否更有优势的研究较少。Gao 等[44]研究表明,从增强CT 提取的组学特征在预测亚实性肺结节浸润性方面没有显著优势(AUC_增强: 0.868 vs AUC_平扫: 0.890),差异无统计学意义(P = 0.190)。Fan 等[21]研究基于平扫CT 构建组学模型,用于预测亚实性肺结节的浸润性,该模型在分别由平扫和增强图像所构成的验证集中表现出相近的性能(AUC_增强: 0.936 vs AUC_平扫: 0.942)。这均与本研究结果基本一致(AUC_增强: 0.890 vs AUC_平扫: 0.914)。此外,本研究显示,增强及平扫模型中所选择的特征完全不一致,这表明多数的影像组学特征可能容易受到造影剂的影响。类似的在Sun 等[45]研究中,平扫和增强模型中重要性排名前10 的特征中,只有1 个特征(wavelet_gldm_DependenceEntropy)是两者共有的。因此,本研究进一步探讨了基于平扫及增强CT 组学特征构建的综合模型的诊断效能。
本研究中,综合模型从平扫及增强CT 总计208 个特征中筛选出的4 个特征均被包含在前面两个模型中,这说明特征选择的可重复性较高。综合模型中纳入的增强特征包括Firstorder_Kurtosis 和GLSZM_ZoneEntropy。Firstorder_Kurtosis 是图像ROI中信号强度分布的“峰值”度量,量化了图像内灰度值分布的集中程度。GLSZM_ZoneEntropy 是衡量图像灰度分布随机性的特征参数,代表了图像纹理的复杂性,图像纹理越复杂,熵值越高。这两个增强特征最终被纳入综合模型均可能与结节的异质性相关。肿瘤的异质性主要表现为肿瘤病灶内的成分差异[46],在影像学上表现为结节密度不均匀。与平扫CT 相比,增强CT 能进一步反映肿瘤内部血供及分布的特性,这在诊断肺癌、肝细胞肝癌等恶性肿瘤时有较大的诊断价值[47]。研究显示,偏恶性的肺结节在增强CT 表现为稍高强化,可能与结节内部微血管密度及周围毛细血管的灌注及通透性增加有关[22,44]。本研究中综合模型AUC 略高于增强及平扫模型,表明综合模型可能更有助于对于亚实性肺结节浸润性的早期诊断。
本研究仍存在以下不足:①本研究作为回顾性研究,不可避免的存在选择偏倚;②本研究为单中心研究,后续需要多中心证明综合模型的泛化能力。
综上,基于平扫和增强CT 图像构建的综合模型,在预测亚实性肺结节的浸润性方面有一定的诊断价值,有可能在日常工作中为胸外科和放射科医生的临床决策提供助帮助。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
