LINC00662通过调控miR-199a-5p/MAP3K1通路对胃癌侵袭、转移的影响
2023-11-01于鹏杰才保加朱生茂蒲永强
于鹏杰,才保加,朱生茂,蒲永强
(青海大学附属医院胃肠肿瘤外科,西宁 810000)
胃癌在全球最常见的癌症中排名第5位,每年可致数十万人死亡[1]。随着消化道内镜技术的发展,胃癌患者的生存率得到显著提高[2]。然而,化疗和 (或) 放疗对转移性胃癌的治疗效果并不理想,胃癌转移是导致患者高死亡率的主要原因[3]。因此,探究胃癌转移的潜在机制具有重要的临床意义。越来越多的证据表明长链非编码RNA (long non-coding RNA,lncRNA) 在肿瘤发生发展中起着至关重要的调控作用。LINC00662是一种lncRNA,已有研究[4]表明LINC00662在结肠癌细胞中高表达,并促进细胞的增殖与转移。miR-199a-5p在宫颈癌细胞中低表达,过表达miR-199a-5p可抑制宫颈癌细胞增殖、迁移与侵袭[5]。丝裂原活化蛋白激酶激酶激酶1 (mitogen-activated protein kinase kinase kinase 1,MAP3K1) 作为MAP3K家族成员之一,其表达下调可抑制食管癌细胞增殖和侵袭[6]。生物信息学分析显示,LINC00662与miR-199a-5p存在结合位点,miR-199a-5p与MAP3K1存在结合位点,但LINC00662能否通过调控miR-199a-5p/MAP3K1来影响胃癌侵袭与转移尚不明确。因此,本研究探讨LINC00662对胃癌细胞侵袭、转移的影响,以及其对miR-199a-5p、MAP3K1的调控机制,旨在为明确胃癌转移的分子机制提供新的理论依据。
1 材料与方法
1.1 临床样本收集及细胞来源
收集2018年6月至2020年6月期间我院确诊的105例胃癌患者癌组织以及对应的癌旁组织 (距离癌组织3 cm),将所有收集的样本于液氮中冷冻后-80℃保存。本研究获得医院伦理委员会批准,所有患者均签署知情同意书。人胃癌SGC-7901细胞购自中国科学院上海细胞库。
1.2 主要试剂与仪器
miR-199a-5p模拟物 (miR-199a-5p) 及其阴性对照 (miR-NC)、miR-199a-5p抑制物 (anti-miR-199a-5p)及其阴性对照 (anti-miR-NC)、LINC00662 siRNA (si-LINC00662) 及其阴性对照 (si-NC) 均购自广州基迪奥生物科技公司;LipofectamineTM2000转染试剂盒购自上海慧颖生物科技有限公司;pcDNA3.1载体购自美国ThermoFisher公司;胎牛血清 (FBS)、RPMI 1640培养基均购自美国Gibco公司;反转录及荧光定量试剂盒购自北京百奥莱博科技有限公司;Trizol试剂、BCA试剂盒、ECL化学发光试剂盒购自美国Invitrogen公司;MAP3K1、基质金属蛋白酶 (matrix metalloproteinases,MMP) -2、MMP-9、神经型钙黏蛋白(neural cadherin,N-cadherin)、GAPDH兔多克隆抗体(anti-MAP3K1、anti-MMP-2、anti-MMP-9、anti-N-cadherin、anti-GAPDH)、辣根过氧化物酶 (HRP) 标记的羊抗兔二抗均购自武汉艾美捷科技有限公司;荧光定量PCR仪购自美国应用生物系统公司。
1.3 细胞培养及分组
将胃癌细胞SGC-7901置于含有10% FBS的RPMI1640培养基中,在37 ℃,5% CO2培养箱中培养。每隔1 d换1次培养液,进行常规传代培养。取对数生长期的SGC-7901细胞,利用LipofectamineTM2000转染试剂盒分别将si-NC、si-LINC00662、si-LINC00662与anti-miR-NC、si-LINC00662与anti-miR-199a-5p、si-LINC00662与miR-NC、si-LINC00662与miR-199a-5p、miR-NC、miR-199a-5p、pcDNA3.1、pcDNA3.1-LINC00662、anti-miR-NC、anti-miR-199a-5p转染于SGC-7901细胞,并分别设定为si-NC组、si-LINC00662组、si-LINC00662+anti-miR-NC组、si-LINC00662+anti-miR-199a-5p组、si-LINC00662+miR-NC组、si-LINC00662+miR-199a-5p组、miR-NC组、miR-199a-5p组、空载体组、LINC00662过表达组、anti-miR-NC组、anti-miR-199a-5p组,另取未转染的SGC-7901细胞设定为空白组,细胞转染48 h后用于后续实验。
1.4 实时定量PCR检测SGC-7901细胞中LINC00662、miR-199a-5p、MAP3K1 mRNA的表达
使用TRIzol试剂从胃癌组织和癌旁组织中提取总RNA。RNA的浓度和纯度用紫外分光光度计测定。使用反转录试剂盒将RNA逆转录成cDNA,并根据荧光定量试剂盒的操作说明书进行PCR扩增反应,U6和GAPDH分别作为miR-199a-5p、LINC00662与MAP3K1内参,以2-ΔΔCt法计算基因的相对表达量。所用引物包括:miR-199a-5p,正向5’-CCGGGAT CCGCAAACTCAGCTTTAC-3’,反向5’-CGGAATTCG TGGCGACCGTGATACC-3’;U6,正向5’-GTACAAA ATACGTGACGTAGAAAG-3,反向5’-GGTCDTTCGTC CTTTCCAC-3’;LINC00662,正向5’-AGGACAGAAT CTCCGTGGAC-3’,反向5’-TTGATCTTTTAGATTTC TGTCACACTC-3’;MAP3K1,正向5’-AACAACCGT ATAGAGAAGACA-3’,反向5’-TGAGCCTGATAACA AGAAGA-3’;GADPH,正向5’-GGAGCGAGATCCC TCCAAAAT-3’,反向5’-GGCTGTTGTCATACTTCTC ATGG-3’。
1.5 Transwell实验检测细胞侵袭与迁移
1.5.1 细胞侵袭:将基质胶涂于Transwell小室中,待自然干燥后收集对数生长期的SGC-7901细胞用胰蛋白酶消化,用PBS洗涤并重悬于无血清RPMI 1640培养基中,并将细胞密度调整为1×105/mL。取200 μL细胞悬浮液接种在上室中,将500 μL含有10%FBS的RPMI 1640培养基加入到下室中,然后将细胞在含有5% CO2的培养箱中37 ℃培养48 h。侵入下室的细胞用95%乙醇固定10 min,0.1%结晶紫染色10 min,PBS去除未染色的细胞。倒置显微镜下观察,随机选取5个视野的细胞进行计数。
1.5.2 细胞迁移:Transwell小室中不涂基质胶。收集对数生长期的SGC-7901细胞用胰蛋白酶消化,用PBS洗涤并重悬于无血清RPMI 1640培养基中,并将细胞密度调整为1×105/mL。其他步骤同1.5.1。
1.6 划痕实验检测细胞迁移
将各组细胞接种到6孔板中并在培养箱中孵育,当其汇合度约达到100%时用无菌的200 μL枪头尖端垂直水平划线,然后利用PBS洗涤除去漂浮的细胞并在无血清培养基中孵育。使用倒置显微镜观察细胞在0、24 h时迁移情况并拍照。划痕愈合率(%) = (1~24 h的划痕面积/0 h的划痕面积) ×100。
1.7 Western blotting检测细胞中MAP3K1、MMP-2、MMP-9、N-cadherin表达
将各组细胞用PBS洗涤2次后,置于预冷的RIPA裂解缓冲液中裂解并提取总蛋白。在10%十二烷基硫酸钠-聚丙烯酰胺 (SDS/PAGE) 凝胶上分离蛋白质,电印迹到聚偏二氟乙烯膜上,将膜用5%脱脂牛奶封闭1 h后加入一抗anti-MAP3K1、anti-MMP-2、anti-MMP-9、anti-N-cadherin、anti-GAPDH于4 ℃下孵育过夜,第2天用TBST洗涤3次后,加入HRP标记的羊抗兔二抗于室温下孵育2 h,使用ECL发光试剂盒检测蛋白质的显色情况,利用Image-J软件分析蛋白质的灰度值。
1.8 双荧光素酶报告基因实验
使用Starbase网站 (http://starbase.sysu.edu.cn/)预测LINC00662与miR-199a-5p、miR-199a-5p与MAP3K1的结合位点。分别构建LINC00662、MAP3K1 3’-UTR区的野生型 (WT) 和突变型 (MUT) 质粒,记为WT-LINC00662、MUT-LINC00662、WT-MAP3K1、MUT-MAP3K1,利用LipofectamineTM2000转染试剂盒分别将WT-LINC00662、MUT-LINC00662、WT-MAP3K1、MUT-MAP3K1与miR-NC、miR-199a-5p共转染于SGC-7901细胞,转染后24 h收获细胞,使用双荧光素酶报告基因检测系统检测双荧光素酶活性。
1.9 统计学分析
使用SPSS 21.0软件进行统计分析,计量资料采用x-±s表示。2组间比较采用t检验,多组间比较采用单因素方差分析,进一步两组间比较采用SNK-q检验,P< 0.05为差异有统计学意义。
2 结果
2.1 LINC00662、miR-199a-5p、MAP3K1在胃癌组织中的表达
与癌旁组织比较,胃癌组织中LINC00662、MAP3K1mRNA表达水平显著升高,miR-199a-5p表达水平显著降低 (均P< 0.001),见表1。
2.2 LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响
结果显示,与空白组 (1.03±0.12) 和si-NC组 (1.05±0.14) 比较,si-LINC00662组 (0.35±0.06) SGC-7901细胞中LINC00662表达水平显著降低 (均P< 0.05)。与空白组和si-NC组比较,si-LINC00662组SGC-7901细胞侵袭、迁移细胞数目显著减少,划痕愈合率显著降低,MMP-2、MMP-9、N-cadherin、MAP3K1蛋白表达显著降低 (P< 0.05),见图1。
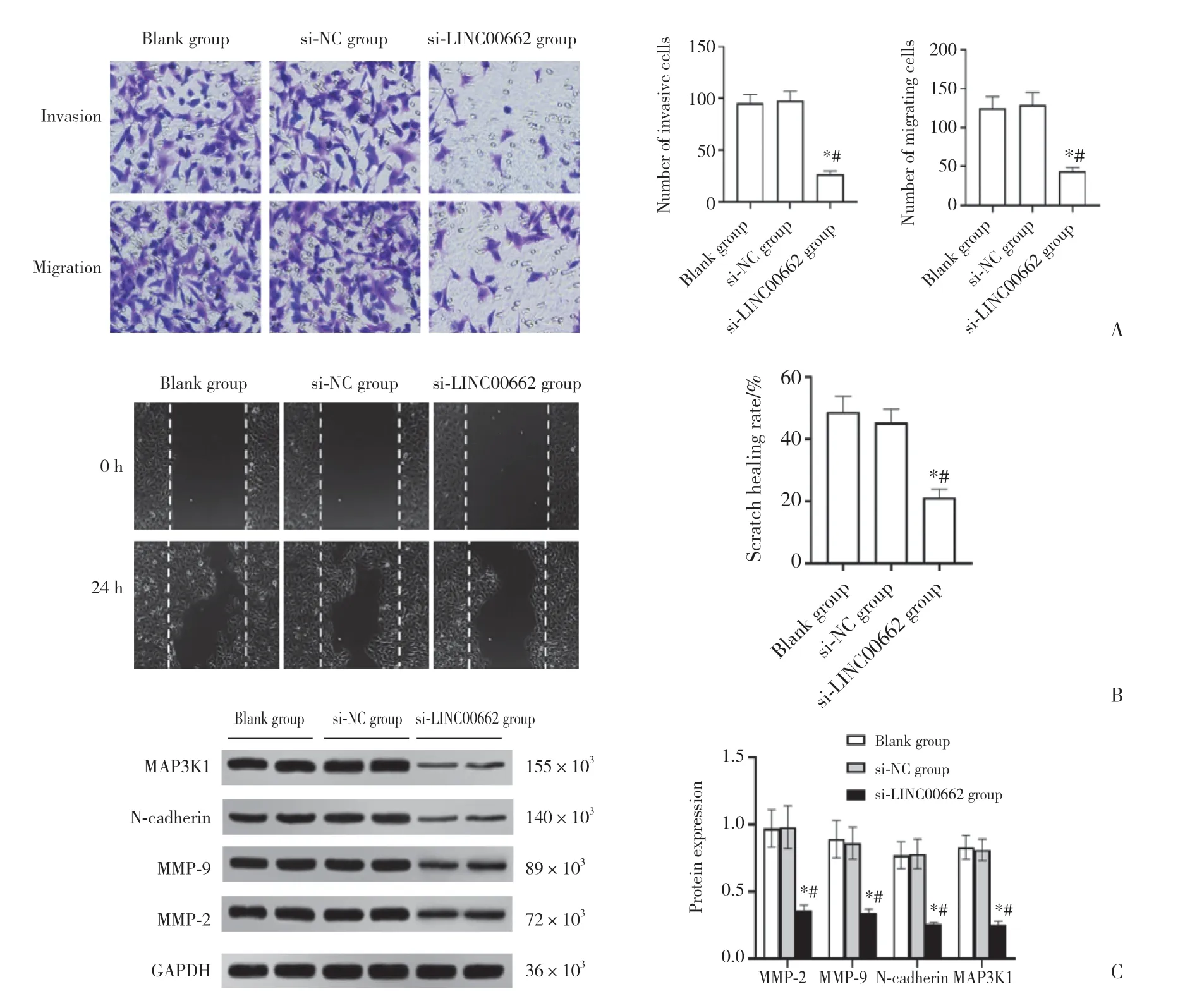
图1 LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响Fig. 1 Effect of LINC00662 inhibition on the invasion and migration of gastric cancer SGC-7901 cells
2.3 各转染组SGC-7901细胞中miR-199a-5p表达比较
结果显示,空白组、si-NC组、si-LINC00662组、si-LINC00662+anti-miR-NC组、si-LINC00662+anti-miR-199a-5p 组、si-LINC00662+miR-NC 组、si-LINC00662+miR-199a-5p 组miR-199a-5p表达分别为1.02±0.14、1.03±0.15、2.21±0.24、1.03±0.13、0.39±0.05、1.06±0.12、2.89±0.32。与空白组和si-NC组比较,si-LINC00662组SGC-7901细胞中miR-199a-5p表达显著升高 (P< 0.05);与si-LINC00662组和si-LINC00662+anti-miR-NC组比较,si-LINC00662+anti-miR-199a-5p组SGC-7901细胞中miR-199a-5p表达显著降低 (P< 0.05);与si-LINC 00662组和si-LINC00662+miR-NC组比较,si-LINC00662+miR-199a-5p组SGC-7901细胞中miR-199a-5p表达显著升高 (均P< 0.05)。
2.4 抑制miR-199a-5p可减弱LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响(图2)
与si-LINC00662组和si-LINC00662+anti-miR-NC组比较,si-LINC00662+anti-miR -199a-5p组SGC-7901细胞中MAP3K1蛋白表达显著升高,侵袭、迁移细胞数目显著升高,划痕愈合率显著升高,MMP-2、MMP-9、N-cadherin蛋白表达显著升高 (P< 0.05),见图2。
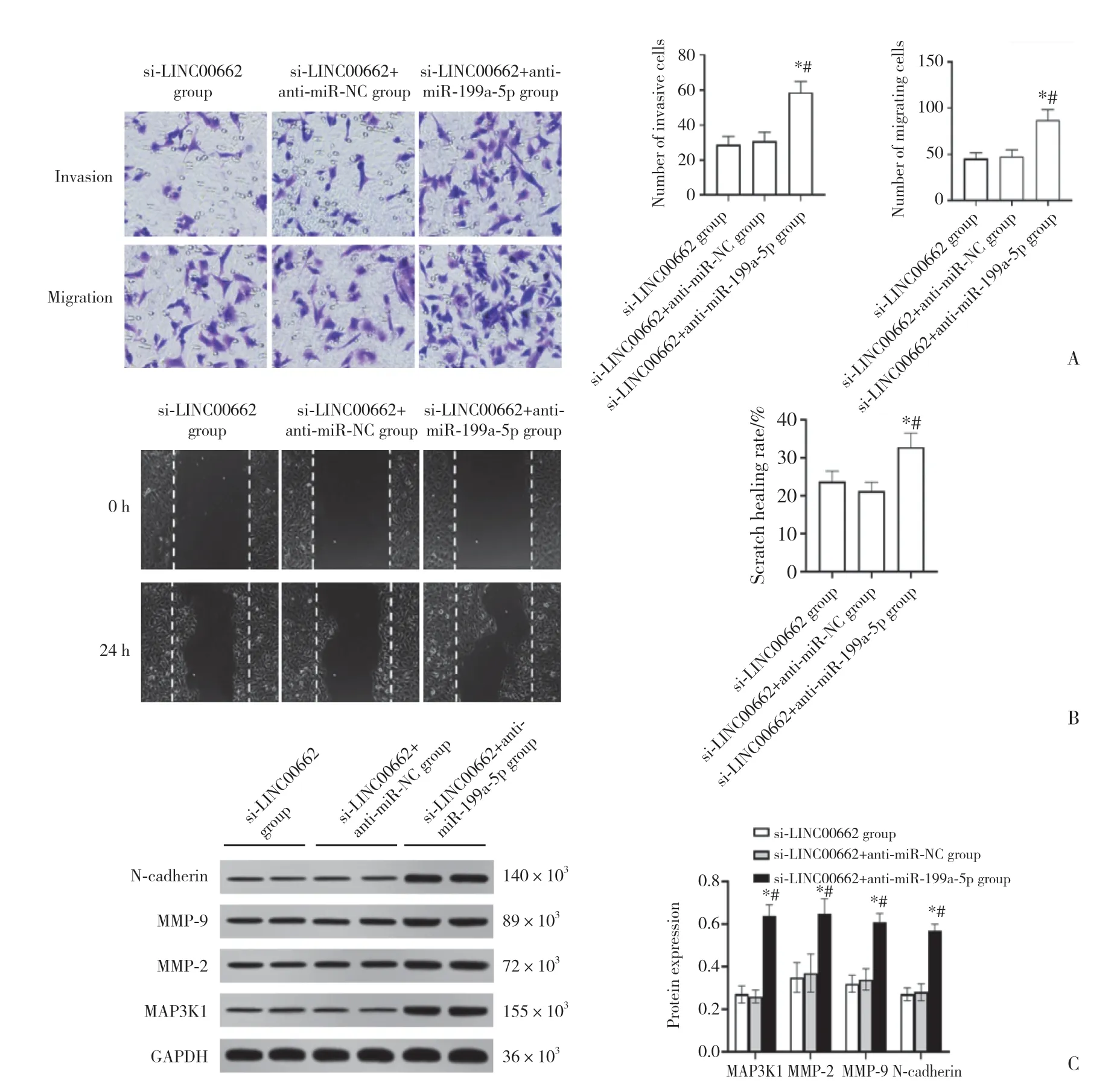
图2 抑制miR-199a-5p可减弱LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响Fig.2 Inhibition of miR-199a-5p could attenuate the effect of LINC00662 inhibition on the invasion and migration of gastric cancer SGC-7901 cells
2.5 上调miR-199a-5p表达可增强LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响
与si-LINC00662组和si-LINC00662+miR-NC组比较,si-LINC00662+miR-199a-5p组SGC-7901细胞中MAP3K1蛋白表达显著降低,侵袭、迁移细胞数目显著降低,划痕愈合率显著降低,MMP-2、MMP-9、N-cadherin蛋白表达显著降低 (P< 0.05),见图3。
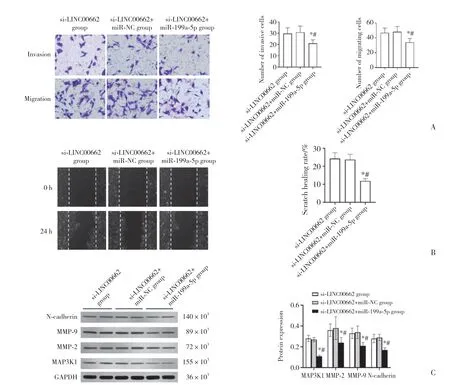
图3 上调miR-199a-5p表达可增强LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响Fig.3 Upregulation of miR-199a-5p expression could enhance the effect of LINC00662 inhibitory on the invasion and migration of gastric cancer SGC-7901 cells
2.6 LINC00662与miR-199a-5p、miR-199a-5p与MAP3K1靶向关系的验证
结果显示,LINC00662与miR-199a-5p存在结合位点,miR-199a-5p与MAP3K1存在结合位点,见图4。与miR-NC组比较,miR-199a-5p组WT-LINC00662胃癌SGC-7901细胞的荧光素酶相对活性降低 (P<0.05),而miR-199a-5p组MUT-LINC00662胃癌SGC-7901细胞的荧光素酶相对活性无统计学差异 (P>0.05),见表2。与miR-NC组比较,miR-199a-5p组WTMAP3K1胃癌SGC-7901细胞的荧光素酶相对活性降低 (P< 0.05),而miR-199a-5p组MUT-MAP3K1胃癌SGC-7901细胞的荧光素酶相对活性无统计学差异(P> 0.05),见表2。与空白组 (1.01±0.11) 和空载体组(1.04±0.12) 比较,LINC00662过表达组 (0.41±0.05)中miR-199a-5p表达水平显著降低 (均P< 0.05)。与空白组和miR-NC组比较,miR-199a-5p组中MAP3K1蛋白表达水平显著降低 (P< 0.05);与空白组和antimiR-NC组比较,anti-miR-199a-5p组中MAP3K1蛋白表达显著升高 (P< 0.05),见图5。
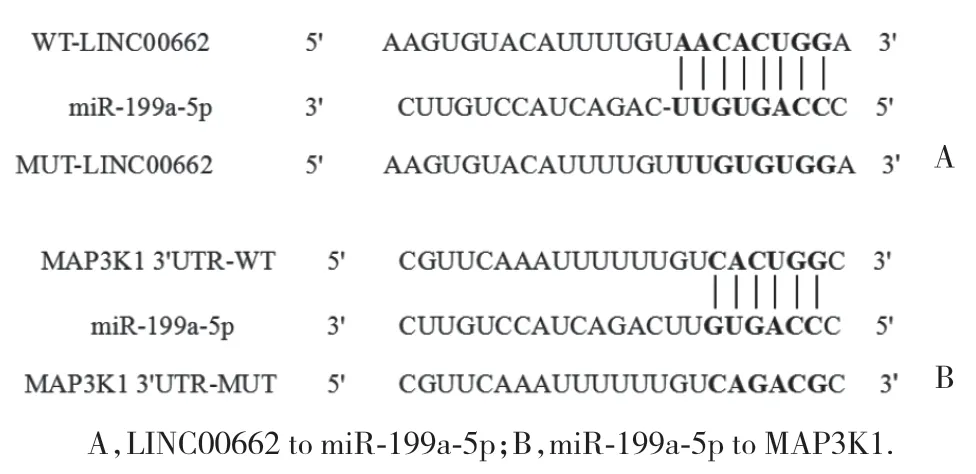
图4 Starbase网站预测LINC00662与miR-199a-5p、miR-199a-5p与MAP3K1的结合位点Fig.4 Binding sites of LINC00662 to miR-199a-5p and those of miR-199a-5p to MAP3K1 were predicted using Starbase website
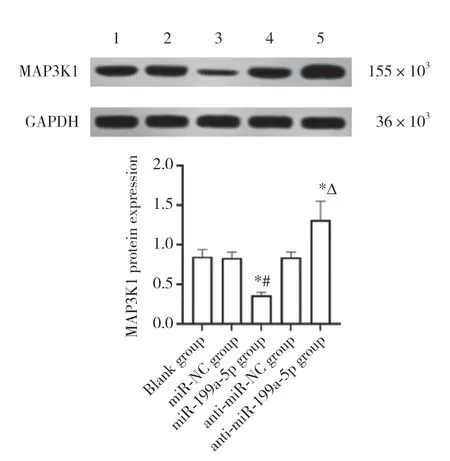
图5 Western blotting检测各组细胞中MAP3K1蛋白表达Fig.5 Expression of MAP3K1 protein in each group by Western blotting
表2 miR-NC组和miR-199a-5p组荧光素酶活性比较 (,n = 6)Tab.2 Comparison of luciferase activity between miR-NC and miR-199a-5p groups (,n = 6)

表2 miR-NC组和miR-199a-5p组荧光素酶活性比较 (,n = 6)Tab.2 Comparison of luciferase activity between miR-NC and miR-199a-5p groups (,n = 6)
GroupWT-LINC00662MUT-LINC00662WT-MAP3K1MUT-MAP3K1 miR-NC group1.05±0.121.06±0.111.01±0.101.04±0.12 miR-199a-5p group0.36±0.071.02±0.100.29±0.051.03±0.11 t 12.1660.65915.7740.150 P<0.0010.525<0.0010.883
3 讨论
尽管目前胃癌的诊治已取得突破性进展,但胃癌患者的5年生存率依然很低[7]。由于胃癌的死亡率与胃癌的转移密切相关,因此,迫切需要寻找肿瘤转移新的生物标志物,以便靶向治疗来提高患者生存率。
研究[8]证实,lncRNA在调控多种癌细胞的增殖、凋亡和转移中发挥重要作用。相关研究表明,LINC00662在前列腺癌组织及细胞中呈相对高表达,敲低其表达可抑制前列腺癌细胞增殖、侵袭和迁移,并促进其凋亡[9];LINC00662在肝癌组织中上调并与肝癌患者肿瘤大小、侵袭和较差的存活率相关[10];LINC00662过表达通过激活ERK信号通路促进结肠癌增殖、侵袭和迁移[11]。本研究结果显示,LINC00662在胃癌组织中高表达,下调LINC00662表达可抑制胃癌SGC-7901细胞的侵袭与迁移,提示LINC00662在胃癌中发挥着促癌基因的作用。相关研究指出MMP-2和MMP-9是MMPs家族中与肿瘤转移关系最为密切的两个成员,其可以通过降解细胞外基质中的Ⅳ型胶原酶促进肿瘤转移[12];N-cadherin是上皮间质转化的重要标志分子,其在肿瘤细胞中高表达可导致上皮间质转化,进而促进细胞迁移和侵袭[13]。本研究结果显示,下调LINC00662表达可抑制胃癌SGC-7901细胞中MMP-2、MMP-9、N-cadherin蛋白表达,提示沉默LINC00662可能通过下调MMP-2、MMP-9、N-cadherin表达抑制SGC-7901细胞的侵袭与迁移。
miR-199a-5p在多种肿瘤细胞中异常表达,参与调控肿瘤细胞的增殖代谢、侵袭转移等过程[14]。研究显示,过表达miR-199a-5p能够下调DDR1表达,抑制人脑胶质瘤细胞增殖和迁移[15];miR-199a-5p在非小细胞肺癌组织中低表达,其表达上调可抑制非小细胞肺癌细胞的增殖[16];miR-199a-5p在喉癌组织中的表达明显低于癌旁组织,过表达miR-199a-5p可显著抑制喉癌细胞的增殖、侵袭和迁移,同时诱导细胞凋亡[17]。本研究结果显示,miR-199a-5p在胃癌组织中低表达,抑制miR-199a-5p可减弱抑制LINC00662对胃癌SGC-7901细胞侵袭、迁移的影响,上调miR-199a-5p表达可增强抑制LINC00662对胃癌SGC-7901细胞侵袭、迁移的影响,提示抑制LINC00662可能通过上调miR-199a-5p的表达抑制SGC-7901细胞侵袭、迁移。MAP3K1是广泛存在于人体内的一种重要激酶,具有调控细胞迁移的作用[18]。有研究表明,过表达miR-196b通过下调MAP3K1来抑制人绒毛膜癌细胞的增殖、迁移和侵袭[19];miR-451可以通过抑制MAP3K1来抑制食管癌细胞增殖[20]。本研究结果显示,MAP3K1mRNA在胃癌组织中高表达,沉默LINC00662后胃癌SGC-7901细胞中miR-199a-5p表达上调,MAP3K1蛋白表达下调,提示抑制LINC00662可能通过调控miR-199a-5p/MAP3K1来抑制胃癌细胞的侵袭与迁移。同时本研究还证实了LINC00662可靶向负调控miR-199a-5p的表达,miR-199a-5p可靶向负调控MAP3K1的表达,提示抑制LINC00662可通过靶向上调miR-199a-5p的表达进而间接下调MAP3K1的表达来发挥对胃癌细胞侵袭与迁移的抑制作用。
综上所述,抑制LINC00662可通过调控miR-199a-5p/MAP3K1抑制胃癌细胞侵袭与迁移。本研究为胃癌的早期诊断及靶向治疗提供了参考依据。
