IL-9 及其受体通过STAT3 通路激活巨噬细胞促进慢性阻塞性肺疾病进展
2023-11-01高媛周新佳周妍赵立
高媛,周新佳,周妍,赵立
(中国医科大学附属盛京医院 1. 呼吸与危重症科; 2. 耳鼻咽喉头颈外科,沈阳 110004)
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD) 是一种常见的慢性气道炎症疾病,严重危害人类身体健康[1]。研究[2]表明,免疫失衡在COPD中起重要作用。作为免疫调节的中心环节,辅助T细胞及其产生的细胞因子参与黏膜炎症的各种免疫反应[3-4]。白细胞介素-9 (interlukin-9,IL-9) 是一种多功能细胞因子,主要由活化的Th9细胞分泌。 IL-9与IL-9受体 (IL-9 receptor,IL-9R) 结合后,激活STAT3通路,启动一系列基因表达,发挥相应的生物学作用[5]。既往研究[6]表明,COPD患者肺组织中IL-9的表达上调。此外,也有研究[7]表明IL-9促进COPD疾病进展,具体机制可能与氧化应激有关。
巨噬细胞是机体重要的免疫细胞,通过抗原呈递参与炎症反应的发生、发展,是COPD免疫致病机制的关键环节[8-9]。 巨噬细胞具有高度可塑性,当受到微环境的刺激时,其表型和功能会发生适应性变化[10]。 香烟烟雾可诱导巨噬细胞活化并增加数量。 活化的巨噬细胞释放趋化因子和基质金属酶,促进炎症并破坏肺微环境[11]。JAK/STAT3是COPD发生发展的重要信号通路之一。 它参与多种细胞因子的信号转导,影响T细胞的分化。有研究[12]表明,IL-9与IL-9R结合可以激活巨噬细胞。目前,IL-9在COPD发展中的调控机制尚未阐明,IL-9在COPD病程中对巨噬细胞功能的影响亦不清楚。本研究通过构建香烟烟雾诱导的COPD小鼠模型,探讨 IL-9及IL-9R在COPD进展中的作用机制。
1 材料与方法
1.1 材料及实验动物
红双喜香烟 (烟尼古丁含量1.2 mg/支,焦油含量15 mg/支) 购自上海卷烟厂。IL-9多克隆抗体 (bs-2428R)、P-STAT3抗体 (bs-1658R) 和基质金属蛋白酶12 (matrix metalloproteinase,MMP12) 抗体 (bs-1854R) 购自北京Bioss公司。 IL-9R 抗体 (ab233757) 购自英国Abcam公司,STAT3 抗体 (#12640S)、GAPDH (#5174S) 购自美国CST公司,p-STAT3 (sc-8059P) 购自美国Santa Cruz 公司。白细胞介素-6 (interleukin-6,IL6) 检测试剂盒 (SEA079Hu) 购自美国USCN公司,肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) 检测试剂盒 (SEA133Hu) 购自美国USCN公司,MMP-12检测试剂盒 (SEA402Hu) 购自美国USCN公司。AG490(CSGC13854) 购自武汉科斯坦生物科技公司。小鼠肺泡巨噬细胞 (MH-S) 购自上海酶研生物科技有限公司。24只雄性C57BL/6小鼠 (8周龄,体质量20~25 g) 购自辽宁长生生物技术公司。
1.2 实验分组及香烟烟雾诱导的COPD小鼠模型建立
小鼠在 (22±2) ℃、相对湿度 (55±15) %、光照12 h/黑暗12 h的清洁环境中饲养。应用随机数字表将24只小鼠均分为3组:吸烟组[CS组,每天放置在舱内,建立香烟烟雾诱导的COPD小鼠模型 (香烟暴露:10支/次,2次/d,60 min/次,5 d/周,连续暴露6个月) ]、戒烟组[cession-CS组,小鼠每天置于舱内,连续香烟暴露 (10支/次,2次/d,60 min/次,5 d/周) 6个月,停止烟雾暴露6个月]、对照组 (小鼠暴露于过滤空气中,除香烟暴露外,其他条件与吸烟组相同,连续暴露6个月)。3组均在实验后 24 h内腹腔麻醉小鼠 (10%水合氯醛溶液,0.3 mL/100 g),通过眶后动脉放血处死。取出左肺,10%甲醛灌注左肺下叶,使之膨胀后再用10%甲醛固定48 h后石蜡包埋保存备用。右肺组织迅速移至-80 ℃冰箱保存备用。本研究经中国医科大学盛京医院动物伦理委员会批准 (批准文号:2016PS179K)。
小鼠肺泡巨噬细胞 (MH-S)给予不同浓度 (0、10、30 ng /mL) IL-9干预,干预 2、4、6、12 h时检测IL-6、TNF-α、MMP-12水平。进一步将小鼠肺泡巨噬细胞(MH-S) 分为对照组、干预组 (加入30 ng /mL IL-9干预12 h)、AG490+IL-9干预组 (加入AG490、30 ng/mL IL-9干预12 h)。采用PCR及Western blotting检测STAT3、p-STAT3及MMP-12的表达情况。
1.3 方法
1.3.1 HE 染色:取石蜡包埋的肺组织,在距肺门 3 mm 处连续水平切片 (厚度3~4 μm)。乙醇和二甲苯脱蜡至水,苏木精浸渍,1%盐酸乙醇分化,0.5%伊红溶液复染,透明盖玻片脱水。每张切片在10 倍物镜下随机选取10 个非重复视野,在 100 倍物镜下采集图像,由2位病理医生读片,获得肺泡间隔 (linear intercept,Lm) 和肺泡破坏指数 (destructive index,DI)。Lm反映肺泡直径,具体测量方法:避开大血管和支气管,在视野的中心画十字,计算与十字相交的肺泡间隔数,测量十字的总长度,根据Lm=十字总长度/肺泡格数来计算。DI反映肺泡壁结构的破坏程度,具体测量方法:目镜内放置一个标有42个点的计数网格。如果视野中的标记点落在所见的肺泡腔或肺泡囊腔内,则记为肺泡正常 (normal alveolar and/or duct spaces,N) 或肺泡破坏 (destroyed alveolar and/or duct spaces,D);如果标记点落在其他结构上则不记录。计算DI=D /(D + N) 。
1.3.2 免疫组织化学染色:取3组石蜡包埋肺组织,切片、脱蜡、水化后,抗原修复,用3%过氧化氢去除内源性氧化酶,山羊血清封闭,滴加一抗 (1 ∶400)、二抗PBS洗片孵育,DAB显色、复染、封片。各型炎症细胞以胞质和 (或) 胞膜呈棕黄色或棕褐色判定为阳性表达[13]。采用奥林巴斯光学显微镜 (40倍) 观察切片,通过Image-ProPlusV6.O图像软件分析3组阳性表达结果。
1.3.3 ELISA检测:小鼠肺泡巨噬细胞 (MH-S) 于37℃、5% CO2培养箱中培养,通过加入不同浓度 (0、10、30 ng /mL) IL-9干预MH-S细胞,在干预2、4、6、12 h后使用检测试剂盒检测TNF-α、IL-6和MMP-12的表达水平,操作均按照试剂盒说明书进行。
1.3.4 实时定量PCR (real-time quantitative PCR,qRT-PCR):使用Mini BEST Universal RNA Extraction Kit (9767,日本TaKaRa公司) 提取3组小鼠肺组织标本及肺泡巨噬细胞总RNA,并使用PrimeScriptTMRT Master MIX (RR036A,日本TaKaRa公司) 合成cDNA模板。使用紫外分光光度法测定 RNA 浓度和纯度。采用 One Step SYBR®PrimeScriptTMRT-PR KitⅡ(日本TaKaRa公司) 将 0.5 μg 总 RNA 逆转为 cDNA。使用 BIO-RAD (美国伯乐公司) 进行检测。引物序列:β-actin,正向5’-GCAGAAGGAGATTACTGCTCT-3’,反向5’-GCTGATCCACATCTGCTGGAA-3’;IL-9,正向5’-CTGCTTGTGTCTCTCCGT-3’,反向5’-GACT TCAACTATCCTTTTCACC-3’;IL-9R,正向5’-GCTT TGTCCACCTTCTGTT-3’,反向5’-CACCATTCTGTCT TGCTTG-3’;MMP-12,正向5’-ATTTCCACACACTTCC CA-3’,反向5’-ACCCTTCACTACATTCTTCCT-3’;STAT3,正向5’-TCTACCTCTACCCCGACATT-3’,反向5’-ACTCAAACTGCCCTCCTG-3’。扩增产物长度为 135 bp。利用 2-ΔΔCt计算基因表达水平。
1.3.5 Western blotting检测:提取组织总蛋白,采用BCA法定量。 按每孔30 μg蛋白量进行电泳,将分离的蛋白转膜、封闭、加入一抗孵育。用三羟甲基氨基甲烷缓冲盐水洗涤膜后,加入辣根过氧化物酶标记的二抗。 室温孵育1 h,洗膜后显色。采用江苏捷达801成像系统分析IL-9、IL-9R、STAT3、p-STAT3、MMP-12蛋白的吸光度。相对蛋白含量采用目标蛋白条带值/内参GAPDH条带值表示。
1.4 统计学分析
采用GraphPad Prism 8.0进行统计分析,计量资料以表示。 多组间比较采用单因素方差分析。组间两两比较方差一致的采用 Bonferroni 检验,方差不一致的采用Dunnett’s T 3 检验。P< 0.05 为差异有统计学意义。
2 结果
2.1 3组小鼠气道炎症及肺泡损伤结果
HE 染色结果 (图1A) 显示,对照组小鼠肺泡结构完整,无明显炎症细胞浸润。 CS组小鼠支气管壁、血管壁、肺泡均有明显的炎性细胞浸润,杯状细胞有不同程度增殖。与对照组比较,CS组肺泡腔变大,肺泡间隔破裂。肺大泡融合,炎症细胞浸润明显。cession-CS组小鼠肺泡腔扩大,肺泡间隔破裂,炎症细胞浸润程度较CS组加重。进一步分析结果表明,CS组和cession-CS组Lm和DI均显著高于对照组 (P<0.001)。与CS组比较,cession-CS组Lm和DI显著升高(P< 0.05)。见图1B。表明香烟烟雾诱导的COPD小鼠模型建立成功。香烟烟雾暴露对小鼠肺组织造成严重损害,并且戒烟后损害仍然加重。

图1 3组肺组织HE染色及病理形态学定量分析结果Fig.1 HE staining and histopathologic quantitative analysis of lung tissue in 3 groups
2.2 各组小鼠肺组织IL-9、IL-9R表达变化
免疫组织化学结果显示,IL-9和IL-9R 阳性细胞分布于肺泡壁、气道壁和巨噬细胞壁。 IL-9主要在浸润性炎症细胞中表达。CS组及cession-CS组肺泡壁和小气道IL-9和IL-9R阳性表达高于对照组 (均P<0.05);而CS组IL-9和IL-9R阳性表达高于cession-CS组 (P< 0.05),见图2。
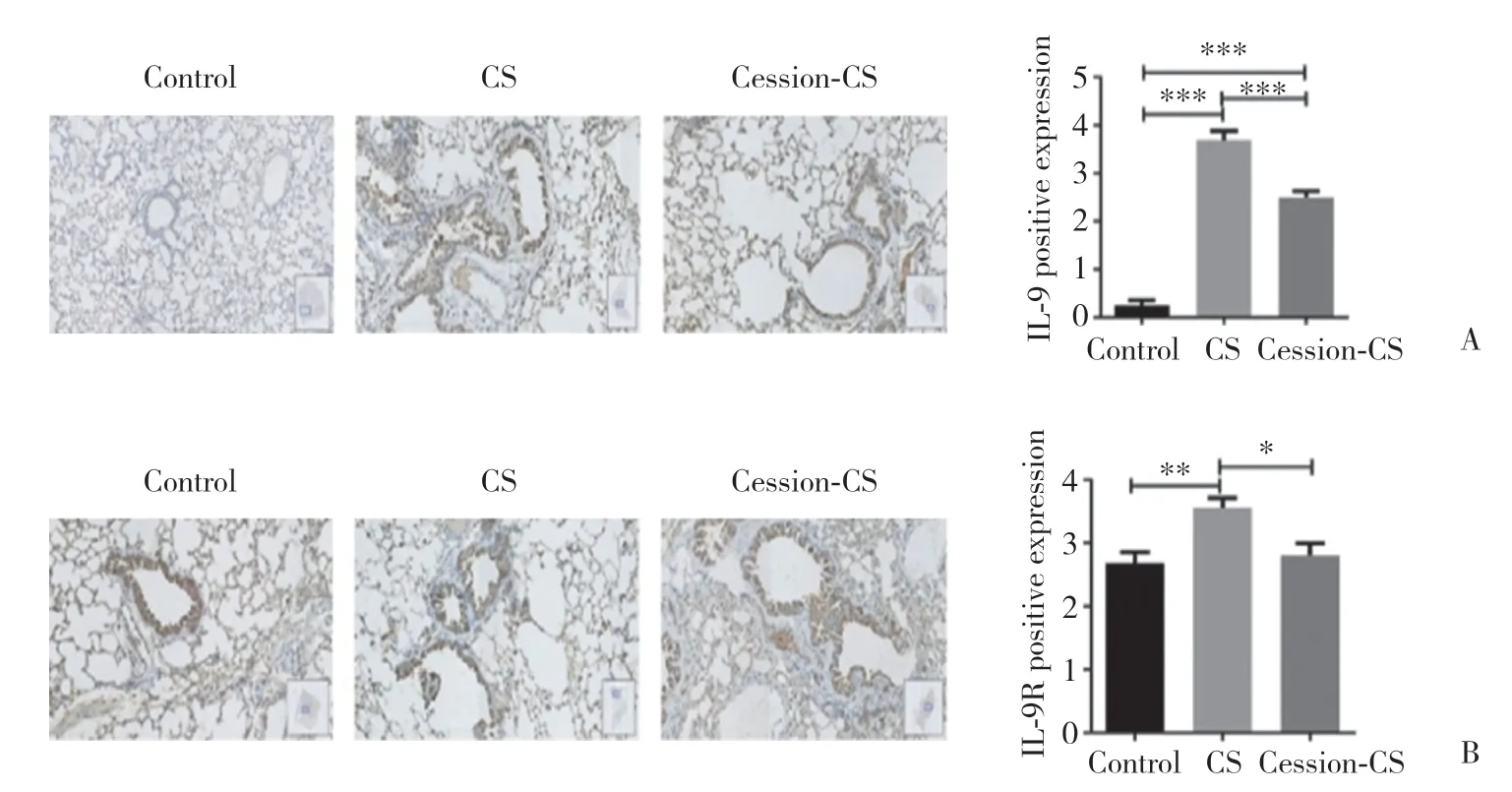
图2 免疫组织化学检测各组肺组织中IL-9和IL-9R阳性表达Fig.2 Positive expressions of IL-9 and IL-9R in lung tissues of each group determined using immunohistochemistry
2.3 各组小鼠肺组织IL-9、IL-9R、STAT3、p-STAT3、MMP-12表达
通过qRT-PCR及Western blotting检测小鼠肺组织IL-9、IL-9R、STAT3、p-STAT3、MMP-12表达的变化。结果显示,与对照组比较,CS组小鼠肺组织IL-9、IL-9R、STAT3和MMP-12表达显著升高 (均P< 0.01)。与CS组比较,cession-CS组IL-9、IL-9R、STAT3和MMP-12表达显著降低 (均P< 0.05),见图3A。 进一步Western blot-ting检测结果显示,与对照组比较,CS组小鼠肺组织IL-9、IL-9R、p-STAT3和MMP-12表达显著升高(P< 0.01)。与CS组比较,cession-CS组小鼠肺组织IL-9、IL-9R、p-STAT3及MMP-12水平降低 (P< 0.01),但仍显著高于对照组,见图3B。
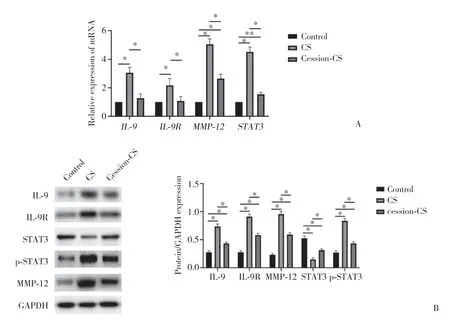
图3 3组小鼠肺组织中IL-9、IL-9R、MMP-12、STAT3表达比较Fig.3 Comparison of IL-9,IL-9R,MMP-12,and STAT3 expressions in lung tissue of mice in 3 study groups
2.4 不同浓度 IL-9 对肺泡巨噬细胞炎症反应的影响
ELISA检测结果显示,与0 ng /mL IL-9比较,10、30 ng /mL IL-9干预2、4、6、12 h时肺泡巨噬细胞分泌IL-6、TNF-α和MMP-12水平逐渐增加 (P< 0.05)。与0 ng /mL IL-9比较,30 ng /mL IL-9干预12 h肺泡巨噬细胞分泌IL-6、TNF-α和MMP-12水平增加更明显 (均P< 0.000 1)。可见,随着IL-9浓度增加,肺泡巨噬细胞分泌 TNF-α、IL-6和MMP-12的水平也提高,见图4。
2.5 IL-9通过JAK/STAT3通路促进巨噬细胞活化
AG490可抑制JAK的激活,进而抑制下游因子p-STAT3水平。进一步将小鼠肺泡巨噬细胞分为对照组、IL-9 (30 ng /mL) 组、AG490+IL-9组,观察IL-9通过JAK/STAT3通路对MMP-12转录的影响。PCR结果显示,与对照组比较,IL-9组MMP-12表达上调,而AG490+IL-9组逆转了这种上调 (均P< 0.001)。Western blotting检测结果显示,与对照组比较,IL-9组MMP-12、p-STAT3表达升高,STAT3表达下降 (均P<0.05);与IL-9组比较,AG490+ IL-9组MMP-12、p-STAT3表达下降,而STAT3表达升高 (均P< 0.05)。表明IL-9通过JAK/STAT3通路促进MMP-12的转录。见图5。
3 讨论
COPD是一种进行性慢性气道炎症疾病,临床表现为不完全可逆的气流受限和肺功能下降[14]。吸烟是发生COPD的主要危险因素。炎症反应是COPD的核心机制,主要影响小气道和肺实质,引起小气道阻塞[15]。戒烟后COPD炎症并不能完全消除,COPD患者戒烟后肺部炎症持续存在,并继续发展为肺气肿[16]。本研究构建了香烟烟雾诱导的COPD小鼠模型。结果表明,戒烟后很长时间吸烟引起的损害仍然持续存在,与以往研究结果一致。
免疫调节在炎症的发展中起重要作用。多项研究表明,CD4+T细胞亚群 (包括Th1、Th2、Th17和调节性T细胞) 介导的免疫反应在COPD的发生发展中起重要作用。 Th9 细胞由 VELDHOEN 等[17]和 DARDALHON等[18]发现,是CD4+T淋巴细胞的一个新亚群。研究[19-20]显示Th9细胞及其分泌的细胞因子 IL-9参与免疫介导的疾病。哮喘或接触性皮炎患者外周血中Th9细胞明显增加,提示Th9细胞可能与过敏性疾病的发病有关。近期关于COPD的研究[5-6]表明,COPD患者诱导痰液中IL-9水平显著升高,提示IL-9参与了疾病进展。本研究免疫组化、Western blotting和PCR检测结果显示,香烟烟雾暴露诱导的COPD小鼠IL-9和下游信号通路激活。而戒烟后小鼠肺部IL-9和下游的STAT3/MMP-12通路仍处于过度激活状态。这些结果表明IL-9在COPD的疾病进展中起重要作用,在戒烟后也是持续气道重塑和肺气肿进展的重要因素。
IL-9R属于γ链细胞因子受体家族,由一条α链和一条γ链组成[21]。IL-9R在许多免疫细胞 (肥大细胞、嗜酸性粒细胞、中性粒细胞和巨噬细胞) 中表达[22]。其中,巨噬细胞是连接先天免疫和适应性免疫的重要桥梁,是呼吸道和肺部抵御微生物感染的第一道防线。巨噬细胞活化在肺部疾病,尤其是COPD 中起着至关重要的作用。本研究结果显示,随着IL-9干预浓度的增加,小鼠肺泡巨噬细胞炎性细胞因子TNF-α、IL-6和MMP-12分泌显著增加,表明IL-9通过受体IL-9R影响巨噬细胞炎症反应。研究[23]表明,IL-9与靶细胞表面的IL-9R结合后,激活JAK/STAT3通路,启动一系列炎性细胞因子转录,从而发挥生物学效应。本研究结果表明,Th9细胞分泌的IL-9 通过JAK/STAT3通路促进巨噬细胞活化,与以往研究结果一致。
综上所述,香烟烟雾诱导的 COPD 小鼠IL-9 及其下游信号通路激活;而戒烟后小鼠肺气肿持续加重,IL-9及其下游信号通路持续激活。IL-9 及IL-9R通过STAT3 通路激活巨噬细胞,促进COPD进展。本研究存在一定局限性:IL-9调控巨噬细胞功能的具体机制尚未明确;此外,缺乏临床病理标本的验证,因此仍需进一步研究论证。
