槲皮素对钛颗粒诱导的成骨细胞凋亡抑制作用研究
2023-11-01游镇君蒋毅吴可沁季斌胡安全蒋侃凌
游镇君,蒋毅,吴可沁,季斌,胡安全,蒋侃凌
槲皮素对钛颗粒诱导的成骨细胞凋亡抑制作用研究
游镇君,蒋毅,吴可沁,季斌,胡安全,蒋侃凌
浙江省嘉兴市第一医院骨科,浙江嘉兴 314000
探讨槲皮素对钛颗粒诱导的成骨细胞凋亡的抑制作用。采用钛颗粒处理小鼠MC3T3-E1细胞系构建细胞凋亡模型,应用槲皮素进行干预并设置对照,噻唑蓝法[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,MTT法]法检测细胞增殖活性,流式细胞术检测细胞凋亡,酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)检测白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达,免疫荧光技术检测C/EBP同源蛋白(C/EBP homologous protein,CHOP)、B细胞淋巴瘤因子2(B-cell lymphoma-2,Bcl-2)蛋白的表达,实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)检测CHOP和Bcl-2的mRNA的表达。钛颗粒抑制成骨细胞增殖活性,并呈浓度依赖性。流式细胞术检测结果显示,钛颗粒诱导成骨细胞凋亡。槲皮素预培养能有效缓解钛颗粒对成骨细胞增殖活性的抑制,减少其凋亡。ELISA检测结果显示,槲皮素能减少IL-1β和TNF-α表达。免疫荧光技术显示槲皮素参与调控CHOP蛋白和Bcl-2蛋白的表达,RT-PCR检测结果显示,槲皮素参与调控CHOP和Bcl-2的mRNA的表达。槲皮素能抑制钛颗粒诱导的成骨细胞凋亡,其作用机制可能与内质网应激启动的凋亡途径抑制,调控CHOP、Bcl-2蛋白表达的信号通路有关。
槲皮素;成骨细胞;细胞凋亡;钛颗粒
磨损颗粒碎屑所诱导的骨溶解和骨吸收是造成人工关节置换术后假体松动的主要原因[1]。目前,人工关节置换术后假体松动尚无有效的预防和治疗方法。如能用药物预防和治疗人工关节置换术后假体松动,不仅可延长人工关节假体的使用寿命、避免翻修手术,而且可为患者减轻痛苦和节约费用,具有巨大的社会效益和经济效益。槲皮素及其衍生物是植物世界分布最广的黄酮类化合物,具有抗氧化、抗突变、抗血管形成、抑制组胺分泌等作用[2]。内质网应激(endoplasmic reticulum stress,ERS)启动的凋亡途径是近年来研究的热点。研究发现,槲皮素能抑制ERS凋亡途径[3]。但是目前还没有使用槲皮素对假体松动治疗的研究报道。目前大多数研究在于磨损颗粒激活破骨细胞引起的骨溶解方面。然而作为假体周围的主要细胞成分,成骨细胞也参与了无菌性松动的病理过程[4]。本实验采用磨损钛颗粒诱导成骨细胞凋亡作为模型,研究槲皮素对钛颗粒诱导成骨细胞凋亡抑制作用,并探索其可能的机制,为其应用于假体周围骨溶解及无菌性松动的治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 小鼠成骨细胞MC3T3-E1细胞系购自上海安为生物科技有限公司。
1.1.2 药物与试剂 1640培养基、磷酸盐缓冲液(phosphate buffer saline,PBS)缓冲液、胰蛋白酶均购自艾尔吉生物科技有限公司;3-(4,5-二甲基噻唑- 2)-2,5-二苯基四氮唑溴盐[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,MTT]溶液、Annexin V-FITC/PI细胞凋亡检测试剂盒均购自上海索莱宝生物科技有限公司;CHOP/GADD153多克隆抗体、Bcl-2多克隆抗体、白细胞介素-1β(interleukin-1β,IL-1β)多克隆抗体、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)单克隆抗体均购自美国Proteintech公司;抗兔IgG(H+L)购自美国Cell Signaling Technology公司;Bcl-2、CHOP均购自苏州吉玛基因股份有限公司;钛颗粒购自美国Thermo Scientific公司;槲皮素购自上海索莱宝生物科技有限公司;RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒均购自康为世纪生物科技股份有限公司;PCR引物购自生工生物工程(上海)股份有限公司。
1.1.3 主要仪器 酶标仪(杭州奥盛仪器有限公司),流式细胞仪(美国Beckman Coulter Life Sciences公司),正置荧光显微镜(上海蔡康光学仪器有限公司),电泳仪(北京东方瑞利科技有限公司),7500定量实时PCR扩增仪(美国ABI公司)。
1.2 方法
1.2.1 细胞培养 44.5ml MEM细胞培养基+5ml胎牛血清+0.5ml双抗,混匀。把细胞冻存管从液氮罐中快速取出,放置于一次性手套中,隔绝恒温水浴锅中的水,快速摇晃,在2min之内融化。取出一次性手套中的细胞冻存管,喷75%乙醇消毒后,放置在超净工作台中,用1ml移液器转移冻存管中细胞到装有培养基的15ml离心管,盖上盖子,用封口膜封口。用水平离心机4000r/min(离心半径200mm),离心4min,离心结束后,15ml离心管外壁喷75%乙醇消毒后,放置于超净工作台中,弃去上清液,加入1ml新鲜培养基,吹匀,转移至25T细胞培养瓶。用显微镜观察细胞状态和密度,细胞圆润透亮,密度适中为合适。把25T细胞培养瓶喷75%乙醇消毒后,放置于37℃、5%CO2条件下培养备用。
1.2.2 MTT检测不同浓度的钛颗粒、槲皮素对成骨细胞的作用 MC3T3-E1细胞铺96孔板,每个孔铺200μl含6×103个细胞悬液,细胞密度为3×104个/ml。铺板贴壁24h,使用浓度为0、100、200、400、600、800μmol/L钛颗粒和浓度为0、3、6、12、25、50μmol/L槲皮素分别处理MC3T3-E1细胞24h,按不同分组处理换α-MEN培养基,每孔加入20μl 5mg/ml的MTT,37℃、5%CO₂培养箱避光培养4h,小心吸弃孔内上清夜,每孔加入150μl DMSO,待结晶完全溶解后酶标仪490nm处检测吸光度值。细胞存活率(%)=(各实验组吸光度值–调零孔吸光度值)/(对照组吸光度值–调零孔吸光度值)×100%。
1.2.3 MTT检测槲皮素对磨损颗粒诱导的成骨细胞的保护作用 MC3T3-E1细胞分别铺96孔板,每个孔铺200μl体系6×103个细胞悬液,细胞密度为3×104个/ml。铺板贴壁24h,先使用槲皮素浓度为3、4、5、6μmol/L预处理细胞2h再加入600μmol/L钛颗粒成骨细胞24h,MTT检测细胞活性。
1.2.4 酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)检测槲皮素对钛颗粒诱导的成骨细胞的IL-1β和TNF-α表达 使用5μmol/L的槲皮素预处理MC3T3-E1细胞2h,用600μmol/L的钛颗粒处理24h。ELISA检测各组上清液中IL-1β和TNF-α的表达水平。从室温平衡20min后的铝箔袋中取出所需板条,设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μl,样本孔中加入待测样本50μl,空白孔不加,除空白孔外,标准品孔和样本孔每孔加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的检测抗体100μl,用封板膜封住反应孔,37℃恒温箱孵育60min。弃去液体,吸水纸上拍干,每孔加350μl洗涤液,静置1min,甩去液体,吸水纸上拍干,如此重复5次。每孔加入底物A、B各50μl,37℃避光孵育15min。每孔加入终止液50μl,15min内,在450nm波长处测定各孔吸光度()值。
1.2.5 流式细胞术检测槲皮素对钛颗粒诱导的成骨细胞凋亡 MC3T3-E1细胞铺100mm皿里,每个皿6000μl体系100×104个细胞悬液。铺板贴壁24h,先使用槲皮素5μmol/L预处理细胞2h再加入上面600μmol/L钛颗粒分别处理成骨细胞24h。细胞使用胰蛋白酶消化细胞离心,重悬,取100µl的细胞悬液于5ml流式管中,加入5µl Annexin V/FITC混匀后于室温避光孵育5min,加入5µl的碘化丙锭溶液(propidium iodide,PI),并加400µl PBS,立刻进行流式或荧光显微镜检测。空白管:阴性对照组细胞,不加Annexin V/FITC,PI溶液,用于调节电压。单染管:阳性对照组细胞,只加Annexin V/FITC,用于调节补偿。检测管:处理的细胞,加Annexin V/FITC,PI溶液,用空白管和单染管调节好电压补偿后,获得所需要的流式数据。
1.2.6 免疫荧光技术检测槲皮素对钛颗粒诱导的成骨细胞的CHOP、Bcl-2蛋白的表达 MC3T3-E1细胞铺爬片,MC3T3-E1细胞铺20×104个细胞。铺板贴壁24h,先使用槲皮素5μmoL/L预处理细胞2h再加入上面600μmol/L钛颗粒处理MC3T3-E1细胞24h。24h后,将细胞爬片取出,用PBS洗1~2次,甲醇固定10~15min,用PBS洗3次,每次5min,甩干用免疫荧光笔画圈。放摇床上用羊血清封闭液封闭60min。孵一抗和二抗用(TBST)Tris Buffered saline Tween稀释,将稀释好的一抗加滴加到爬片上,4℃孵育过夜。次日放摇床上PBS洗3次,每次5min,孵二抗90min,放摇床上PBS洗3次,每次5min,避光孵4’,6-二脒基-2-苯基吲哚(4’,6-diamidino- 2-phenylindole,DAPI) 3~5min。
1.2.7 RT-PCR检测槲皮素对钛颗粒诱导的成骨细胞的CHOP和Bcl-2mRNA的表达收集各组细胞,提取总RNA。用反转录试剂盒反转录合成cDNA。根据PCR试剂盒说明书配制PCR扩增体系。将所获得cDNA进行定量定时PCR,扩增条件:扩增条件:95℃预变性2min,95℃ 5s,56℃退火10s,60℃ 20s,共计40个循环。反应结束后通过溶解曲线评价扩增样品的特异性与可靠性。GAPDH作为内参照,采用2–△△Ct法计算目的基因mRNA的表达情况。引物序列见表1。

表1 RT-PCR引物序列
1.3 统计学方法
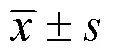
2 结果
2.1 钛颗粒对成骨细胞活性的影响
钛颗粒对成骨细胞的抑制浓度0、100、200、400、600、800μmol/L的钛颗粒处理成骨细胞24h后,细胞存活率分别为96%、87%、76%、64%、49%、36%,与对照组比较,差异均有统计学意义(<0.05)。MC3T3-E1细胞在随着钛颗粒浓度增加时细胞平均存活率逐渐降低,钛颗粒对MC3T3-E1细胞的生长有抑制作用,并且在钛颗粒为600μmol/L时对细胞的抑制率接近50%,见图1。
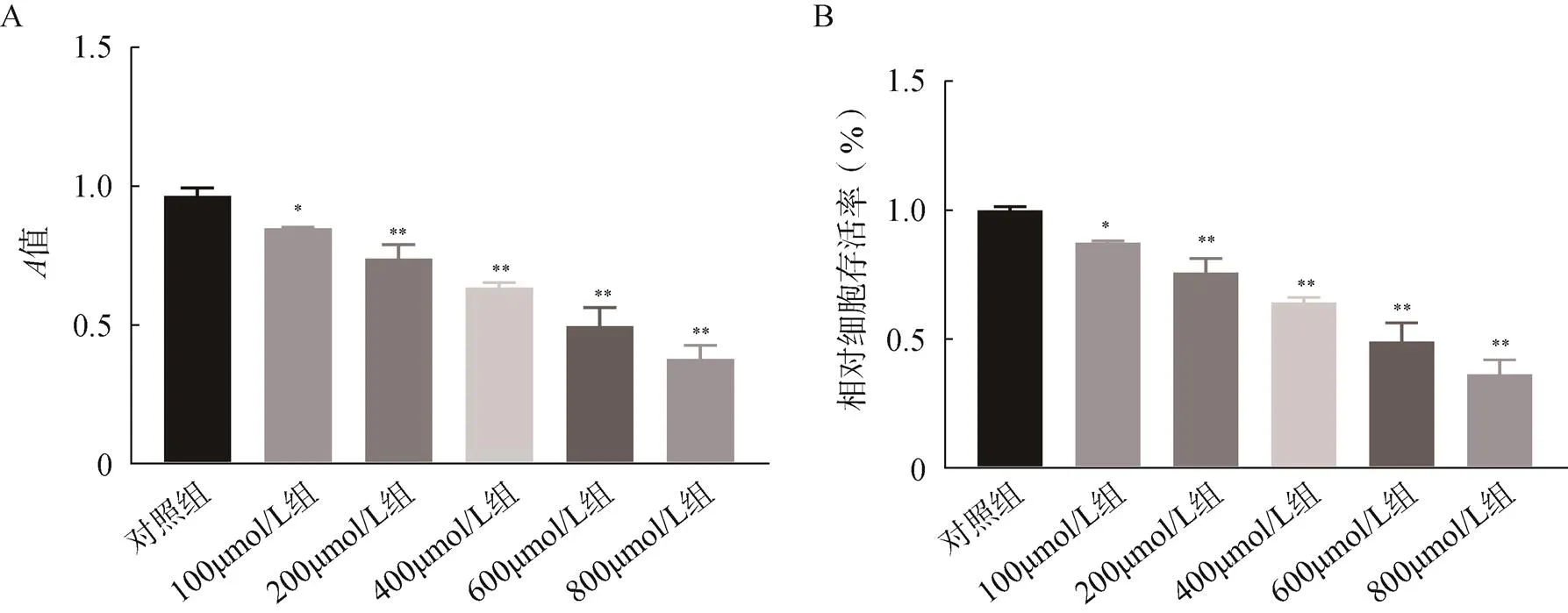
图1 MTT法检测钛颗粒对成骨细胞存活率的影响
A.成骨细胞在不同浓度的钛颗粒作用下值;B.成骨细胞在不同浓度的钛颗粒作用下的存活率;与对照组比较,*<0.05,**<0.001
2.2 槲皮素干预对成骨细胞增殖活性的影响
MC3T3-E1细胞在槲皮素浓度为0、3、6、12、25、50μmol/L时细胞平均活率分别为99%、96%、93%、64%、48%、34%,与对照组比较,差异均有统计学意义(<0.05)。MC3T3-E1细胞在随着槲皮素浓度逐渐升高时,细胞平均存活率呈递减趋势,只有在3~6μmoL/L时对细胞存活率无影响。高浓度的槲皮素对MC3T3-E1细胞的生长起到抑制作用,见图2。
2.3 MTT法检测槲皮素对磨损颗粒诱导的成骨细胞的保护作用
MC3T3-E1细胞在浓度为3~5μmol/L槲皮素预处理2h下再加600μmol/L钛颗粒作用24h的细胞平均存活率随槲皮素浓度的增加而逐渐升高。在5μmol/L槲皮素处理下,MC3T3-E1细胞存活率最高为99%,说明在此浓度下的槲皮素对MC3T3-E1细胞能有一定的保护作用,见图3。
2.4 ELISA检测槲皮素对钛颗粒诱导的成骨细胞的IL-1β和TNF-α表达水平
ELISA检测结果显示,MC3T3-E1细胞对照组、槲皮素组、钛颗粒组、槲皮素+钛颗粒组的IL-1β的表达水平分别为33.75、33.38、40.73、36.57pg/ml,经钛颗粒诱导的MC3T3-E1细胞IL-1β表达水平升高,而加槲皮素预处理后再加钛颗粒诱导的MC3T3-E1细胞的IL-1β的表达水平较钛颗粒组降低,差异均有统计学意义(<0.05)。对照组、槲皮素组、钛颗粒组、槲皮素+钛颗粒组的MC3T3-E1细胞的TNF-α的表达水平分别为156.44、153.65、186.81、168.22pg/ml,经钛颗粒诱导的MC3T3-E1细胞TNF-α表达水平升高,而加槲皮素预处理后再加钛颗粒的组别TNF-α表达水平较钛颗粒组明显下降,差异均有统计学意义(<0.05),见图4。

图2 MTT法检测槲皮素对成骨细胞存活率的影响
A.成骨细胞在不同浓度的槲皮素作用下值;B.成骨细胞在不同浓度的槲皮素作用下的存活率;与对照组比较,*<0.001
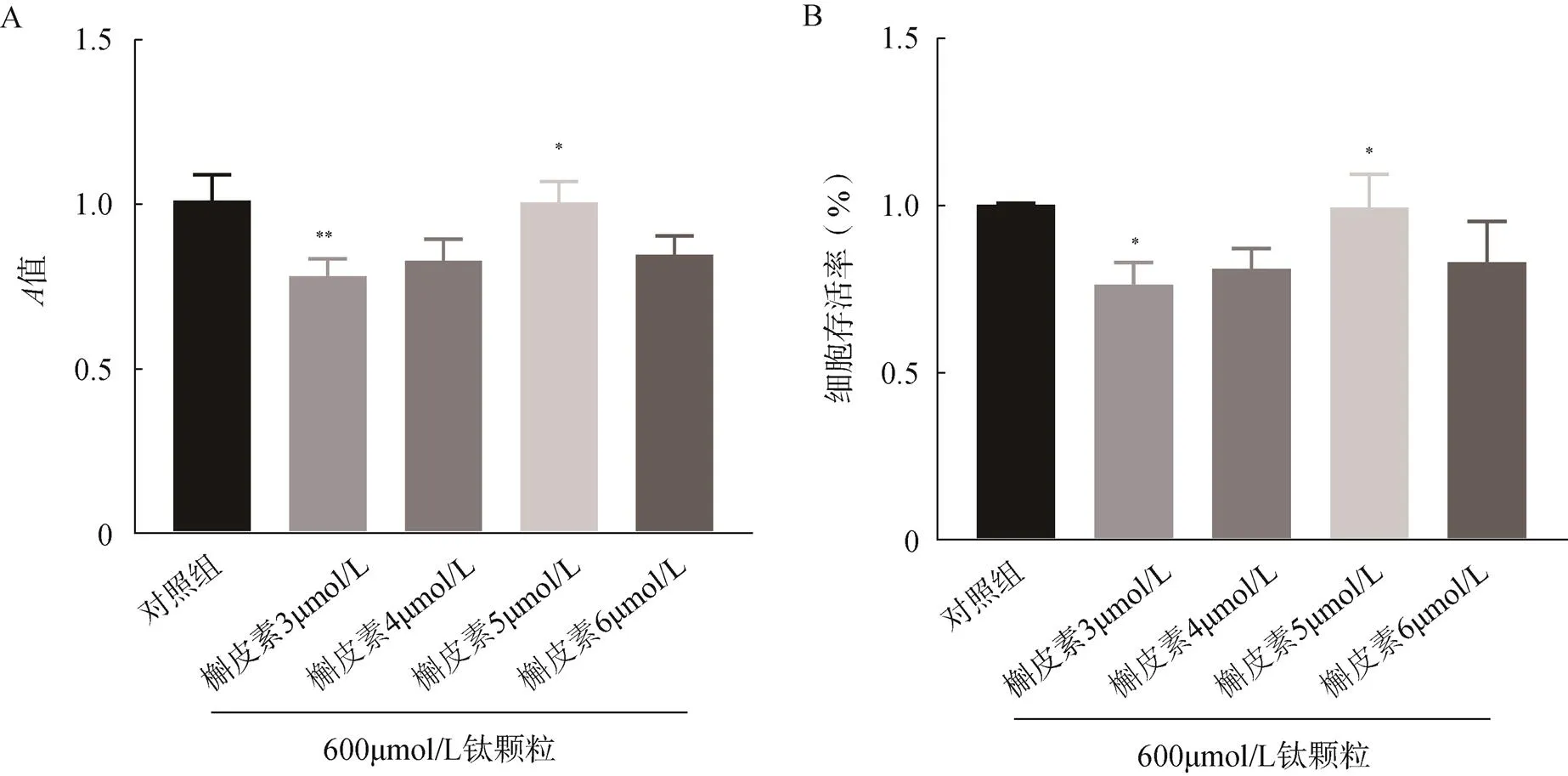
图3 MTT法检测槲皮素与钛颗粒联合对成骨细胞存活率的影响
A.成骨细胞在各组槲皮素与钛颗粒联合作用下值;B.成骨细胞在各组槲皮素与钛颗粒联合作用下的存活率;与对照组比较,*<0.05,**<0.01
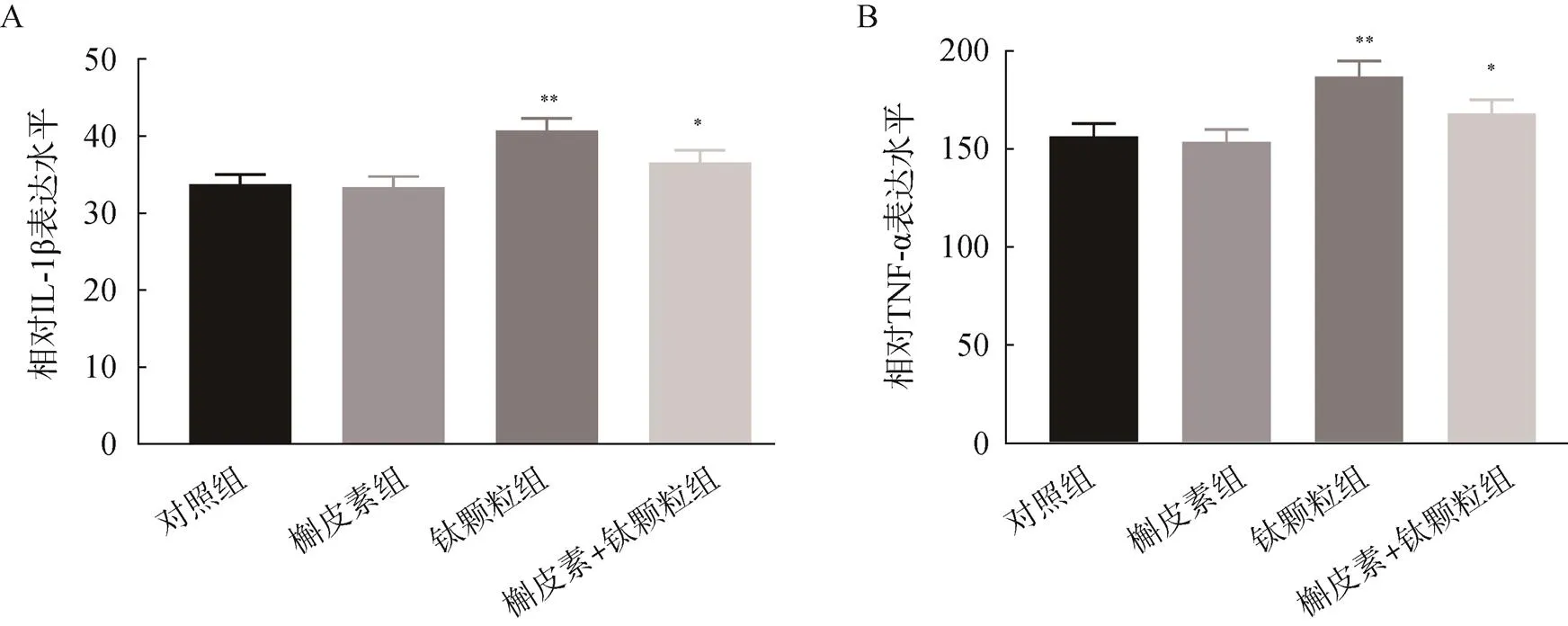
图4 槲皮素对钛颗粒诱导的成骨细胞的IL-1β和TNF-α表达水平的影响
A.诱导的成骨细胞的IL-1β表达水平;B.诱导的成骨细胞的TNF-α表达水平;与对照组比较,*<0.05,**<0.01
2.5 流式细胞术检测槲皮素对钛颗粒诱导的成骨细胞凋亡
先用槲皮素预处理细胞2h,再加钛颗粒作用24h,流式细胞术检测对照组的MC3T3-E1细胞凋亡率为3.30%,槲皮素组的MC3T3-E1细胞凋亡率为3.24%,钛颗粒组的MC3T3-E1细胞凋亡率为43.14%,槲皮素+钛颗粒组的MC3T3-E1细胞凋亡率为20.40%,差异均有统计学意义(<0.05)。钛颗粒促进了MC3T3-E1细胞凋亡,槲皮素+钛颗粒明显降低了MC3T3-E1细胞的凋亡率,说明槲皮素对MC3T3-E1细胞起到一定的保护作用,见图5。
2.6 免疫荧光技术检测槲皮素对钛颗粒诱导的成骨细胞的CHOP、Bcl-2的表达水平
CHOP在对照组和槲皮素组都有荧光表达,荧光主要是在细胞质中表达,且荧光强度弱,呈弱阳性表达。钛颗粒组的CHOP在核质都表达,荧光强度最强,呈强阳性表达。槲皮素+钛颗粒组的CHOP表达位置在核质,但主要是在质中,荧光呈阳性表达。Bcl-2在对照组、槲皮素组和槲皮素+钛颗粒组里荧光都呈弱阳性表达,在对照组表达位置主要是在细胞质中,槲皮素组和槲皮素+钛颗粒组里在细胞核、细胞质都有表达。钛颗粒处理的MC3T3-E1细胞的Bcl-2在细胞核、细胞质都表达,呈强阳性表达,见图6、图7。

图5 流式细胞术检测槲皮素对钛颗粒诱导的成骨细胞凋亡的影响
A.流式细胞图;B.细胞凋亡率;与对照组比较,*<0.001
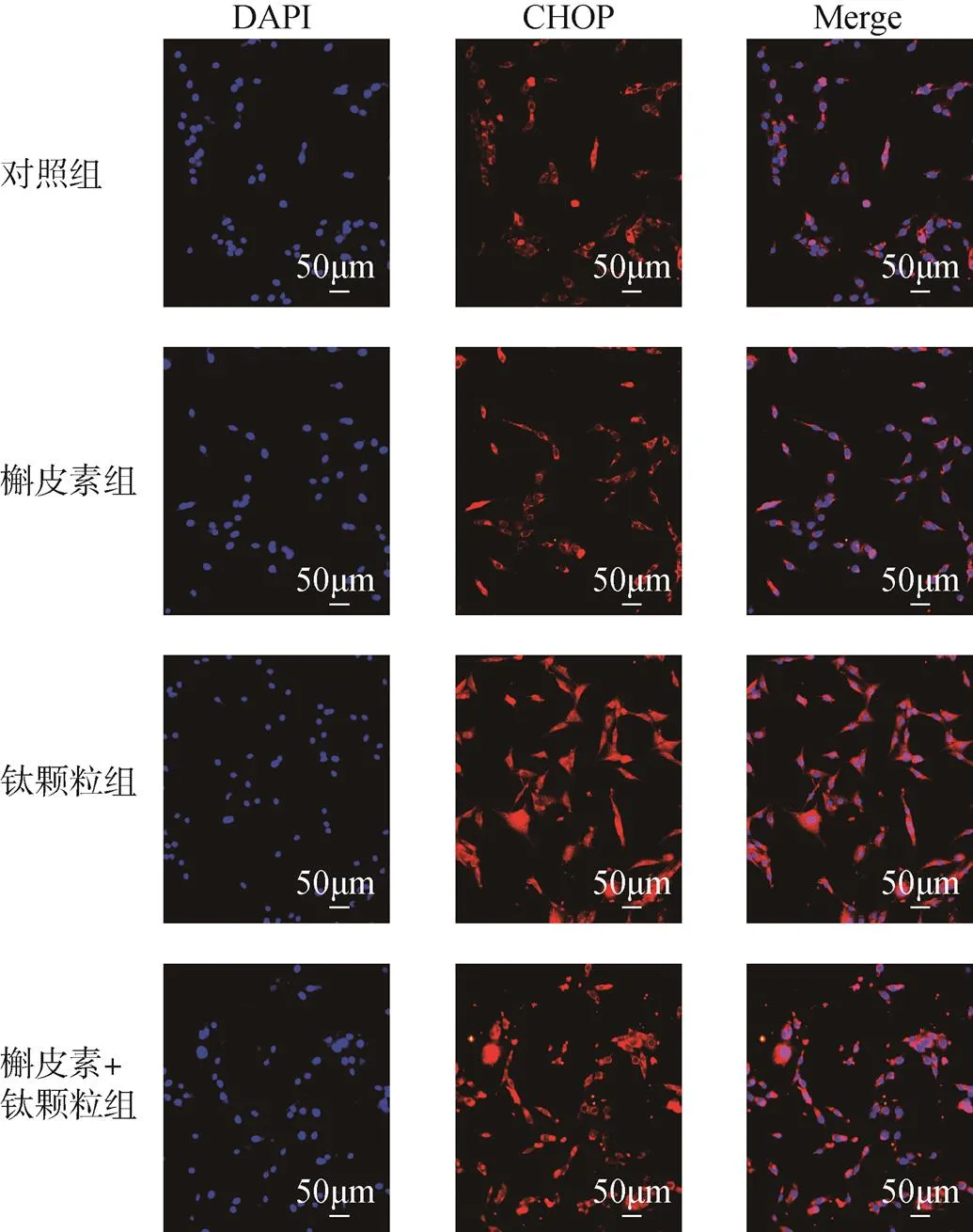
图6 免疫荧光技术检测槲皮素对钛颗粒诱导的成骨细胞的CHOP表达
2.7 PCR检测槲皮素对钛颗粒诱导的成骨细胞的CHOP和Bcl-2的mRNA的表达
在成骨细胞中,相较于对照组,槲皮素诱导下CHOP的mRNA表达差异无统计学意义,但钛颗粒组、槲皮素+磨损颗粒组中CHOP的mRNA表达升高,差异均有统计学意义(<0.05);槲皮素+磨损颗粒组的CHOP相对于钛颗粒组蛋白表达有所降低。在成骨细胞中,相较于对照组,Bcl-2的mRNA在槲皮素、钛颗粒、槲皮素+钛颗粒诱导下升高,差异均有统计学意义(<0.05);槲皮素+磨损颗粒组的Bcl-2的mRNA相对于钛颗粒组蛋白表达有所降低,见图8。

图7 免疫荧光技术检测槲皮素对钛颗粒诱导的成骨细胞的Bcl-2表达
3 讨论
人工关节置换术是一种广泛应用于晚期关节炎的终极治疗方法,可以有效地减轻患者的疼痛症状,恢复关节活动度,并让患者早期回归到正常的生活当中。然而,人工关节置换术的广泛应用使得外科医生又面临一种新的挑战,即如何应对假体周围骨溶解所引起的假体无菌性松动。目前很少有研究将重点放在假体周围骨溶解中成骨细胞增殖活性受抑制和成骨细胞凋亡的环节上,对于上述环节具有保护作用的药物及其机制的报道并不多。因此,理论上能有特效药物解决长期困扰关节外科磨损颗粒导致的人工关节置换术后骨溶解与假体松动的顽疾,必将为人工关节置换患者带来福音。近年来,有在实验中观察到磨损微粒对成骨细胞的抑制作用,本实验研究结果与其相符[5]。钛合金是目前骨科常用的假体材料,虽然其价格相对其他材质较贵,但钛合金具有良好的组织相容性且无明显的不良反应,其缺点是耐磨性差,因此,在假体周围组织中钛颗粒的含量也相对较高,本实验选用纯钛颗粒作为磨损颗粒,主要原因是钛的纯度和颗粒大小都能符合实验要求[6]。槲皮素及其衍生物已被作为天然抗氧化剂用于心血管疾病、骨质疏松性疾病、肿瘤和糖尿病等方面的治疗[7]。国内外对其研究日益增多,槲皮素具有抗过敏、抗炎症、抗氧化、抗病毒等作用[8-9]。研究证实,槲皮素能缓解甲基乙二醛诱导的成骨细胞凋亡,其作用机制可能与调控阻断Wnt通路,影响成骨细胞增殖分化有关[10]。但是目前还没有使用槲皮素对假体磨损松动治疗的研究。本研究发现,钛颗粒引起的成骨细胞增殖活性下降及细胞凋亡率的增高,而槲皮素对钛颗粒诱导成骨细胞凋亡有明显抑制作用。
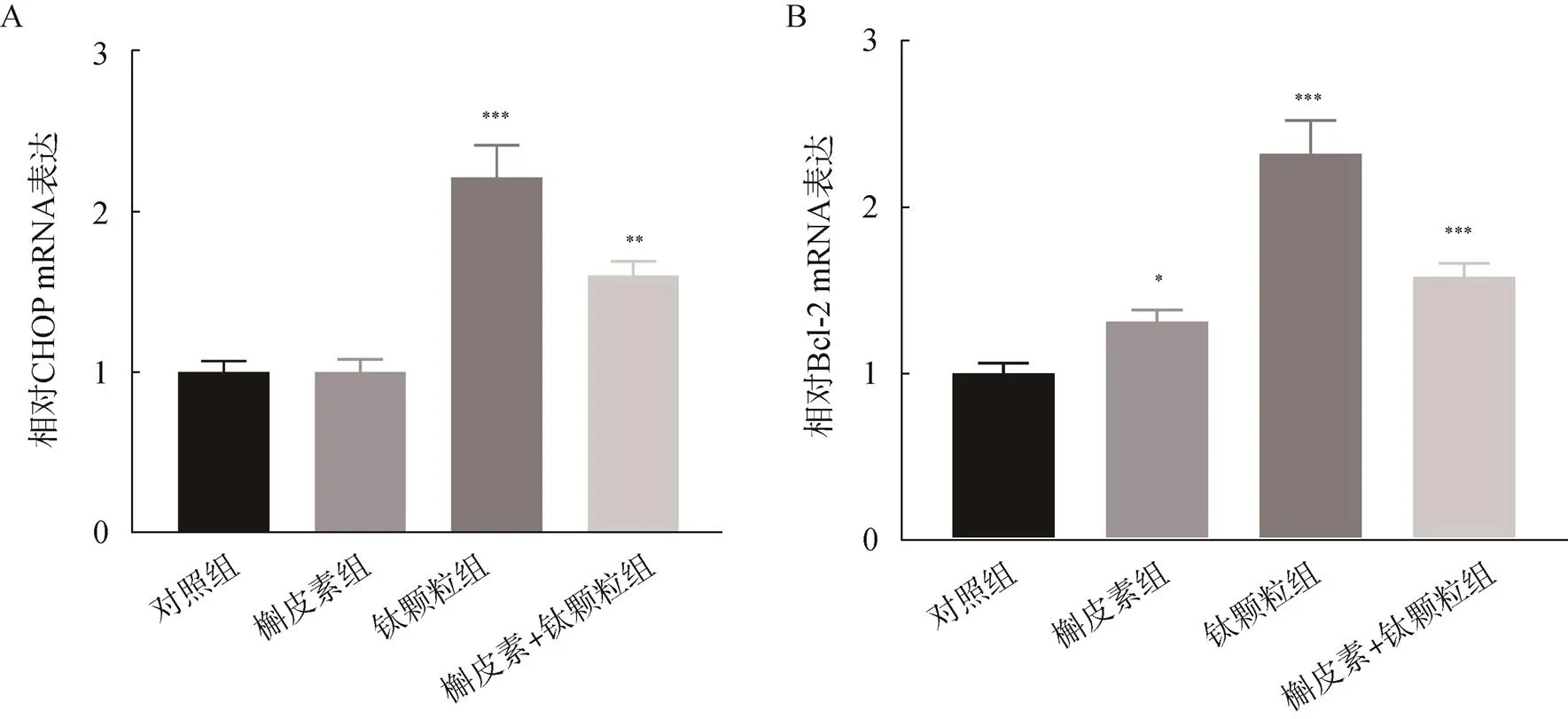
图8 PCR检测槲皮素对钛颗粒诱导的成骨细胞CHOP和Bcl-2的mRNA表达
A.诱导的成骨细胞CHOP的mRNA表达情况;B.诱导的成骨细胞Bcl-2的mRNA表达情况;与对照组比较,*<0.05,**<0.01,***<0.001
磨损颗粒导致的假体周围骨溶解及假体松动的发生是一个复杂的过程。关节活动产生的磨损颗粒会刺激局部组织产生无菌性炎症,在假体周围形成界膜组织,导致成纤维细胞和巨噬细胞等炎症细胞增生、浸润并释放大量的炎症因子,进而产生更多的炎症细胞浸润,同时也活化破骨细胞,引发局部发生骨溶解和骨吸收,最后导致假体松动。因此,TNF-α是磨损颗粒诱导骨溶解的发生过程中的关键因子,其能直接与破骨前提细胞表面的肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)结合,促进破骨细胞的生成和活化;同时TNF-α还能促进其自身以及IL-1β的生成[11]。因此,通过各种方法抑制TNF-α的水平,以及被认为是治疗磨损颗粒诱导假体周围溶解的有效方法之一[12]。通过槲皮素的抗炎症、抗氧化等功能,本实验证实了槲皮素能抑制TNF-α和IL-1β水平,能显著抑制炎症的产生和发展,抑制磨损颗粒导致的骨溶解的作用,具有高效、特异等显著的优势。
研究表明,磨损颗粒诱导的慢性炎症与细胞凋亡存在一定的关系[12]。细胞凋亡又称作细胞程序性死亡,细胞受到凋亡诱导因素的作用后,经信号转导系统的传递而激活凋亡基因。其中Wnt/β-Catenin、调控核因子κB(nuclear factor-κB,NF-κB)等信号通路,Bcl-2家族蛋白表达以及逆转表观遗传学修饰等途径在诱导细胞凋亡中起到关键作用[13-14]。细胞凋亡过程中没有溶酶体和包膜破裂,内涵物不外泄,不引起炎症反应及继发性损害,可有效限制炎症保护机体。但当严重损害时,细胞内外环境发生极度紊乱,细胞凋亡出现严重异常,可引起凋亡过快,凋亡比例过多或清除障碍,进而产生机体组织炎症损害。研究发现,细胞凋亡与磨损颗粒种类有关,在含金属颗粒的介膜组织中细胞凋亡率最高,其次为超高分子聚乙烯颗粒及陶瓷颗粒[15]。因此,本实验选择钛颗粒金属作为磨损颗粒具有代表性,保证了实验的齐同性和有效性。死亡受体活化和线粒体损伤途径是细胞内两条经典的凋亡途径[16]。而ERS启动的细胞凋亡途径是近年才发现的一种新的凋亡途径[17]。内质网是真核细胞中蛋白质合成、折叠与分泌的重要细胞器。当机体细胞受到缺氧、饥饿、钙代谢紊乱、自由基侵袭及药物等应激原的刺激时,内质网腔内未折叠蛋白增多或钙失衡,可引发ERS,细胞对ERS会产生未叠蛋白反应(unfoled protein response,UPR)来降低蛋白质的合成,促进蛋白质的正确折叠,相关的转录因子有RNA依赖的蛋白激酶样内质网激酶(PKR-like ER kinase,PERK)、肌醇激酶1(inositol-requiring kinase1,IRE1)和活化转录因子6(activating transcription factor6,ATF6)[18]。当应激过强时,UPR可激活CHOP引起细胞的凋亡,发生不可逆的损伤。CHOP是ERS诱导多种细胞产生凋亡的关键信号分子,过表达CHOP能够诱发细胞的凋亡[19]。国外也有研究发现,槲皮素能抑制ERS凋亡途径[20]。本研究发现,钛颗粒能够抑制成骨细胞增殖活性,并且呈浓度依赖性。此外,流式细胞术检测结果显示,钛颗粒能够诱导成骨细胞凋亡。本研究免疫荧光技术和PCR检测结果均显示,相对于钛颗粒组,槲皮素+磨损颗粒组的CHOP蛋白表达有所降低,说明ERS启动途径受到抑制。槲皮素在转录和蛋白水平均可抑制钛颗粒诱导的CHOP表达上调,保护成骨细胞免受ERS诱导的凋亡。研究还发现,当外界信号启动ERS途径,发生由ERS所介导的凋亡信号通路时,通过CHOP调控下游的凋亡信号,如Bcl-2家族蛋白等,可以调节肿瘤细胞凋亡[21]。因此,阻断CHOP介导的系膜细胞凋亡,从而逆转ERS诱导的成骨细胞凋亡进展将是治疗的潜在靶点之一。Pang等[22]研究发现,槲皮素通过与内质网相互作用刺激骨形成蛋白信号转导,从而发挥抗ERS的生物学效应。本实验观察到调控细胞凋亡的CHOP及其下游促凋亡信号的活性明显增高,导致系膜细胞凋亡率明显增加,而给予槲皮素干预后系膜细胞ERS得到抑制,CHOP及其下游促凋亡信号明显减弱,细胞凋亡率明显下降。因此,适量浓度槲皮素干预后显著恢复了钛颗粒抑制的成骨细胞增殖活性,本实验证实,浓度5μmol/L槲皮素对成骨细胞有很好的保护作用。因此,适当浓度的槲皮素可促进成骨的活性,可能有利于假体与骨的牢固整合及长期稳定。
综上所述,本研究结果显示,适量浓度槲皮素能抑制钛颗粒诱导的成骨细胞凋亡,其作用机制可能与内质网应激启动的凋亡途径抑制,调控CHOP、Bcl-2蛋白表达的信号通路有关。但本研究为单纯体外实验,需进一步研究证实,从而为临床应用提供理论基础。
[1] YANG G, TANG K, QIAO L. Identification of critical genes and lncrnas in osteolysis after total hip arthroplasty and osteoarthritis by RNA sequencing[J]. Biomed Res Int, 2021, 2021: 2314–2327.
[2] 马子雨, 张宾, 张云涛, 等. 槲皮素缓释系统对MC3T3-E1细胞成骨性能的影响[J]. 中国组织工程研究, 2023, 27(12): 1870–1876.
[3] 脱淑梅, 李瑞瑞, 李娟, 等. 槲皮素通过内质网应激诱导宫颈癌细胞凋亡的机制[J]. 甘肃医药, 2022, 41(9): 769–773.
[4] 林绵辉, 史玉朋, 王磊, 等. 钛颗粒对成骨细胞增殖分化及细胞形态的影响[J]. 中国修复重建外科杂志, 2014, 28(5): 581–585.
[5] 戴闵, 周通华, 熊皞, 等. 金属离子对成骨细胞凋亡、细胞周期分布及ALP分泌的影响[J]. 中国修复重建外科杂志, 2011, 25(1): 56–60.
[6] 陈德胜, 李燕, 郭凤英, 等. 钛颗粒刺激小鼠颅骨诱导骨溶解的动物模型建立[J]. 宁夏医学杂志, 2018, 40(8): 677–680.
[7] HONG Y, LEE J, MOON H, et al. Quercetin induces anticancer activity by upregulating pro-NAG-1/GDF15 in differentiated thyroid cancer cells[J]. Cancers (Basel), 2021, 13(12): 2027–2041.
[8] GUO H, DING H, TANG X, et al. Quercetin induces pro-apoptotic autophagy via SIRT1/AMPK signaling pathway in human lung cancer cell lines A549 and H1299 in vitro[J]. Thorac Cancer, 2021, 12(9): 1415–1422.
[9] FANUNZA E, IAMPIETRO M, DISTINTO S, et al. Quercetin blocks ebola virus infection by counteracting the VP24 interferon-inhibitory function[J]. Antimicrob Agents Chemother, 2020, 64(7): 1098–1112.
[10] 金杯, 戴盼盼, 孙旺, 等. 槲皮素对甲基乙二醛诱导的成骨细胞凋亡保护作用研究[J]. 浙江医学, 2020, 42(18): 1914–1920.
[11] CONNORS JP, STELZER JW, GARVIN PM, et al. The role of the innate immune system in wear debris-induced inflammatory peri-implant osteolysis in total joint arthroplasty[J]. Bioengineering (Basel), 2022, 9(12): 2306–2320.
[12] Yang C, Liu W, Shan H, et al. Naringin inhibits titanium particles-induced up-regulation of TNF-α and IL-6 via the p38 MAPK pathway in fibroblasts from hip periprosthetic membrane[J]. Connect Tissue Res, 2021, 62(5): 485–494.
[13] WEI J, ZHANG X, LI Y, et al. Novel application of bergapten and quercetin with anti-bacterial, osteogenesis- potentiating, and anti-inflammation tri-effects[J]. Acta Biochim Biophys Sin, 2021, 53(6): 683–696.
[14] ZENG Y, NIKITKOVA A, ABDELSALAM H, et al. Activity of quercetin and kaemferol against Streptococcus mutans biofilm[J]. Arch Oral Biol, 2019, 98: 9–16.
[15] 刘子歌, 张晨, 宋国瑞, 等. 磨损颗粒在人工关节置换术后无菌性松动中的作用机制及其影响因素[J]. 中国骨科临床与基础研究杂志, 2020, 12(3): 177–184.
[16] 李帅, 张炳东. 细胞凋亡途径的研究进展[J]. 山东医药, 2017, 57(37): 103–106.
[17] 任慧敏, 韩树池, 薛乾隆, 等. 内质网应激在吸烟COPD模型小鼠膈肌细胞凋亡中的作用及机制研究[J].中国免疫学杂志, 2023, 39: 22–33.
[18] YAO Y, LU Q, HU Z, et al. A non-canonical pathway regulates ER stress signaling and blocks ER stress-induced apoptosis and heart failure[J]. Nat Commun, 2017, 8(1): 133–148.
[19] 刘红, 王增四, 高文, 等. 黄芪甲苷对STZ诱导的糖尿病大鼠肾组织内质网应激及CHOP信号通道的影响[J]. 中国医院药学杂志, 2021, 41(13): 1318–1322.
[20] Eisvand F, Tajbakhsh A, Seidel V, et al. Quercetin and its role in modulating endoplasmic reticulum stress: a review[J]. Phytother Res, 2022, 36(1): 73–84.
[21] 徐成波, 郑瑞玑, 廖斌, 等. 雷公藤内酯醇通过CHOP/BCL-2内质网应激途径诱导人多发性骨髓瘤细胞凋亡[J]. 中国病理生理杂志, 2022, 38(7): 1274–1282.
[22] PANG X, CONG Y, BAO N, et al. Quercetin stimulates bone marrow mesenchymal stem cell differentiation through an estrogen receptor mediated pathway[J]. Biomed Res Int, 2018, 2018: 2314–2325.
Inhibitory effect of quercetin on titanium particles induced apoptosis in osteoblasts
Department of Orthopedics, the First Hospital of Jiaxing in Zhejiang Province, Jiaxing 314000, Zhejiang, China
To explore the inhibitory effect of quercetin on titanium particles induced apoptosis in osteoblasts.Mouse MC3T3-E1 cell line was treated with titanium particles to construct apoptosis model, quercetin was applied to intervene and control group was set up. Cell proliferation activity was detected by 3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide assays (MTT), the apoptosis was analyzed by flow cytometry. The expression levels of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) were detected by enzyme-linked immunoadsordent assay (ELISA). Immunofluorescence technology was used to detect the expression of C/EBP homologous protein (CHOP) and B-cell lymphoma-2 (Bcl-2) protein.The protein expression levels of CHOP and Bcl-2 mRNA expression were detected by real-time polymerase chain reaction(RT-PCR).Titanium particlesl inhibited osteoblast proliferation in a dose dependent manner. Flow cytometric showed that titanium particles induced osteoblast apoptosis. Quercetin pre-culture can effectively relieve the inhibition of titanium particles on the proliferation of osteoblasts and reduce their apoptosis. ELISA results showed that quercetin could reduce the expression of IL-1β and TNF-α. Immunofluorescence technology showed that quercetin is involved in regulating the expression of CHOP and Bcl-2 proteins, and RT-PCR detection results showed that quercetin is involved in regulating the mRNA expression of CHOP and Bcl-2.Quercetin can inhibit the apoptosis of osteoblasts induced by titanium particles, and which may be related to the inhibition of apoptosis pathway initiated by endoplasmic reticulum stress and the signal pathway that regulates the expression of CHOP and Bcl-2 protein.
Quercetin; Osteoblasts; Apoptosis; Titanium particles
R332
A
10.3969/j.issn.1673-9701.2023.29.011
浙江省嘉兴市科技计划项目(2020AD30076)
蒋毅,电子信箱:jiangyi0573@163.com
(2023–03–26)
(2023–09–14)
