金属有机框架材料在声动力疗法中的研究进展
2023-11-01周雪莲吴见乐刘锡建
周雪莲,吴见乐,缪 丹,江 峰,刘锡建
(1. 赣南医学院药学院;2. 江西省医用组织工程材料与生物制造重点实验室,江西 赣州 341000;3. 上海工程技术大学化学化工学院,上海 201620)
声动力疗法(Sonodynamic therapy, SDT)中所使用的超声波对生物组织具有较强的穿透能力,特别是聚焦超声能无创伤地将声能聚焦于深层组织,并激活声敏剂生成活性氧(Reactive oxygen species,ROS),进而产生抗肿瘤作用。由于可以精准控制药物的空间分布以及高安全性[1],声动力疗法有望成为治疗恶性肿瘤的有效方法。然而,现有声敏剂的不足限制了声动力疗法的发展。
金属有机框架(Metal organic framework, MOF)材料是一种新型的多孔配位复合物,它通过有机连接物吸收超声,引起声致发光效应,并利用其产生的能量转移电子,生成活性氧[2]。此外,该材料的多孔结构可有效促进氧气和活性氧在肿瘤细胞中的扩散[3]。因此,MOF 材料在声动力疗法的应用中具有巨大潜力。本文主要综述声动力疗法和MOF 材料在此疗法中的应用。
1 声动力疗法
1.1 声动力疗法的原理声动力疗法是使用超声波来激活声敏剂并产生局部细胞毒性[4],从而诱导肿瘤细胞凋亡的一种高效、安全和简单的新疗法。声动力疗法是在光动力的基础上发展起来的,然而,光动力疗法使用的激光穿透能力有限,无法有效治疗位于组织深部的肿瘤,但超声波能穿透数十厘米的组织,声动力疗法利用高穿透力的超声弥补了光动力疗法穿透力弱的缺陷[5]。声动力疗法的具体治疗步骤是先将声敏剂注入体内,当声敏剂聚集在肿瘤部位时,它可以在超声波的刺激下杀伤肿瘤细胞(图1)。

图1 声动力疗法治疗步骤示意图
1.2 声动力疗法的作用机制声动力疗法的机制尚未定论,但有两种主流观点,即ROS 假说和机械效应。ROS 主要包括单线态氧(1O2)、氧自由基(过氧化氢等)和羟基自由基(·OH)。研究表明,低强度的超声会通过空化效应导致气泡坍塌,进而引起声致发光现象,声敏剂的吸收光,与声致发光的光谱重叠,在这种情况下,声敏剂吸收能量从基态激活至激发态[6]。当受激声敏剂返回基态时,释放的能量可以激活周围环境中的氧分子,使其成为ROS。ROS 具有极强的氧化性,可通过夺取电子降低肿瘤细胞线粒体的膜电位并导致线粒体膜损伤,从而导致Bcl-2 基因家族水平的下调以及胱天蛋白酶激活剂(如细胞色素C)和其他促凋亡分子的释放[7-9],从而诱导肿瘤细胞凋亡。
超声也可通过机械效应或热效应破坏肿瘤细胞[10]。超声是一种机械波,液体在超声的振动下产生大量直径1~10 μm 的气泡,即空化微泡[11]。在超声的作用下,空化微泡可以在液体介质中流动并产生机械力,对细胞膜造成可逆性损伤,从而促进药物和声敏剂向细胞转移,空化微泡爆破形成的流体动力和剪切力也会严重破坏肿瘤细胞的骨架结构[12-13]。同时,对超声的吸收和扩散会导致肿瘤细胞局部高温,造成热损伤(图2)[8,14]。虽然这种机械损伤和热损伤缺乏选择性,但纳米声敏剂的被动靶向性可以提高声动力治疗的效率。一般认为声动力疗法的抗肿瘤能力是多种机制组合共同作用下的结果,而不是单一的生成ROS的机制。
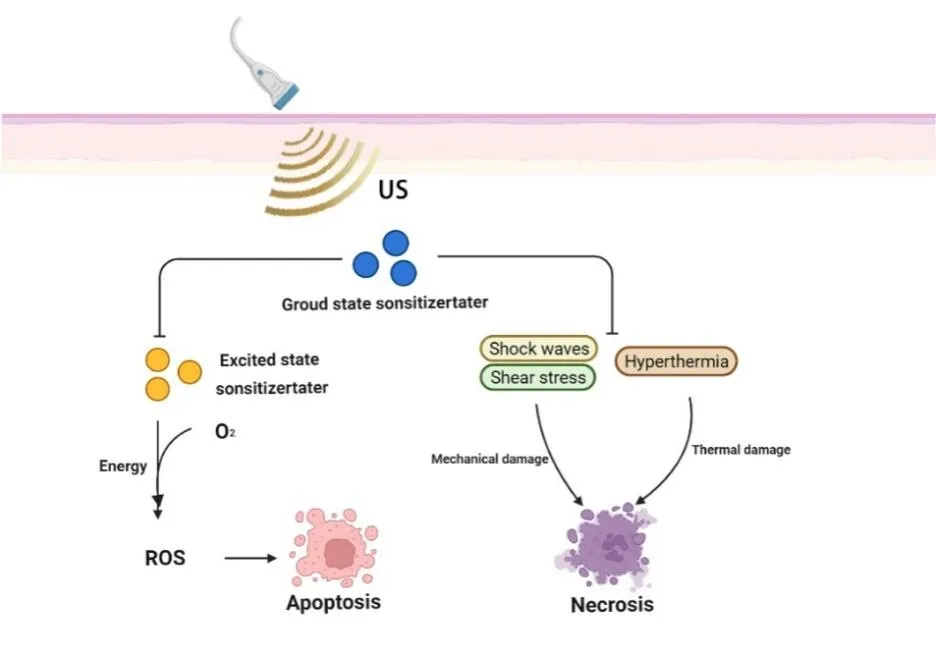
图2 声动力疗法的机制
2 MOF在声动力疗法中的研究进展
SDT 抗肿瘤能力依赖于声敏剂、氧气和超声三个基本元素,其中声敏剂起决定性作用[15-17]。目前SDT 声敏剂主要分为有机类和无机类,有机类声敏剂大多数起源于光敏剂,包括卟啉及其衍生物、吩噻嗪类或阿霉素类化合物;无机类包括二氧化硅纳米颗粒和二氧化钛纳米颗粒等药物[18-19]。大多数有机声敏剂存在水溶性差、生物利用度有限、对肿瘤富集能力低、代谢快、光毒性等缺陷,导致SDT 治疗效果不佳。如光卟啉,它可被肿瘤细胞选择性吸收,对正常细胞几乎没有不良反应,但因水溶性和在血液循环中代谢快,导致它在目标肿瘤部位药物浓度较低影响SDT 效率[19-20]。目前,加强有机声敏剂与纳米材料的结合是有机声敏剂的主要优化方向之一,在一定程度上可以克服上述缺点提高使用价值。PING H 等[21]制备了一种可生物降解的介孔中空结构有机硅纳米材料,将金属锰卟啉(MnPpIX)有机声敏剂锚定在其表面合成为可降解的纳米声敏剂(HMONs-MnPpIX-PEG),该声敏剂通过保留效应实现了MnPpIX 在肿瘤部位的富集,改善了药代动力学,在体内抑瘤实验中明显抑制肿瘤生长。与传统有机声敏剂相比,无机声敏剂有更加优越的理化性质,但也存在降解性差和潜在生物相容性低的不足,需考虑生物安全性问题[22]。正是由于缺乏合适的声敏剂以及肿瘤缺氧环境造成的障碍,SDT 目前仍处于初级阶段,无法实现临床转化。因此开发出高载药量、高活性和可降解的材料作为传输介质或声敏剂,能进一步有利于实现声动力疗法的临床转化。
2.1 MOF 声敏剂及其合成MOF 是以金属离子或金属簇合物为主体,通过有机连接物组装而成的一种新型多孔配位复合物[23]。它具有孔隙率高、密度低、比表面积大、孔道规则、孔径可调以及拓扑结构多样性和可裁剪性等优点[24-27]。与无机纳米粒子相比,MOF 材料具有更高的生物相容性[28];同时,它改进了传统有机声敏剂药代动力学差和光毒性的不足[8]。与其他多孔材料相比,MOF 的理化性质和活性可以通过调整其组分(如金属离子、金属簇和有机连接体)来改善,克服肿瘤细胞微环境带来的限制,提高声敏剂的量子产率,或通过材料的选择与药物的负载赋予一定的功能,实现声动力疗法与其他疗法的联合应用,拓展声动力疗法的临床前景。例如,可以选择生物包容性更好的锆做中心金属离子来改善生物相容性,可以选择卟啉等传统声敏剂材料做有机连接体来提高SDT 的疗效[29]。因此,MOF 材料不仅可作为传统声敏剂的载体,还可直接作为新声敏剂来克服传统声敏剂的各种不足。
在肿瘤微环境(Tumor microenvironment, TME)中,肿瘤细胞处于缺氧状态,并含有高浓度的谷胱甘肽(Glutathione,GSH)。GSH 的抗氧化能力导致ROS 生成不足,从而限制了SDT 发挥抗肿瘤作用的能力[30]。为解决该问题,学者们尝试使用天然过氧化氢酶来弥补SDT 在这方面的不足[31]。然而,生物体内的还原酶和蛋白酶会降低过氧化氢酶的活性,使其很难进入肿瘤细胞[32]。有些金属离子,如Pt4+、Cu+和Mn3+等,可在TME 中与过氧化氢相互作用,通过芬顿反应生成ROS。如果在MOF 的合成中使用这些离子,并与过氧化氢酶样物质协同作用,SDT的功效可以得到提高[28,33]。此外,合适的纳米粒径在肿瘤治疗中也起着非常重要的作用。肿瘤周围有许多新生血管,考虑到由其引起的滞留效应(Enhanced permeability and retention effect, EPR),粒径为100~300 nm 的MOF 纳米粒子可以被动靶向地聚集在肿瘤部位[34-35]。然而,由于TME 中血管畸形以及细胞外基质致密所造成的固有障碍,大的MOF 纳米粒子对肿瘤的渗透性差,只能在肿瘤组织表面堆积,这会导致实体瘤中心的药物浓度不足,治疗效果较差[36]。为了更好地穿透肿瘤,可以选择粒径小于20 nm 的纳米粒子,然而这样的纳米粒子在体内的循环时间短,易于被代谢和清除[37]。因此,理想的思路是合成出可以随肿瘤环境变化而调整粒径的MOF 纳米载体。该载体具有合适的初始尺寸,可以被动靶向并聚集在肿瘤部位,然后在TME 的作用下分解,释放出小尺寸药物和声敏剂,从而增加药物渗透性,提高药物靶向性(图3)[38-40]。
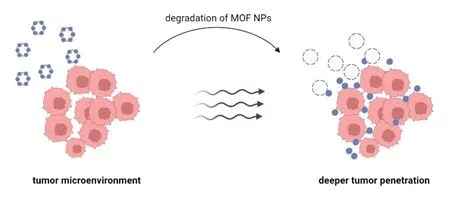
图3 纳米粒子在TME下裂解实现纳米粒径的调控
2.2 MOF 在SDT 中的应用ZHANG K 等[33]以氯化铜和偶氮苯-4,4'-二甲酸为原料,通过溶剂热法合成了Cu-MOFs,然后将声敏剂二氢卟吩6(Chlorin e6,Ce6)负载到Cu-MOFs上,得到平均尺寸为260 nm的Cu-MOFs/Ce6(图4)。通过EPR 效应,大尺寸的Cu-MOFs/Ce6 纳米粒子可有效地蓄积在肿瘤部位,然后在缺氧的TME 环境下偶氮键裂解,降解为小尺寸的Cu-MOFs/Ce6 纳米粒子,进而释放Cu2+和Ce6到肿瘤内部,游离Cu2+与肿瘤细胞内高水平的GSH发生氧化还原反应,耗竭GSH,同时自身被还原为Cu+,Cu+在弱酸性中表现出高催化活性和特异性,通过类芬顿反应将H2O2转换成ROS。锌与2-甲基咪唑组装成ZIF-8 纳米粒子,实验表明,ZIF-8纳米粒子中的不饱和Zn-N3基团簇可激活吸附在表面上的氧气和水分子,从而产生ROS(图5)。体内体外实验结果显示,该纳米粒子在超声作用下表现出更高的ROS 产率及靶向杀伤肿瘤细胞的能力,且在安全剂量下未表现出明显的毒副作用[42]。与传统声敏剂相比,该纳米粒子具有更好的靶向性和安全性,是一个值得被期待的潜在声敏剂。

图4 Cu-MOFs/Ce6纳米体系的合成方法和低氧响应性[33]

图5 结合生物活性和声动力学特性的ZIF-8 NPs[42]
ZHANG K 等[33]对人体乳腺癌细胞MCF-7 和人皮肤成纤维细胞NHDF 给药Cu-MOFs/Ce6 纳米粒子,证实该粒子可以被MCF-7很好地摄取,对MCF-7细胞表现出很好的选择性和杀伤能力,且对NHDF细胞无毒性。在荷瘤小鼠模型中,给药并超声后小鼠的肿瘤生长受到抑制并被逐渐破坏。在治疗过程中,荷瘤小鼠的体重未明显减轻,各项血液生化数据与对照组比未见异常,表明Cu-MOFs/Ce6 无明显的毒副作用。SUN Y 等[41]使用偶氮苯-4,4'-二甲酸合成Cu-MOF 纳米粒子,并负载了非氧依赖性声敏剂2,2-偶氮双[2-(2-咪唑啉-2-基)丙烷]二盐酸盐(AIPH),体内和体外实验表明,该纳米颗粒具有良好的靶向性和抗肿瘤能力。
除了TME 的缺氧环境外,微酸环境也可被纳米粒子利用。WANG W W 等[42]在甲醇溶液中将金属
使用声敏剂作为有机连接物构建MOF,可以有效地避免某些声敏剂在体内的团聚和自猝灭,从而提高SDT 的功效[43-44]。比如卟啉类化合物就容易产生猝灭现象[45]。Mn-TCPP 是一种类过氧化氢酶物质,可以消耗肿瘤细胞中的过氧化氢生成氧气,从而克服低氧环境给SDT 带来的困难。而具有良好生物相容性的锆(Zr)可降低细胞内的GSH 水平。XU Q B 等[29]使用四羧基苯基卟啉锰(Mn-TCPP)作为连接物,并将其与Zr连接以构建Mn-MOF,在细胞实验中对比Mn-TCPP 和Mn-MOF 发现,后者表现出更好的内化能力和更高的细胞内荧光强度。小鼠模型给药后,在超声条件下,Mn-MOF 可更加有效地抑制肿瘤的生长和转移[29]。ZHANG T等[46]将金属钛与中-四(4-羧基苯基)卟吩(TCPP)合成为Ti-TCPP MOF纳米粒子,在体外实验中,通过探针证实Ti-TCPP MOF 在超声的作用下有生成ROS 的能力,细胞给药后,共聚焦显微镜观察到大多数的Ti-TCPP MOF在细胞核中富集(图6);体内实验表明,经Ti-TCPP MOF和超声处理的小鼠组存活时间最长,肿瘤增殖速度最慢,表明以卟吩为骨架的Ti-TCPP MOF 具有良好的肿瘤靶向性和抗肿瘤性能。

图6 Ti-TCPP MOF在SDT靶向治疗中的示意图[46]
2.3 MOF 推动声动力疗法与其他疗法联合治疗联合治疗是抗肿瘤领域的主流趋势,MOF 的高孔隙和大比表面积不仅可以促进ROS 在细胞内的扩散,还可以实现高载药量[29];且超声波通过空化效应可改变肿瘤细胞的通透性,进而增加肿瘤细胞对药物的摄取,减少药物用量,降低化疗药物的耐药性,从而实现SDT 与化疗的联合应用,提高疗效[47-48]。当使用可以产生芬顿效应的金属元素作为合成MOF 的原料时,SDT 又可与化学动力疗法(Chemodynamic therapy,CDT)结合起来[49]。学者们通过诸如此类的对负载药物和纳米材料的选择,合理地设计MOF,从而将SDT 与其它疗法联合起来,为提高抗肿瘤能力提供了可能。
BAO Y H 等[50]为了增强SDT 疗法的效应,选择将SDT与饥饿疗法协同起来。BAO Y H等[50]用八水氧氯化锆(ZrOCl2·8H2O)和TCPP 反应制备PCN224,再负载铂纳米粒子,随后在纳米粒子表面负载红细胞膜以及葡萄糖氧化酶(GOx),形成PPGE NCs。实验结果显示,含有PPGE NCs 的葡萄糖溶液的pH 值明显低于纯葡萄糖溶液,这证明PPGE NCs 中的GOx 依然具备活性,可以氧化葡萄糖。H2O2可被负载的铂纳米粒子还原为氧气分子,进而在超声下与PCN224 反应形成ROS。铂与GOx 的联合作用减缓了缺氧对SDT 的不利影响。溶氧分析法也证实PPGE NCs 能够平稳地显示催化活性。在细胞实验中,该团队使用缺氧探针观察各组细胞的含氧量,发现PPGE NCs 组的荧光强度最低,这证实PPGE NCs 在细胞水平上仍能有效缓解TME 的缺氧。在小鼠模型中,PPGE NCs 组表现出比未负载GOx 组更强的抗肿瘤效果,这证实了GOx 在体内的饥饿抗肿瘤效果与体外细胞实验的结果一致。经超声作用的PPGE NCs 组显示出更高的抑制肿瘤生长的能力,这证实了PPGE NCs 的SDT 效应[50]。上述结果表明,PPGE NCs纳米粒子可以很好地将饥饿疗法与声动力疗法结合起来。
TRUONG HOANG Q 等[51]采用八水氧氯化锆(ZrOCl2·8H2O)和TCPP 制备PCN-222 纳米粒,随后将PCN-222偶联到聚乙二醇上,合成PEG-PCN,并负载促氧化化疗药物荜茇酰胺(piperlongumine,PL)形成PL-PEG-PCN(图7)。细胞实验显示,PL-PEG-PCN给药组的肿瘤细胞存活率在超声和未超声条件下均低于PEG-PCN组和PL组。DCF-DA染色检验细胞内ROS 生成水平的实验表明,在超声或无超声条件下,PL-PEG-PCN 组产生的ROS 明显高于PEG-PCN组。证明由于PL的存在细胞内生成了更多的ROS,且与未经US 处理的PL-PEG-PCN 给药组相比,经过US辐射的PL-PEG-PCN组会更高效地产生ROS。这个结果表明,PL-PEG-PCN 成功将SDT 与PDT 高效地结合起来,提高了抗肿瘤能力。

图7 负载了PL的PEG-PCN的合成方法与作用机制[51]
3 总结与展望
本文综述了声动力疗法的机理、优点以及MOF纳米粒子在声动力疗法中的研究进展。与经典肿瘤治疗方法相比,声动力疗法具有高穿透性、无创性和高靶向性的特点。MOF 纳米颗粒能有效提高声动力治疗的效果,增强其在肿瘤部位的富集,改善肿瘤患者的预后,在一定程度上解决了目前声动力治疗中的瓶颈问题。此外,MOF 纳米粒子能够负载大量的声敏剂或其他药物,容易修饰,可实现与化疗、放疗、光热治疗和饥饿治疗等的联合应用,为肿瘤治疗拓展了一条新途径。然而,MOF 介导的声动力疗法想要实现临床转化,仍需大量的实践支持与证明。开发出具有靶向性和生物相容性,并能在超声下持久高效地发挥抗肿瘤作用的MOF 纳米粒子也是关键。
