西达本胺联合PD-1抑制剂治疗晚期三阴型乳腺癌的疗效及安全性
2023-11-01熊戴群刘少龙叶欣华
熊戴群,刘少龙,叶欣华
(南昌市第三医院肿瘤内科,江西 南昌 330009)
乳腺癌是中国女性最常见恶性肿瘤之一[1],在我国发病率呈不断上升趋势,中位生存期约2~3年[2],经多个周期挽救化疗后进展的乳腺癌患者中位生存期更短。而转移性乳腺癌应采取综合治疗控制肿瘤进展,除放化疗及内分泌治疗外,靶向治疗也占有非常重要地位,如曲妥珠单抗和吡咯替尼等相关靶向药物。
三阴型乳腺癌是指雌激素受体、孕激素受体及人表皮生长因子受体2 均阴性的乳腺癌,其特点是侵袭性强,内脏转移概率较高,相对易发生局部复发及远处转移[3],而三阴型乳腺癌患者经过一线、二线治疗后相当大一部分出现耐药。在精准医学时代,靶向药在肿瘤治疗地位越来越重要,三阴型乳腺癌因缺乏有效的靶向治疗,进展后严重危及生命,对临床医疗工作者具有极大的挑战,同时也带来了其它新型靶向药物治疗的机遇。本文通过小样本临床数据研究新型药物西达本胺联合PD-1 抑制剂作为三线治疗晚期三阴型乳腺癌的疗效及安全性,为晚期三阴型乳腺癌的治疗提供新途径。
1 资料与方法
1.1 一般资料选取我院2019年1月至2020年11月收治的61例晚期三阴型乳腺癌患者为研究对象,患者均为行乳腺癌根治术后出现复发及转移且接受过至少2个解救化疗方案后出现肿瘤进展者。将患者随机分为观察组(n=30):予西达本胺+帕博利珠单抗;对照组(n=31)予帕博利珠单抗+安慰剂。入组标准:(1)病理确诊为三阴型乳腺癌;(2)体力状况评分ECOG≤2 分或(KPS)≥70 分;(3)年龄≥20岁,<70 岁;(4)至少有一个可测量的复发灶或转移灶;(5)既往未使用过西达本胺、PD-1抑制剂、PDL-1抑制剂;(6)肺、肝、肾、心功能基本正常;(7)预期生存期≥3 个月;(8)中性粒细胞≥1.5×109·L-1,血小板≥100×109·L-1,血红蛋白≥90 g·L-1;(9)患者自愿签署知情同意书。排除标准:(1)既往使用过西达本胺、PD-1 抑制剂、PDL-1 抑制剂;(2)病理确诊为非三阴型乳腺癌;(3)不具有测量的复发灶或转移灶;(4)有中枢神经系统转移,且症状未控制;(5)预期生存期<3 个月;(6)合并其它恶性肿瘤;(7)既往治疗的不良反应未消除;(8)筛选期出现心脑血管疾病(心肌梗死、脑梗死、脑出血);(9)左室射血分数LVEF<50%,QTc 间期>450 ms,心包积液≥10 mm;(10)中性粒细胞<1.5×109·L-1,血小板<100×109·L-1,血红蛋白<90 g·L-1;(11)肝功能异常,ALT或AST>正常值上限5 倍,总胆红素>正常值上限3 倍;(12)肾功能异常,血清肌酐>正常值上限1.5倍;(13)甲状腺功能异常;(14)怀孕或者哺乳期女性患者;(15)有活动性感染疾病;(16)有免疫缺陷疾病。两组患者一般资料比较差异无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会批准。
1.2 研究方法
1.2.1 治疗方法观察组:口服西达本胺片(每周2 次,周一、周四或周二、周五或周三、周六服药,每次口服西达本胺片30 mg,5 mg/片,共6 片,早餐后30 min服用,连续服用2个月),第1天同时联合使用帕博利珠单抗200 mg,每21 天为1 疗程,行3 个疗程。对照组:予口服安慰剂(每周2次,周一、周四或周二、周五或周三、周六服药,每次口服安慰剂30 mg,5 mg/片,共6片,早餐后30 min 服用,连续服用2个月),第1 天同时联合使用帕博利珠单抗200 mg,每21天为1疗程,行3个疗程。治疗前后收集数据,评价疗效及安全性。治疗后每个月进行定期门诊随访和电话随访,随访至2022年9月1日,中位随访时间为16.7个月,失访0例。
1.2.2 评价标准按照RECIST 1.1 标准进行疗效评价疗效定义,不良反应按NCI CTC 3.0 版标准评价,分为0~Ⅳ级。
1.3 统计学方法数据采用SPSS 19.0 统计学软件进行分析,计量资料以均数±标准差表示,组间比较采用t检验,计数资料以n(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗疗效比较观察组客观缓解率(ORR=CR+PR)为20.0%高于对照组3.2%,差异无统计学意义(P>0.05),疾病控制率(DCR=CR+PR+SD)为40.0%高于对照组16.1%,差异有统计学意义(P<0.05)(表2)。
2.2 两组患者生存情况比较观察组患者的中位无进展生存期(Progression-Free Survival,PFS)4.21个月(95%CI:0.19~18.10 个月)长于对照组0.75 个月(95%CI:0.13~14.12 个月)(χ2=3.99,P<0.05);观察组1 年生存率为57%高于对照组(33%)(χ2=3.85,P<0.05)。
2.3 两组患者治疗相关不良反应比较观察组白细胞下降、血红蛋白、血小板下降、胃肠道反应的发生率高于对照组(P<0.05),但主要以1~2级不良反应为主,3~4 级经积极对症治疗后均恢复正常,不良反应可耐受(表3)。
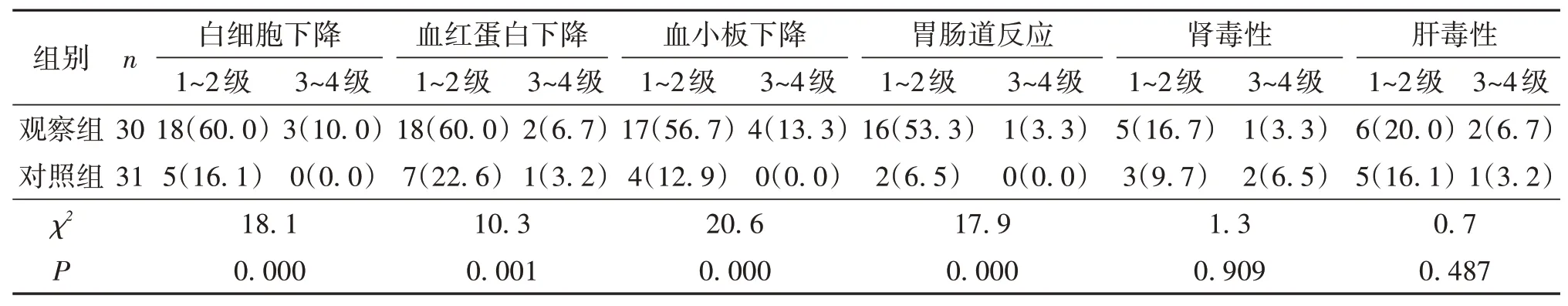
表3 两组患者不良反应比较/n(%)
3 讨论
西达本胺为苯酰胺类组蛋白去乙酰化酶抑制剂(Histone Deacetylase, HDACi),通过抑制组蛋白去乙酰化酶(Histone deacetylases, HDACs)调节影响蛋白分布的转录后修饰,如增加CD22 在细胞表面的表达[4]诱导肿瘤细胞凋亡,导致G0/G1 细胞周期阻滞,抑制细胞生长[5]。西达本胺还可以诱发DNA损伤、抗血管生成以及活性氧生成[6]。
西达本胺于2014 年获国家食品药品监督管理总局(China Food and Drug Administration,CFDA)批准上市,首个适应证为复发及难治性外周T 细胞淋巴瘤(Peripheral T-cell lymphoma,PTCL)。GUI L等[7]研究证实西达本胺联合化疗治疗外周T 细胞淋巴瘤疗效确切。大量研究表明西达本胺在其它实体瘤治疗上获益。单独使用或联合表皮生长因子受体酪氨酸激酶抑制剂伊可替尼对非小细胞肺癌有抗肿瘤活性[8]。联合硼替佐米可显著降低胃癌MGC-803 和BGC-823 细胞增殖、侵袭和迁移能力[9]。2019 年西达本胺获国家市场监督管理总局批准新的适应证为激素受体阳性、人表皮生长因子受体-2阴性的复发或转移性乳腺癌。但西达本胺对三阴型乳腺癌是否有效呢?组蛋白去乙酰化酶抑制剂联合mTORC1 和ESR1α 共同抑制可延缓三阴性乳腺癌的生长,并抑制肿瘤干细胞过度表达[10]。通过noxa 介导的MCL1 降解,增强MEK 抑制剂在三阴性和炎性乳腺癌中的疗效[11]。减少HDAC9的过表达,通过调控microRNA-206 表达降低三阴性乳腺癌的侵袭性和血管生成[12]。
乳腺癌发生、发展是一个复杂多变的漫长过程,因人体中的药代动力学、内环境、免疫系统及遗传特性不同,单药极易产生耐药导致肿瘤进展,而多种药物联合治疗可通过不同的抗肿瘤机制发挥叠加效应。西达本胺联合PD-1 免疫治疗在许多癌症取得不错的效果,如西达本胺联合帕博利珠单抗疗法是治疗软组织肉瘤的一个潜在的重要策略[13]。PD-1(+)细胞可能在先天性和适应性免疫反应中存在缺陷,而西达本胺可以逆转这种缺陷[14],显著提高了循环PD-1(+)细胞的趋化因子活性和趋化功能相关基因的表达,通过招募免疫细胞和改善PD-1(+)细胞的固有免疫功能,重塑肿瘤微环境,使其成为一种抗肿瘤表型,并与检查点抑制剂协同作用[15]。此外HDAC 抑制剂AR42 衰减了两个相互独有的胶质瘤干细胞亚型之间的交配,并通过PD-1检查站封锁增强免疫治疗[16]。HDAC 抑制剂联合奈拉替尼促进抗肿瘤免疫反应[17]。本研究发现观察组客观缓解率、疾病控制率高于对照组,观察组中位PFS长于对照组、1年生存率高于对照组。虽然观察组白细胞下降、血红蛋白下降、血小板下降、胃肠道反应发生率高于对照组,但主要以1~2 级不良反应为主,3~4 级经积极对症治疗后均恢复正常,不良反应可耐受。
综上所述,临床上应用西达本胺联合PD-1抑制剂作为三线治疗晚期三阴型乳腺癌,可能使患者受益。本研究为单中心研究、样本量少,未做后续的生存期及治疗后生活质量评估等,后续需要多中心大样本临床试验去验证。此外,西达本胺是否可以联合PARP 抑制剂治疗晚期三阴型乳腺癌,还需临床工作者进一步去探究证实。
