RBM20基因在扩张型心肌病中表达的研究进展
2023-11-01林欣综述周岩审校
林欣 综述 周岩 审校
(吉林大学第一医院小儿心血管科,吉林长春 130000)
扩张型心肌病(dilated cardiomyopathy, DCM)是全球心力衰竭重要的原因之一,表现为心脏结构出现一侧或双侧心室扩大及收缩功能减退,可同时合并心律失常,在疾病的任何阶段均可出现严重心血管事件,导致猝死,最终的治疗手段多为心脏移植。部分DCM 原因不明,在特发性DCM中,20%~35%为家族遗传,多为常染色体显性遗传。自1990 年发现第1 例家族性心肌病致病性基因突变,目前已超过170个基因与心肌病、离子通道病等多种心脏系统疾病相关,超过60 个基因可引起DCM[1-2]。2009 年,首次发现RNA 结合基序蛋白20(RNA binding motif protein 20,RBM20)基因突变可引起DCM[3]。RBM20基因突变所致的心肌病多为家族性DCM,临床表现相似[4],发病率为1%~5%[5]。少数RBM20基因突变所致的心肌病为散发性DCM[6]。RBM20基因又可作为剪接因子,在转录过程中可变剪接TTN基因、TNNT2基因,在心脏发育中起重要作用。RBM20基因突变导致的DCM 具有发病年龄小、心力衰竭严重、高病死率的特点[7-9]。目前,RBM20基因已被证实与多种心血管疾病相关,可表现为DCM、心律失常、猝死及心肌广泛纤维化、心肌致密化不全。
1 RBM20基因的结构
RBM20基因主要在横纹肌中表达,心肌中表达最高,非肌肉组织中几乎不表达[10-11]。RBM20基因位于10号染色体,包含14个外显子,编码含1 227 个氨基酸的蛋白质。存在物种间高度保守的功能区域,包括2 个锌指(zinc finger, ZnF)结构域,1 个RNA 识别基序(RNA recognition motif,RRM)结构域,1个富含精氨酸/丝氨酸(arginine-/serine-rich, RS)区域,1 个富含亮氨酸(leucinerich, L-rich)区域,1 个富含谷氨酸(glutamaterich, E-rich)区域[12-13](图1)。其中,与DCM 相关的RBM20基因突变多发生在RS 区域[2,10,14-15],导致表达的蛋白质功能丧失。E-rich 区域和ZnF 结构域内突变发生率比RS 区域低,但是在这些区域内发生突变后也会降低RBM20基因的剪接活性,影响所调控的基因表达,导致DCM[16-17]。不是所有突变均有意义,如I536T-RBM20基因突变影响基因表达、导致剪接异常,但是不会引起DCM[18]。
2 RBM20基因突变的表达
Zhang 等[19]表明RS 区域发生的突变介导中心核定位信号的中断,可引起严重的DCM。大多数RBM20基因突变定位在RS 区域中的精氨酸-丝氨酸-精氨酸-丝氨酸-脯氨酸(arginine-serinearginine-serine-proline, RSRSP)片段,RSRSP 片段的磷酸化干扰了RBM20基因的核定位,在细胞质中形成异常的核糖核蛋白(ribonucleoprotein, RNP)颗粒,考虑这种RNP 颗粒是形成DCM 心肌改变的重要原因[12,14,20-21]。另有研究表明,RSRSP 片段突变使DCM 表型更加严重,并发心房颤动及室性心律失常[22]。但是,低水平的磷酸化仍可提高蛋白质表达水平,可能是受反馈机制的作用[23]。RBM20基因是心脏发育过程中核糖核酸处理机制的重要组成成分。RBM20基因突变干扰前体信使核糖核酸(pre-messenger RNA, pre-mRNA)的翻译后修饰过程,生成大量异常蛋白质(图2)。转录过程中,RBM20基因通过RRM 结构域抑制上游和下游内含子[17],Upadhyay 等[24]发现RRM 结构域具有C 端螺旋,特异识别含尿嘧啶-胞嘧啶-尿嘧啶-尿嘧啶的RNA 基序,成为转录pre-mRNA 的基础。
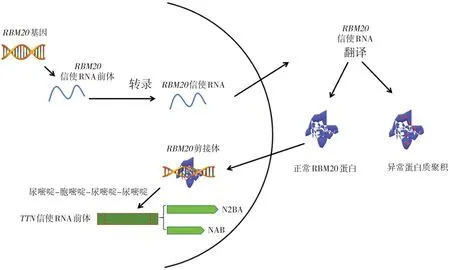
图2 RBM20基因转录翻译及可变剪接TTN基因示意图 图片改自Koelemen等[13]的文章。RBM20基因突变影响转录及翻译过程,导致异常蛋白质聚积。同时,RBM20基因突变通过调整N2BA及NAB亚型比例,可变剪接TTN基因。
3 RBM20基因的可变剪接
RBM20基因突变导致可变剪接异常,导致靶基因形成致病性的环状RNA,并且在细胞质加工小体内重新生成RNP,导致心肌细胞变异,心脏收缩功能异常[25]。RBM20基因的结构域在定位剪接位点及外显子/内含子的选择中至关重要。通过研究实验大鼠与人类心脏的基因,在内含子结合位点发现一组独特的RNA 识别元件,在3′剪接位点下游400 碱基对和5′剪接位点上游400 碱基对位点与RBM20基因结合,并且,RBM20基因也通过与U1 和U2 核小核糖核蛋白颗粒(small nuclear ribonucle protein particle, snRNP)结合位点结合,抑制剪接过程[10,26]。
RBM20基因作为一种剪接因子,调节与影响心室舒张功能、肌节组装、离子转运等多个心脏相关基因的剪接[11],包括TTN基因、CAMK2基因、MYH6基因、MYH7基因、RYR2基因、NEXN基因、NPRL2基因、TNNT2基因、PDLIM3基因等[5,11,27]。本文介绍RBM20基因调控TTN基因及CAMK2基因的过程。
3.1 TTN基因
TTN基因突变是引起DCM 常见的原因[28],占10%~30%。TTN基因在人类中包含363 个外显子,3个亚型,编码的肌联蛋白是人类体积最大的蛋白质,大小超过3 MDa,连接大多数横纹肌中的Z盘和粗丝,调节心肌收缩和弹性,是导致心肌硬化的重要因素[20]。TTN基因主要的2 种亚型是N2BA和NAB,心肌顺应性由N2BA和NAB所占比例不同决定。RBM20基因突变显著提高N2BA 亚型表达,造成N2BA和NAB比例改变,使肌原纤维被动张力降低,导致心肌病[12,26-27,29](图2)。
3.2 CAMK2基因
CAMK2基因的产物属于丝氨酸/苏氨酸激酶家族的一种多功能蛋白激酶,蛋白激酶中的δ亚型在心脏中占主导地位。RBM20基因突变导致CAMK2基因的产物从常规的-δB和-δC亚型转变为-δA和-δ 9亚型,导致L 型钙离子电流增加,心肌细胞肌浆网中充满钙离子,细胞内钙离子超负荷,可能是DCM心律失常发生的原因[27,30]。
4 性别差异
DCM 发病率及临床严重程度存在性别差异,男性发病率高于女性,症状更加严重。一项Meta分析表明,相比于女性,男性DCM的全因病死率、心血管病死率及猝死风险更高[31]。RBM20基因突变所致的DCM 中,男性患者的临床症状也比女性更严重[6,32]。但是,Lennermann 等[33]研究构建的RBM20基因敲除(knockout, KO)小鼠模型,虽然RBM20-KO 所致DCM 雄性小鼠的基因表达和磷酸化更加显著,但是心脏形态和功能与DCM 雌性小鼠相比无性别差异。这种人类及小鼠的发病性别差异的不同可能受行为风险因素如吸烟、肥胖及激素等的影响。
5 治疗
DCM 在临床中大多数仍表现为收缩性心力衰竭。很多患者最后的治疗措施为心脏移植,但供体稀少。目前,已开展多项治疗RBM20基因突变所致心肌病的研究,期望可以治愈心力衰竭。
研究表明,强心苷类药物包括地高辛及洋地黄毒苷可以抑制RBM20基因对TTN基因的可变剪接,降低RBM20基因表达蛋白质的水平,可能改善舒张性心力衰竭[34]。丝氨酸-精氨酸蛋白激酶可以调节RSRSP 片段的磷酸化,调控心肌病相关基因的剪接,成为治疗RBM20基因相关心肌病的潜在治疗靶点[21]。应用CRISPR/Cas9 基因编辑技术建立体外心肌模型,此模型包含RBM20基因杂合突变的多能干细胞定向分化心肌细胞,通过全反式维甲酸上调RBM20基因表达,部分恢复由RBM20基因缺陷引起的剪接、钙处理异常和收缩功能障碍,有望修复RBM20基因突变所致的DCM[35]。
基因突变的精准校正是一种新的治疗方法。一项研究指出,应用腺嘌呤碱基编辑和先导编辑校正RS 区域内的突变,诱导多能干细胞衍生出心肌细胞,使心力衰竭的大鼠恢复心脏功能[14]。目前,关于基因编辑改善致病性RBM20基因变异体修复的方法研究仍在初级阶段。
6 总结与展望
RBM20基因突变通过多种途径导致DCM,其转录、翻译及调控其他基因可变剪接的过程复杂。目前,对于RBM20基因突变所致DCM的治疗方案多基于基础研究,由于RBM20基因具有物种间高度保守的特征,非同源物种、体内及体外的RBM20基因研究结果有部分不同,对人类DCM 的疗效仍需要更多临床研究与基础研究结合进一步明确。
利益冲突声明:所有作者声明无利益冲突。
