幼儿园儿童年龄与肺炎链球菌疫苗覆盖率间的剂量-反应关系
2023-11-01李亭邓文君张景锋李平原周俊立姚振江叶小华
李亭 邓文君 张景锋 李平原 周俊立 姚振江 叶小华
(广东药科大学公共卫生学院流行病与卫生统计学系,广东广州 510310)
肺炎链球菌疾病是儿童发病和死亡的最主要原因,特别是侵袭性肺炎链球菌疾病(invasive pneumococcal disease, IPD)给全球儿童造成了严重的疾病负担。肺炎链球菌疾病在5岁以下儿童、65岁以上老年人及具有免疫缺陷病、基础合并症人群中发病率很高[1]。肺炎链球菌主要通过呼吸道飞沫定植于鼻咽部并侵入机体正常无菌部位(如血液、脑脊液等),从而导致IPD 并引起全身性的严重感染(例如菌血症和脑膜炎)[2]。疫苗接种是预防和控制肺炎链球菌感染的最经济、最有效策略。肺炎球菌结合疫苗(pneumococcal conjugate vaccine, PCV)的引入已使全世界IPD 发病率显著降低[3-4],但疫苗的广泛使用改变了肺炎链球菌血清型的自然流行规律,致使疫苗覆盖血清型流行率呈下降趋势,而非疫苗覆盖血清型流行率呈上升趋势,这已成为全球日益关注的公共卫生问题[5]。世界卫生组织推荐5 岁及以下儿童接种10价肺炎链球菌结合疫苗(10-valent pneumococcal conjugate vaccine, PCV10)与13 价肺炎链球菌结合疫苗(13-valent pneumococcal conjugate vaccine,PCV13)[6];《肺炎球菌性疾病免疫预防专家共识》(2020版)[2]指出,PCV13在较大年龄儿童中(2~6岁)具有较好的免疫原性,因此幼儿园儿童是PCV 接种的主要人群,需要持续监测肺炎链球菌的血清型流行状况,以更好地评估结合疫苗的有效性。由于结合疫苗仅局限于特定血清型且生产成本较高,因此新型的、高度保守的蛋白疫苗成为了新一代肺炎疫苗的研究热点。迄今为止,候选蛋白疫苗中具有较大潜力的毒力蛋白主要是自溶素(autolysin A, lytA)、肺炎链球菌溶血素(pneumolysin, ply) 和肺炎链球菌表面蛋白A(pneumococcal surface protein A, pspA),以及基于菌毛基因rlrA与sipA的蛋白。多项研究表明,上述蛋白质具有多种生物学活性,在肺炎链球菌疾病的发病机制中起重要作用[3,7-9],这可为研发新型肺炎链球菌蛋白疫苗提供新思路。本研究对广东省佛山市顺德区幼儿园儿童进行流行病学研究,旨在掌握该地区幼儿园儿童携带肺炎链球菌的血清型流行状况,并探究儿童年龄与肺炎链球菌血清型、基因型覆盖率间潜在剂量-反应关系,为指导儿童疫苗接种与研发新型蛋白疫苗提供依据。
1 资料与方法
1.1 研究对象
选取2020 年10—12 月佛山市顺德区幼儿园的健康儿童为研究对象,采用分层整群随机抽样的方法:第一阶段,按经济发展水平和地理分布位置将顺德区分为2 层(城镇、农村);第二阶段,每层按比例采用直接抽选法抽取部分幼儿园,共抽取6所幼儿园,其中城镇和农村各3所,抽中幼儿园中所有符合纳入标准的儿童均参与本次调查。纳入标准:年龄≤7 岁的健康幼儿园儿童,且监护人签署知情同意书。排除标准:调查前7 d内患有支气管炎、肺炎等急性感染性疾病;患有血友病等易出血疾病。共调查1 830名儿童。本研究获得广东药科大学伦理委员会批准(批件号:伦理审[2019]第19 号),所有儿童监护人在调查前均已签署知情同意书,并于采样前完成问卷调查。
1.2 菌株采集与分离鉴定
由经过统一培训的调查员对儿童进行鼻咽拭子采样,首先用生理盐水湿润无菌拭子,然后通过鼻腔慢慢插入鼻咽,遇到阻力后轻轻旋转3~5圈,取出拭子并放置无菌试管中。肺炎链球菌的分离鉴定:将鼻咽拭子样品接种于哥伦比亚血平板,置于35℃、5% CO2培养箱培养18~20 h,对可疑菌落依次进行溶血试验、Optochin敏感试验与胆汁溶菌试验,以上试验均阳性则可判定为肺炎链球菌阳性。
1.3 肺炎链球菌的全基因组测序
将所有肺炎链球菌均进行全基因组测序分析。将经复苏和扩增培养的肺炎链球菌制成菌液,按照Magen 细菌基因组DNA 提取试剂盒的操作说明书提取肺炎链球菌DNA,并通过NanoDrop 微量紫外分光光度检测计检测所提取DNA的浓度和纯度。将质量合格的肺炎链球菌基因组DNA 行进一步质量检测和全基因组测序,并进行序列质控、序列拼接及序列物种鉴定。
1.4 血清型分型与基因检测
将拼接好的肺炎链球菌菌株序列上传到PathogenWatch 全球基因组监测平台(https://pathogen.watch/),该网站使用SeroBA 软件对菌株序列进行血清型预测。SeroBA 软件是一种能可靠地识别出肺炎链球菌血清型的生物信息学工具,其通过识别cps位点,基于k-mers方法直接从全基因组测序数据中进行肺炎链球菌血清型预测。若菌株缺乏荚膜操纵子,则该菌株被归类为不可分型。使用ABRicate软件对菌株序列菌毛基因(rlrA和sipA) 与毒力基因(lytA、ply、pspA) 进行检测。
1.5 相关定义
(1)PCV10:包含血清型1、4、5、6B、7F、9V、14、18C、19F和23F。(2)PCV13:在PCV10的基础上增加血清型3、6A、19A。(3)菌毛基因岛1(pilus islet 1, PI-1):由rlrA基因决定的致病岛。(4)菌毛基因岛2(pilus islet 2, PI-2):由sipA基因决定的致病岛。
1.6 统计学分析
使用EpiData 3.1软件建立数据库,调查问卷结果采用双人录入并进行一致性检验。使用STATA 17.0 软件和R 4.2.1 软件对数据进行统计学分析。计量资料采用均数±标准差(±s)表示;计数资料采用例数和百分率(%)表示;采用基于限制性立方样条(restricted cubic spline, RCS)的logistic回归模型分析年龄与肺炎链球菌疫苗血清型/基因型覆盖率间的剂量-反应关系。检验水准α=0.05。
2 结果
2.1 人口学特征和肺炎链球菌携带率
本研究共调查了1 830 名健康儿童,年龄最大为7 岁,最小为1 岁,平均年龄为(4.5±1.0)岁;其中男童1 001 名(54.70%), 女童829 名(45.30%)。1 830 名幼儿园儿童中,鼻咽部肺炎链球菌携带率为22.46%(411/1 830)。
2.2 肺炎链球菌血清型分布和疫苗血清型/基因型覆盖率
411 株肺炎链球菌菌株中,共检出22 种血清型,11株未能确定血清型。最常见血清型为6B型(133株,32.4%),其次为19F型(55株,13.4%)、15A 型(46 株,11.2%)、23A 型(31 株,7.5%)、34 型(24 株,5.8%)、23F 型(18 株,4.4%);主要流行的疫苗血清型是6B、19F、23F 型,主要流行的非疫苗血清型为15A、23A、34 型。PCV10 和PCV13 血清型覆盖率分别为53.0% (218/411)、57.9%(238/411)。PI-1、PI-2、lytA、ply、pspA基因型覆盖率分别为37.7%(155/411)、16.1%(66/411)、99.5%(409/411)、99.0%(407/411)、5.4%(22/411)。
2.3 儿童年龄与疫苗血清型/基因型覆盖率的关系
儿童年龄与PCV10 血清型覆盖率间呈“S”形的剂量-反应关系(P=0.021),其中2 岁组儿童PCV10 血清型覆盖率最高(88.0%);儿童年龄与PCV13 血清型覆盖率间呈“S”形的剂量-反应关系(P=0.004),其中2岁组儿童PCV13血清型覆盖率最高(91.1%)。儿童年龄与PI-1覆盖率间呈“S”形的剂量-反应关系(P=0.004),各年龄组儿童PI-1覆盖率均较低(13.0%~58.5%);儿童年龄与PI-2覆盖率间呈“S”形的剂量-反应关系(P<0.001),各年龄组儿童PI-2覆盖率均较低(6.0%~29.4%)。见表1、图1。对于蛋白疫苗相关的pspA基因覆盖率,儿童年龄与其覆盖率间存在线性剂量-反应关系(P=0.005),随着年龄的增长,覆盖率逐渐升高,但各年龄组pspA基因覆盖率均维持在较低水平(1.1%~12.9%)(表1)。对于蛋白疫苗相关的lytA、ply基因覆盖率,儿童年龄与其覆盖率之间的线性(分别为P=0.201、P=0.957)与非线性(分别为P=0.699、P=0.739)剂量-反应关系均无统计学意义,但在各年龄组中均维持在较高水平 (lytA: 96.6%~100%;ply: 99.0%~99.1%)。

图1 基于RCS模型分析年龄与肺炎链球菌疫苗血清型/基因型覆盖率的关系 A:儿童年龄与PCV10覆盖率间存在非线性剂量-反应关系;B:儿童年龄与PCV13覆盖率间存在非线性剂量-反应关系;C:儿童年龄与PI-1覆盖率间存在非线性剂量-反应关系;D:儿童年龄与PI-2覆盖率间存在非线性剂量-反应关系。图中线条为不同年龄组儿童的疫苗血清型/基因型覆盖率的预测值,阴影部分为预测值的95%置信区间。
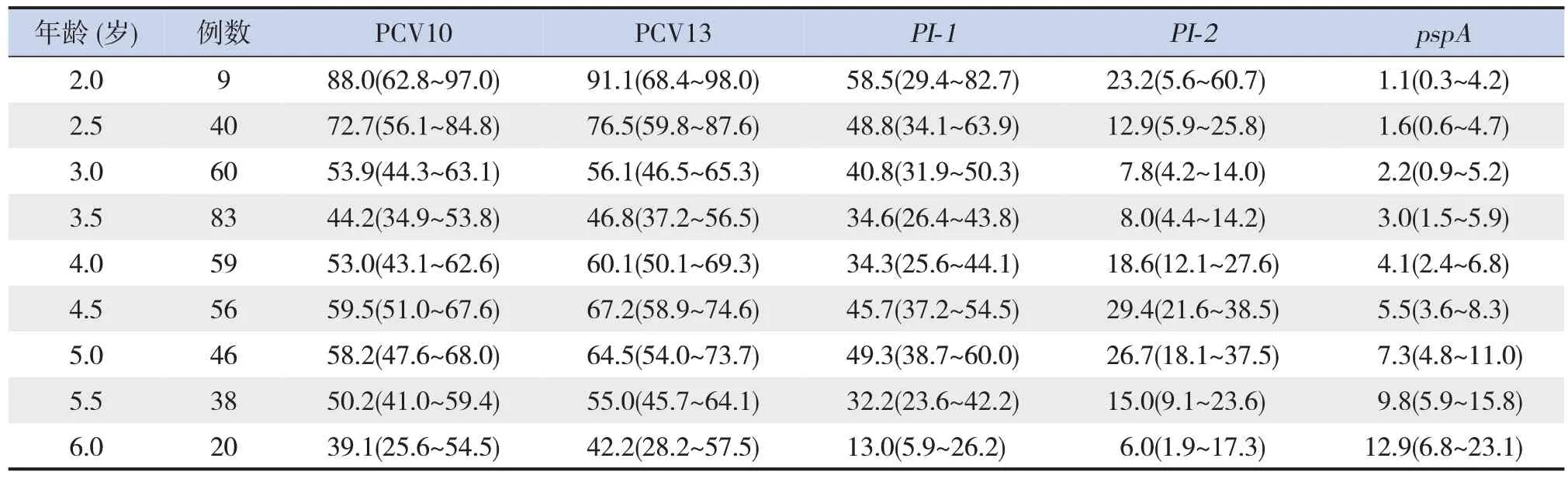
表1 不同年龄儿童肺炎链球菌疫苗血清型/基因型覆盖率的预测结果 [%(95%CI)]
3 讨论
肺炎链球菌是幼儿园儿童最主要的条件致病菌,主要定植在鼻咽部。荚膜多糖(capsular polysaccharide, CPS)是肺炎链球菌致病的主要毒力因子,根据不同菌株CPS抗原的差异性,可将肺炎链球菌分为100 多种血清型[10]。本研究结果显示:幼儿园7岁及以下健康儿童鼻咽部中肺炎链球菌主要血清型为6B、19F、15A、23A 和34 型,没有检测出PCV10 所包含的额外血清型(1、5 和7F型)。我国一项儿童调查研究表明,成都市5 岁及以下儿童鼻咽部肺炎链球菌主要血清型为19F、6B、19A、6A、23F型[11];重庆市5岁及以下儿童鼻咽部肺炎链球菌的主要血清型为23F、11B、9A、7C 型[12],本研究中血清型分布与上述研究存在差异。国外一项研究显示,泰国5岁及以下IPD儿童临床菌株的主要血清型为6B、23F、14、9A、19F型[13];加拿大18 岁及以下IPD 儿童临床菌株主要血清型为7F、33F、19A型[5];美国18岁及以下肺炎儿童临床菌株主要血清型为19A、35B、3、34型[14];俄罗斯联邦的日托中心6 岁及以下健康儿童鼻咽部菌株主要血清型为4、19F、6 型[15],本研究中血清型分布与上述研究也存在差异。不同研究中血清型分布的差异性可能与地理位置、菌株来源(定植与感染菌株)或采样部位、年龄段不同等因素有关。
本课题组前期研究提示,幼儿园儿童间存在肺炎链球菌的班级内、班级间的交叉传播风险[16]。幼儿园儿童具有黏膜免疫系统尚未发育成熟、群体生活且肺炎链球菌携带率高的特点,是肺炎链球菌感染的高危人群。除了加强幼儿园的卫生管理外,接种疫苗也是预防疾病最经济、最有效的手段,PCV 是目前为止预防儿童感染肺炎链球菌的最有效疫苗。值得注意的是,虽然结合疫苗所覆盖血清型是基于免疫群体肺炎链球菌的优势血清型分布,但是结合疫苗的使用会致使人群肺炎链球菌的疫苗血清型流行率下降而非疫苗血清型流行率上升[5];且不同地理位置、不同菌株来源、不同年龄段儿童肺炎链球菌疫苗血清型覆盖率也存在较大波动[2,4,11-15]。因此结合疫苗的接种规划仍依赖于肺炎链球菌血清型分布的准确监测数据,以更好地评估结合疫苗的有效性。本研究中最常见的血清型为PCV10 血清型6B、19F、23F 与PCV13 血清型19A、6A,超过50%的分离株属于血清型6B、19F、23F,这与以往我国医院儿童临床分离株研究结果相似[17-19],提示PCV 目前仍能覆盖大部分健康儿童的血清型,但仍需继续监测PCV13中未涵盖的血清型15A、23A与34的高流行率状态。PCV10 自2008 年在我国上市,并于2017年被PCV13 取代。值得关注的是,由于肺炎链球菌疾病发生率高、致残率高、病死率高,所以世界卫生组织将肺炎链球菌疾病列为需“极高度优先”使用疫苗预防的疾病[2];但是,PCV 至今仍未纳入我国儿童免疫规划且价格较贵,因此现阶段儿童的接种率仍然较低,导致PCV 对预防我国儿童肺炎链球菌相关疾病方面的作用仍较为有限[20]。本研究中的幼儿园儿童肺炎链球菌研究结果显示,PCV10 与PCV13 血清型覆盖率分别为53.0%和57.9%,这与一项我国的系统评价研究结果一致(PCV10 和PCV13 血清型覆盖率分别为29.7%~62.3%、43.2%~61.4%)[20]。以上研究结果表明,PCV10 与PCV13 可以有效减少疫苗覆盖的血清型菌株导致的肺炎链球菌感染,降低肺炎链球菌疾病负担,但是疫苗的覆盖率仍有待进一步提高。
值得重视的是,疫苗血清型覆盖率随年龄的动态变化趋势至今仍未明确。本研究的创新之处是:采用基于RCS 的logistic 回归模型探究儿童年龄与肺炎链球菌疫苗血清型覆盖率间的剂量-反应关系。既往研究主要将年龄划分为若干组段,从而探讨不同年龄段儿童PCV 血清型覆盖率的差异性,以及运用趋势χ2检验揭示是否存在线性趋势[20-23];但是传统趋势χ2检验无法揭示年龄与疫苗血清型覆盖率之间是否存在非线性剂量-反应关系,更重要的是无法探究是否存在阈值效应或拐点,因此无法最大效度地指导疫苗接种。本研究中RCS 模型的分析结果表明:儿童年龄与肺炎链球菌疫苗(PCV10、PCV13)血清型覆盖率呈现明显的非线性剂量-反应关系,表现为先下降后上升再持续下降的“S”型曲线。同时,本研究通过RCS 模型预测不同年龄段PCV 覆盖情况,结果表明:2 岁组儿童的PCV10、PCV13 血清型覆盖率较高(分别高达88.0%、91.1%),而6 岁组儿童的PCV10、PCV13 血清型覆盖率较低(分别为39.1%和42.2%),表明低年龄段儿童的PCV 血清型覆盖率明显高于高龄段儿童,这一现象可能与低龄儿童肺炎链球菌高发病率、疫苗免疫对象(即5岁以下儿童)感染菌株的血清型分布有关。值得重视的是,以往研究揭示幼儿园低年龄段儿童肺炎链球菌交叉传播风险明显高于高年龄段[16]。因此,考虑低龄幼儿园儿童肺炎链球菌的“高PCV 覆盖率”和“高传播风险”两大特征,今后应重视PCV对幼儿园儿童(特别是2岁组儿童)的重要预防作用,可通过主动免疫预防来降低儿童肺炎链球菌感染的发生率。
结合疫苗极大地降低了儿童IPD的发病率,然而由于结合疫苗的选择性压力,全球非疫苗血清型导致的肺炎链球菌疾病显著增加,已成为重要的公共卫生问题[5]。而且结合疫苗仅局限于特定血清型,组分复杂导致生产成本较高。与PCV 相比,重组蛋白疫苗具有更低的成本和更强的免疫原性,并且不受血清型的限制,因此基于肺炎链球菌毒力因子和表面蛋白的新型蛋白疫苗已成为重要的候选疫苗[24-25]。既往文献报道,候选疫苗相关蛋白,例如菌毛结构(PI-1、PI-2)与毒力因子(lytA、ply 与pspA)是开发新一代蛋白质疫苗的关键候选靶标[2-3,7-9]。因此,本研究分析了菌毛基因(PI-1、PI-2) 与毒力基因(lytA、ply与pspA)在菌株中的流行率,结果表明:年龄与菌毛基因覆盖率呈现明显的非线性剂量-反应关系,但其在儿童中的总体覆盖率较低(PI-1为37.7%,PI-2为16.1%)且各年龄阶段的覆盖率也均较低(PI-1为13.0%~58.5%,PI-2为6.0%~29.4%),这与柳州市的医院5岁以下儿童菌株的研究结果有一定差异[7],提示PI-1与PI-2在人群中的覆盖率具有地区差异性,这可能与研究对象特征、样本类型等差异有关[7];年龄与pspA覆盖率存在线性剂量-反应关系,但在各年龄段幼儿园儿童中pspA覆盖率均较低(1.1%~12.9%);年龄与lytA、ply覆盖率不存在剂量-反应关系,但其在幼儿园儿童携带菌株中的流行率分别高达99.5%与99.0%,这表明毒力基因lytA、ply在佛山市顺德区幼儿园儿童的肺炎链球菌分离株中高度流行,这与以往发现肺炎链球菌毒力基因lytA、ply在我国西南部地区具有极高流行率一致[11,18,26],提示毒力基因lytA、ply在重组蛋白疫苗的开发中具有很高的应用潜力。
综上所述,本研究结果表明,儿童年龄与PCV10、PCV13血清型覆盖率呈现明显的非线性剂量-反应关系,且低年龄段儿童的血清型预测覆盖率明显高于高龄段儿童,2 岁组幼儿园儿童PCV10、PCV13血清型覆盖率均较高,提示应该重视PCV对幼儿园儿童(特别是2岁儿童)的重要预防作用。同时,所有年龄组的儿童保持蛋白疫苗候选基因lytA与ply的高覆盖率,为设计新型肺炎链球菌重组蛋白疫苗提供了新的思路。但是,本研究也存在一定局限性:(1)采用横断面研究,只调查了某一区域集中时间儿童疫苗的覆盖情况,无法对疫苗覆盖的长期动态变化规律进行全面评估。因此在后续研究中可以开展连续多次、更大范围的监测,评估更大范围幼儿园儿童疫苗血清型、基因型的覆盖规律。(2)本研究是基于幼儿园儿童进行的集中时间、集体采样研究,同时课题组既往研究表明幼儿园儿童菌株间存在一定交叉传播风险[16],此类基于幼儿园儿童的研究设计可能会影响菌株血清型分布,因此今后可进一步开展社区儿童的肺炎链球菌研究来验证本研究结果。
