双 酶 法 制 备 大 米 多 肽 的 研 究
2023-11-01顾杰瑞刘可意刘午若文颖月李丕武
■ 顾杰瑞 刘可意 丁 烽 刘午若 文颖月 李丕武
(齐鲁工业大学(山东省科学院)生物基材料与绿色造纸国家重点实验室,山东济南 250353)
大米是我国重要的粮食作物之一,2021年度我国大米总产量约为1.47亿吨,占全球大米产量的29%[1]。大米中主要成分包括碳水化合物(75%~80%)、蛋白质(7%~8%)和脂质(1.3%~1.8%),过去在我国食品加工行业中多以大米为原料生产淀粉和糖浆等产品,作为其生产副产物的大米蛋白却没有得到很好的利用,以往多被直接用作动物饲料,少数被开发利用成相关产品,大量的高质量蛋白资源遭到浪费。
随着近年来我国市场对蛋白粉需求量的不断扩大,可作为食用蛋白粉直接生产原料的大米蛋白受到社会和市场越来越多的关注[2]。大米蛋白(rice protein,RP)具有易于消化吸收、低致敏性等特点,其生物效价为77,与WHO/FAO建议的营养模型相近,是一种优质的植源性膳食蛋白。由大米蛋白制备的大米多肽不仅有着很高的营养价值,还具有增强机体免疫力等作用[3]。大米蛋白主要由清蛋白(2%~5%)、球蛋白(2%~10%)、谷蛋白(66%~78%)和醇溶蛋白(1%~5%)组成,其中,水不溶性的谷蛋白和醇溶蛋白占80%以上[4]。现有大米蛋白肽制备方法中最常用的是通过碱液溶解,然后加酸沉淀的方式,但是,在高碱性环境中,蛋白质的产率通常很低,且容易发生交叉耦合和重排[5],从而降低蛋白质的营养价值。目前研究和实践方法中多采用酶制剂对大米蛋白进行增溶改性,并对其水解产物大米多肽进行功能特性和营养价值的开发。马晓雨等[6]采用胰蛋白酶法将大米蛋白酶解,使大米蛋白的溶解和乳化性能得到明显的提高,其抗氧化能力明显增强,并可有效地改善其功能性。Singh 等[7]利用木瓜蛋白酶处理米糠蛋白,得到的水解产物RBPH 具有较高的溶解度和消化率,其潜在的生物活性有一定程度增加。许多研究者对超声辅助酶处理大米蛋白的工艺进行了探究,如Fathi等[8]使用超声-Alcalase 联合处理的方法水解米糠蛋白(RBP),证实了超声处理通过影响蛋白质的结构来增强酶水解的作用,并在超声条件(150 W,40 min)下取得最高的水解度[(27.35±0.45)%]。与非水解样品相比,生成水解物的蛋白质和肽拥有更低的分子量。还有研究者运用多酶共同作用复合酶解等方式处理大米蛋白,如徐珍珍等[9]以大米蛋白为原料,采用优化后的酶解法,制备大米蛋白肽,其蛋白质的回收率可达43.9%,且分子量较低,感官评定及生物活性均较好。为了进一步提高酶法水解大米蛋白的效力,本研究采用碱性蛋白酶与中性蛋白酶复合酶解大米蛋白的工艺,结合超声预处理技术,进行大米蛋白肽制备,检测其溶解度和溶液中短肽含量的变化,并通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)技术和氨基酸分析仪对复合酶解产物进行分子结构和氨基酸成分分析,进而优化大米蛋白肽生产工艺,为大米蛋白的深加工技术提供进一步的研究基础。
1 材料与方法
1.1 主要材料与试剂
大米蛋白粉,山东大树达孚特膳食品有限公司;碱性蛋白酶(酶活力单位200 000 U/g)、中性蛋白酶(酶活力单位200 000 U/g),山东隆科特酶制剂有限公司;Methyl red 甲基红指示剂、Bromocresol Green 溴甲酚绿指示剂,北京酷来搏科技有限公司;混合氨基酸标品,北京索莱宝科技有限公司;氢氧化钠、盐酸、硼酸、三氯乙酸,均为国药集团化学试剂有限公司的分析纯试剂。
1.2 主要仪器与设备
SCIENTZ-HF5000 超声波循环提取机,宁波新芝生物科技股份有限公司;ES-E 系列标准分析天平,天津市德安特传感技术有限公司;PHS-3C 精密pH 计,济南欧莱博生物科技有限公司;ZQZY-CF8E 三层组合式全温振荡培养箱,上海知楚仪器有限公司;DSHZ-300 旋转式水浴恒温振荡器,苏州培英实验设备有限公司;德国Hermle(哈默)大容量冷冻型高速离心机Z326K,贺默(上海)仪器科技有限公司;KDN-16C数显温控消化炉、KDN-1000全自动定氮仪,上海新嘉电子有限公司;FT-IRTracer100 傅里叶变换红外光谱,日本岛津公司;日立氨基酸自动分析仪L-8900,广州仪德精密科学仪器股份有限公司。
1.3 试验方法
1.3.1 样品制备
称取10 g(精确至0.000 1 g)大米蛋白粉置于250 mL玻璃烧杯中,加入0.1 mol/L NaOH溶液120 mL,在磁力搅拌器上搅拌15 min,混匀,配置成固液比1∶12的大米蛋白悬液,进行超声预处理[10(]超声处理的条件为:在每升处理液施加超声功率250 W、超声处理时间10 min、超声工作间歇比1∶2、循环速率30 r/s)。冷却至室温后,在8 000 r/min、18 ℃条件下离心15 min,取上清液,微滤、超滤后置于4 ℃保存,此为对照组。
将超声预处理过的溶液pH 调至10,在50 ℃条件下,按质量比0.8%加入碱性蛋白酶酶解2 h,酶解过程中保持pH不变,酶解结束后90 ℃水浴灭酶10 min,待冷却到室温,在8 000 r/min 、18 ℃条件下离心15 min,取上清液,微滤、超滤后置于4 ℃保存,此为单一酶解组。
用0.2 mol/L HCl溶液将单一酶解组初始pH调节为7.5,按质量比0.8%加入中性蛋白酶,在50 ℃条件下酶解2 h,酶解过程中维持pH 不变,复合酶解液水浴90 ℃灭酶10 min,冷却至室温后,在8 000 r/min 、18℃条件下离心15 min,取上清液,微滤、超滤后置于4 ℃保存,此为复合酶解组。
1.3.2 总氮含量的测定
总氮含量的测定采用凯氏定氮法[11]。使用移液器吸取1 mL 样品溶液置于250 mL 消化管底部,加入0.4 g 五水硫酸铜和6 g 无水硫酸钾,然后在通风橱内分次沿壁缓慢加入10 mL 浓硫酸,用掌心轻拍消化管外壁,将样品和试剂小心混匀,在消化管口处放置弯颈漏斗,静置过夜。放入消化炉中消解,首先设置240 ℃,不盖盖子保持30 min,然后转为420 ℃,直至溶液变为淡蓝色,继续保持1 h 后,将消化炉关掉,室温冷却、待测。利用全自动凯氏定氮仪对消化管进行蒸馏,设置程序为加入50 mL超纯水、40 mL质量分数为40%的氢氧化钠溶液,反应2 min 后,开始加热,用20 mL 质量分数为2%的硼酸溶液吸收。在蒸馏过程中,硼酸溶液会不断吸收蒸馏出的氨水。在蒸馏结束后的硼酸吸收液中滴加1~2 滴甲基红-溴甲酚绿指示剂,混匀,用酸性滴定管向蒸馏液中加入0.1 mol/L 盐酸标准溶液进行滴定,直至溶液由蓝绿色变为灰红色,并记录盐酸标准溶液的消耗体积。
式中:X——试样中总氮含量(g/mL);
V1——滴定试样时所消耗的盐酸体积(mL);
V2——滴定空白试样时所消耗的盐酸体积(mL);
V3——试样取用量(mL);
c——盐酸标准滴定溶液的浓度(mol/L);
0.014——与1.00 mL 标准HCl 溶液相当氮的质量(g)。
1.3.3 大米蛋白粉溶解度测定
使用量程为10 mL玻璃量筒分别准确量取对照组、单一酶解组和复合酶解组的大米蛋白溶液各10 mL,置于50 mL玻璃烧杯中,在磁力搅拌器上搅拌15 min,混匀,将溶液转移至离心管中,以4 200 r/min 离心10 min,小心移取上清液1 mL,放入消化管中,通过1.2.2中的方法测定上清液中蛋白质含量,同时测定同一样品总蛋白质含量[12]。
1.3.4 大米蛋白溶液中短肽含量评价
用三氯乙酸氮溶指数(TCA-NSI)来衡量大米多肽中短肽含量[13]。使用量程为10 mL 的玻璃量筒分别准确称取对照组、单一酶解组和复合酶解组大米蛋白溶液各10 mL,置于50 mL玻璃烧杯中,在磁力搅拌器上搅拌15 min,混匀,使用10 mL 移液管分别准确加入10 mL 10%的三氯乙酸(TCA),静置30 min后4 200 r/min 离心10 min,取上清液2 mL 进行微量凯氏定氮,测定其三氯乙酸氮溶指数(TCA-NSI)。
1.3.5 大米蛋白肽的结构鉴定
将45 ℃烘干至恒重的大米蛋白粉状样品与KBr按1∶100 比例在研钵中研磨混匀,压片后均匀地平铺于FTIR Tracer100 傅里叶红外光谱仪的金刚石检测窗口,旋转压力旋钮至指示压力,确保试样和测试面窗口保持紧密的接触,以减少在试验中的红外光束损耗。记录每个样品在波数400~4 000 cm-1光谱范围内以4 cm-1的分辨率扫描32 次光谱的平均值。在做样品之前须做空白干净金刚石的背景扫描。检测到的光谱数据采用FT-IR Tracer100 光谱仪所配备的软件OMNIC 进行基线校正和均一化处理,最后计算光谱差值,得到红外光谱[14]。
1.3.6 氨基酸成分分析
将样品称重后放入玻璃水解管,并加入6 mol/L盐酸10 mL,在减压下密封水解管,垂直氮吹3 min后,压盖密封,使用水解器在110 ℃的加热温度下分解22 h。加热结束后,将水解管取出冷却至室温,在减压下干燥成固体,去除盐酸。最后使用0.02 mol/L盐酸稀释至一定浓度后用作样品,最终标准浓度为0.5 mg prot./mL。样品上机前用0.22 μm 滤膜进行过滤,收集滤液进行分析,进样量为20 μL,检测器波长为570 nm和440 nm,色谱柱型号为LCA K06/Na,流动相为缓冲液A、缓冲液B、缓冲液D(再生液)和水,洗脱泵流速:0.45 mL/min,衍生泵流速:0.25 mL/min,温度为58~75 ℃梯度温控,压力为3~7 MPa[15]。
1.3.7 数据统计分析
采用Microsoft Excel 2010 软件对数据进行处理和绘图,采用SPSS 18.0 软件进行单因素分析(oneway ANOVA),用Duncan’s 法进行多重比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 大米蛋白溶液溶解度的测定结果分析
如图1所示,对照组溶解度为37.05%,与对照组相比,单一酶解组溶解度(51.55%)极显著提高(P<0.01);复合酶解组溶解度(56.18%)极显著提高(P<0.01)。复合酶解组溶解度显著高于单一酶解组(P<0.05)。

图1 不同酶解条件大米多肽溶液溶解度
2.2 大米蛋白溶液中短肽含量的测定结果分析
如图2 所示,对照组的短肽含量仅为12.15%,与对照组相比,单一酶解组短肽含量(71.44%)极显著提高(P<0.01);复合酶解组短肽含量(89.38%)极显著提高(P<0.01)。复合酶解组溶解度显著高于单一酶解组(P<0.05)。

图2 不同酶解条件大米蛋白溶液中短肽含量
2.3 大米蛋白肽的结构分析
如图3所示,3 309.23 cm-1附近吸收峰主要归因于酰胺Ⅱ带的泛频和费米振动;2 892.65 cm-1附近吸收峰处于酰胺B 带,归属于C―H 伸缩振动;1 632.72 cm-1附近吸收峰属于酰胺Ⅰ带,主要是由80% C═O 伸缩振动所导致,表现为α-螺旋结构;1 557.31 cm-1附近吸收峰主要是由60%―H 面内弯曲振动和40%C―N伸缩振动所导致;1 406.90 cm-1附近吸收峰主要归属于―CH3和―CH2的不对称变形振动;1 240.58 cm-1附近吸收峰属于酰胺Ⅲ带,主要是C═O弯曲振动和C―N伸缩振动所产生;1 097.57 cm-1附近吸收峰可归为少量胱氨酸氧化物。

图3 复合酶解组大米多肽红外光谱分峰图
2.4 大米蛋白肽的氨基酸成分分析
如图4、图5所示,样品中含量最高的是谷氨酸,含量达到了8.8 nmol/L,接下来依次是天冬氨酸、亮氨酸、丙氨酸和甘氨酸,含量均达到了4 nmol/L以上,主要氨基酸成分中还有丝氨酸、缬氨酸和精氨酸,含量分别为3.631、3.309、3.181 nmol/L。除了含量排名前8 位的氨基酸之外,其他氨基酸(苏氨酸、脯氨酸、蛋氨酸、异亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、组氨酸)共占比28.31%。
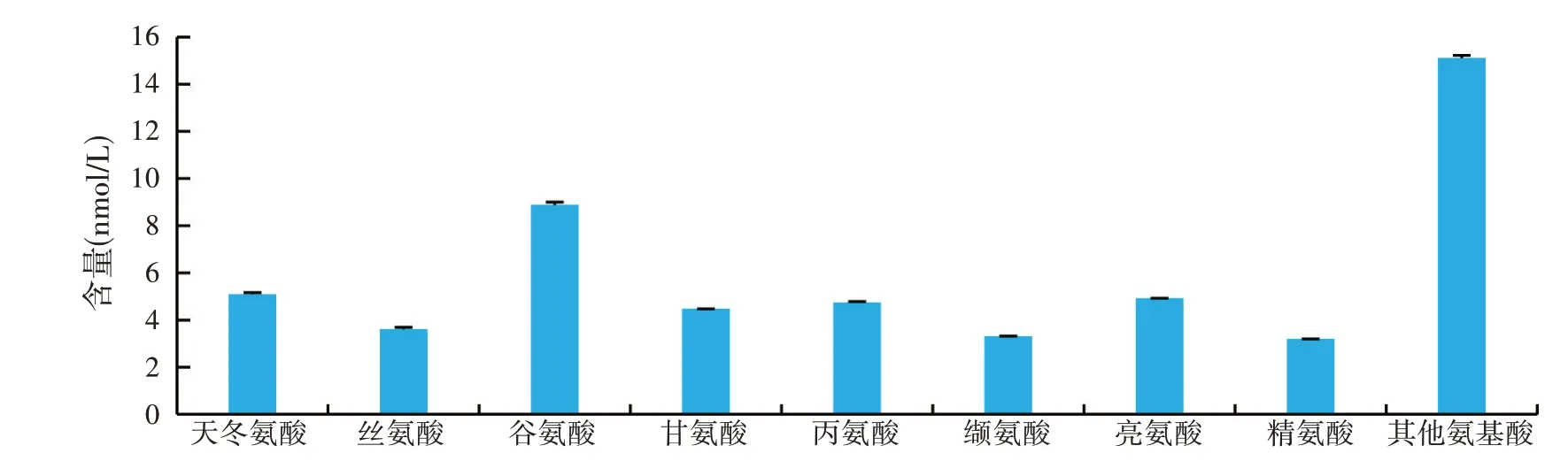
图4 复合酶解组大米多肽中主要氨基酸成分及其含量

图5 复合酶解组大米多肽VIS1和VIS2整体色谱图
3 讨论
溶解度是蛋白质的一种功能特性,是在不同加工条件下判断蛋白质潜在应用价值的关键因素,可以作为评价指标在食品和饲料研究领域发挥重要作用[16-17]。物质溶解能力的大小往往取决于其内在组成部分。未经处理的大米蛋白溶解度较低,与其中所含高比例的谷蛋白和醇溶蛋白有较大关系。由图1可得,经过超声和碱处理的大米蛋白溶液溶解度可达37.05%,这是因为经过超声波处理后蛋白内部结构发生了一定的改变,增强了其溶解性,并且经过超声处理可以使蛋白酶更好地作用于蛋白内部结构,而部分碱溶性蛋白在碱性环境下有着更好的溶解效果。与对照组相比,单一酶解组和复合酶解组使得大米蛋白溶液溶解度得到进一步提升,说明碱性蛋白酶和中性蛋白酶的复合酶解对大米蛋白的溶解度有显著提升作用,这很大程度上是因为碱性蛋白酶的作用位点多存在于谷蛋白和醇溶蛋白上,经过酶解作用后,使两者的肽链被切断,结构发生改变,溶解度显著提高,而中性蛋白酶作为碱性蛋白酶的补充,使得大米蛋白的水解更为彻底。
三氯乙酸可以作为蛋白质沉淀剂,将大米蛋白溶液中的可溶性蛋白质和肽链较长的肽沉淀,并用酸将短肽溶解出来,所以可以利用三氯乙酸氮溶指数(TCA-NSI)与相同条件下蛋白溶液溶解度的比值,来反映短肽在蛋白溶液的溶质中所占比例,简称短肽含量。相比于游离氨基酸,动物机体以短肽形式吸收的氨基酸强度要更高,并且短肽这种易吸收特性有利于动物体内肠道益生菌的繁殖和微量元素的吸收,以促进动物体的生长发育[18]。与对照组和单一酶解组相比,复合酶解组中短肽在溶液溶质中所占的比例有显著的提高,可以说明碱性蛋白酶和中性蛋白酶对大米蛋白有着极佳的酶解效果,能够使大米蛋白内部的功能区更多地被释放出来,从而使其具有制备各种功能短肽的条件,增进其利用价值。
据相关研究表明[19-20],大米多肽可以调节人体内多个生理过程,还具备抗衰老、增强机体免疫力等作用。为了进一步证明经过碱性蛋白酶和中性蛋白酶作用的大米蛋白溶液中,主要成分为具有多种生物学功能的多肽,而非小分子氨基酸,我们利用FTIR 技术对复合酶解组中的溶质进行了分析检测,由图3 分析可得,复合酶解组中溶质的特征峰位置与蛋白肽相吻合[21],可以判定通过碱性蛋白酶和中性蛋白酶复合酶解所制得的大米蛋白肽具有多肽的基本结构,而不是小分子氨基酸结构。
将复合酶解组制得的产物大米多肽溶液进行氨基酸成分分析[22],根据图4、图5 可得,经复合酶解后的大米多肽中,具有8 种人体必需的氨基酸,氨基酸组成和种类十分丰富。将所测得的大米蛋白肽氨基酸成分与豆粕蛋白、玉米蛋白相比[23],大米蛋白的生物价相对较高,其营养价值可与动物源蛋白相媲美。在保健功能方面,大米多肽还能够降低人体内的胆固醇水平,预防高血压,并具有促进伤口愈合的功效[24-25]。根据上表分析,大米蛋白与豆粕蛋白、玉米蛋白相比,三者含有的氨基酸种类齐全,均含有人体所需的8 种必需氨基酸和2 种半必需氨基酸。虽然大米蛋白必需氨基酸总量较豆粕蛋白略低,但大米蛋白的氨基酸组成较为均衡,符合世界卫生组织的建议。并且大米蛋白具有低抗原性,更有利于生产婴幼儿食品。
本试验使用了碱性蛋白酶和中性蛋白酶复合酶解大米蛋白,结合超声预处理技术,优化其生产工艺,显著提高了大米多肽溶液的溶解度和短肽含量,并分析了大米蛋白肽的分子结构和氨基酸成分,为大米蛋白的深加工技术提供进一步的研究基础。
但本试验未对蛋白肽中所含的风味物质展开研究,未来市场会对蛋白肽相关产品表现出极大兴趣,相应的功能性饮料和保健饮品也会随之逐渐面世。在未来的研究中,可以尝试多种不同的酶对植物蛋白进行复合酶解,结合超声处理,提高产物浓度,改善其风味和口感,并对产物多肽的功能性展开研究,生产出更多对身体健康有益的产品,减少大米蛋白资源的浪费,促进中国食品深加工技术的发展。
4 结论
本研究首次通过碱性蛋白酶和中性蛋白酶对大米蛋白溶液的复合酶解作用,与超声预处理技术相结合,工艺简单,成本低廉,使所得大米多肽溶液溶解度提高到56.18%,且溶质中短肽含量占比高达89.38%。通过FTIR 技术进行检测,发现复合酶解产物红外光谱特征峰位置与蛋白肽基本符合,具有多肽的基本结构。氨基酸分析仪的检测结果表明,其氨基酸组成丰富,含有8 种必需氨基酸,大米蛋白营养价值得到了充分地提高。
