饲料磷脂水平对中华绒螯蟹仔蟹存活、生长、消化酶活性、生化指标及Neverland基因表达的影响
2023-11-01满敦蕊石伟帅陶长红姜玉声衣启麟左然涛
■ 袁 融 满敦蕊 石伟帅 陶长红 姜玉声 衣启麟 黄 姝 左然涛
(大连海洋大学水产与生命学院,农业农村部北方海水增养殖重点实验室,辽宁大连 116023)
中华绒螯蟹(Eriocheir Sinensis)又称大闸蟹或河蟹,因其丰富的营养价值和独特的口感而广受消费者喜爱[1-2]。近年来,日益增长的市场需求导致中华绒螯蟹过度捕捞,其自然资源量严重下降[3]。随着中华绒螯蟹人工繁育和苗种培育技术被相继突破,中华绒螯蟹人工增养殖发展迅速[4-5],现已成为我国重要的水产经济养殖品种之一,养殖年产量已突破80 万吨[6]。传统的中华绒螯蟹养殖中,通常饲喂玉米、南瓜、大豆和杂鱼等[7],这些生物饵料存在营养不均衡、供应不稳定、贮藏不方便、容易携带致病菌等缺陷[8]。2022 年农业农村部印发《“十四五”全国渔业发展规划》,明确提出推动配合饲料代替野生幼杂鱼、推进生态健康养殖模式。因此,开发和推广应用中华绒螯蟹配合饲料势在必行。
脂类是生物体的重要能量物质,同时也是必需脂肪酸的来源和脂溶性维生素的载体[9-12]。磷脂是一类分子中含磷的极性脂,包括磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇和磷脂酰胆碱[13-14]。磷脂在促进水生动物的生长、免疫、性腺发育和繁殖性能等方面发挥着重要作用[13,15-21]。中华绒螯蟹的磷脂需求受生长阶段、磷脂来源和其他营养素(如胆固醇)水平的影响。饲料中添加2%~4%的大豆卵磷脂能有效提高中华绒螯蟹幼体[初始体质量为(1.23±0.36) g]的蜕壳率和生长速度[22]。饲料中添加2.89%~2.95%的大豆卵磷脂可以提高中华绒螯蟹幼蟹[初始体质量为(0.52±0.01) g]的生长速度和抗氧化能力并促进了脂肪从肝胰腺向肌肉的转移效率[23]。磷虾油对中华绒螯蟹幼蟹[初始体质量为(0.26±0.01) g]的促生长效果最好,其次是卵黄磷脂,大豆卵磷脂的促生长效果最差[24]。
蜕壳是甲壳动物的重要生理活动,虽然磷脂对甲壳动物生长和蜕壳的有益影响已被广泛报道,但其调控机制尚不完全清楚。消化酶在营养物质的消化和吸收中起着重要作用。消化酶活性直接反映动物消化能力和饲料转化效率,并影响其生长速度[25]。研究表明,磷脂营养对水生动物消化酶活性有显著促进作用[26-29]。磷脂和胆固醇的协调作用在甲壳动物中被广泛证明,但相关机制尚未阐明。Neverland基因(Nvd)最早在家蚕和果蝇中发现[30-33],Nvd的调节作用主要是通过与胆固醇7-脱氢酶结合,使胆固醇脱氢形成7-脱氢胆固醇(维生素D 前体),然后在CYP105A1和CYP2R1 这两种酶的作用下生成1α,25-二羟基维生素D3(俗称维生素D3)[34-37]。维生素D 可以促进甲壳动物对钙的吸收,有利于其蜕皮和生长[38-40]。然而,目前尚不清楚添加磷脂对中华绒螯蟹Nvd表达的影响。因此,本研究旨在探究饲料中添加磷脂对中华绒螯蟹仔蟹存活、生长、消化酶活性、生化指标和Nvd表达的影响,以期为理解磷脂对中华绒螯蟹的有益作用提供参考。
1 材料与方法
1.1 实验饲料
本实验以鱼粉、豆粕和酪蛋白为主要蛋白源,以大豆卵磷脂和棕榈油为主要脂肪源,通过梯度添加大豆卵磷脂配制了5 种等氮等脂的饲料,饲料磷脂水平依次为0、1%、2%、3%和4%,饲料配方组成和营养水平如表1 所示。在饲料制备之前,所有固体饲料原料粉碎过80 目筛。依据逐级扩大的原则,准确称量固体原料并充分混合,随后将其与相应的脂类混合物再次混匀,最后加入35%的纯净水。使用双螺杆自动制粒机(济南鼎润机械公司)将饲料原料压制成直径1.5 mm 的饲料。制作好的饲料低温(55 ℃)烘干,冷却后密封在自封袋中,保存在-20 ℃冰箱中备用。

表1 实验饲料配方及组成(干物质基础,%)
1.2 饲养实验和日常管理
实验于2021 年8 月—10 月在辽宁省盘锦市光合蟹业有限公司研发中心实验基地开展。实验用淡水为地下井水,在室外土池曝气1 个月,在砂滤后被抽室内蓄水池继续曝气。
实验所用中华绒螯蟹仔蟹购自江苏省南通市海通水产有限公司,被暂养在室内水泥池进行为期2 周的驯化,每天早晚两次投喂对照组饲料,以适应养殖环境和实验饲料。暂养结束后,随机选取体质量相近(0.52±0.02) g、附肢完整的健康仔蟹,置于15 个塑料水槽(60 cm×40 cm×40 cm)中,每个水槽放养20 只。每种实验饲料随机投喂3 个水槽的仔蟹。在每个水槽放置一定数量的塑料管和塑料网以减少同类之间残食。每天两次(07:00 和17:00)对中华绒螯蟹进行表观饱食投喂,每次投喂后通过虹吸清除残饵、粪便。每隔一天换水1 次,每次换水量为水箱体积的50%。摄食生长实验共持续60 d,实验期间,水体pH 7.6~7.8,水温23~26 ℃,溶氧8 mg/L 以上,氨氮和亚硝酸盐浓度分别控制在0.05 mg/L和0.07 mg/L以下。
1.3 样本采集
实验结束后,对中华绒螯蟹进行24 h 饥饿处理,并对每个水槽仔蟹进行计数和称重。随后,从每个水槽中随机挑选3~4 只仔蟹置于冰上麻醉,解剖获取肝胰腺,并将其放入无酶离心管,液氮速冻后保存在-80 ℃冰箱中。
1.4 生化分析
使用南京建成生物工程研究所有限公司的试剂盒测定中华绒螯蟹肝胰腺中三酰甘油、总胆固醇、蛋白质的含量和脂肪酶、纤维素酶、胰蛋白酶、淀粉酶的活性。
1.5 实时定量PCR
使用DP424 Trizol通用试剂(天根)提取仔蟹的肝胰腺总RNA。使用琼脂糖电泳检测RNA 完整性,并利用Agilent 2100 生物分析仪显微分光光度计检测RNA 浓度。采用PrimeScriptTMRT reagent Kit (Perfect Real Time)试剂盒(北京依珊汇通科技有限公司)获取cDNA,反转录体系见下表2,反应条件:37 ℃15 min,85 ℃ 5 s,cDNA保存于-20 ℃。

表2 cDNA生成体系
实时荧光定量引物序列见下表3,将反转录得到的cDNA 用DEPC water稀释5倍作为模板,使用Light-Cycler®96(Roche Group,Basel,Switzerland)荧光定量PCR 仪,按照PrimeScriptTMReal time PCR Ki(t宝日医生物技术有限公司)配置反应体系,具体见下表4,反应条件:95 ℃,10 min;95 ℃,15 s;60 ℃,60 s;40 个循环;95 ℃,10 s;65 ℃,60 s;97 ℃,1 s。最后采用2-ΔΔCT算法分析实时定量数据。

表3 实时荧光定量所使用的引物

表4 实时荧光定量反应体系
1.6 计算与统计分析
增重率(WGR,%)=(Wf-Wi)/Wi×100
存活率(SR,%)=Nf/Ni×100
特定生长率(SGR,%/d)=(lnWf-lnWi)/d×100
饲料系数(FCR)=F/(Wf-Wi)
式中:Wi和Wf——分别为各水槽仔蟹的初始体质量和终末体质量(g);
Ni和Nf——分别为各水槽仔蟹的初始和最终数量;
d——实验天数(d);
F——实验期间各水槽仔蟹摄食的饲料质量(g)。
所有数据进行正态性和方差齐性检验后,利用SPSS 单因素方差分析法(one-way ANOVA)进行统计分析,使用Duncan’s 多重比较法进行组间差异性检验。若P<0.05,则认为存在显著差异,统计结果以“平均值±标准差”的形式表示。
2 结果与分析
2.1 饲料中添加磷脂对仔蟹存活、生长和饲料系数的影响
如图1 所示,随着饲料磷脂添加水平升高,仔蟹存活率呈先升高后下降的趋势,当磷脂添加水平为2%时仔蟹存活率最高,但各组间差异不显著(P>0.05)。饲料中添加磷脂不同程度提高了仔蟹增重率和特定生长率,其中1%磷脂添加组仔蟹的增重率和特定生长率最高,显著高于对照组和3%磷脂添加组(P<0.05)。饲料中添加磷脂在不同程度上降低了饲料系数,当磷脂添加水平为1%时饲料系数最低,显著低于对照组和3%磷脂添加组(P<0.05)。

图1 磷脂水平对中华绒螯蟹仔蟹存活率、增重率、特定生长率和饲料系料的影响
2.2 饲料中添加磷脂对仔蟹消化酶活性的影响
如图2 所示,较高磷脂添加水平显著降低了仔蟹胰蛋白酶和淀粉酶活性。当磷脂添加水平为3%和4%时,仔蟹胰蛋白酶和淀粉酶活性均显著低于对照组和1%磷脂添加组(P<0.05)。随着饲料磷脂添加水平升高,仔蟹纤维素酶活性先升高后下降,当磷脂添加水平为1%时纤维素酶活性最高,显著高于3%和4%磷脂添加组(P<0.05)。随着饲料磷脂添加水平升高,仔蟹脂肪酶活性呈先降低后升高,磷脂添加水平为2%时仔蟹脂肪酶活性最低,与3%磷脂组差异不显著(P>0.05),但显著低于其他各组(P<0.05)。

图2 磷脂水平对中华绒螯蟹扣蟹肝胰腺消化酶活性的影响
2.3 饲料中添加磷脂对仔蟹肝胰腺中三酰甘油和总胆固醇含量的影响
如图3 所示,随着磷脂添加水平升高,仔蟹肝胰腺三酰甘油含量显著降低,3%和4%磷脂添加组三酰甘油含量显著低于对照组和1%磷脂添加组(P<0.05)。饲料中添加磷脂未对肝胰腺总胆固醇含量产生显著影响(P>0.05)。
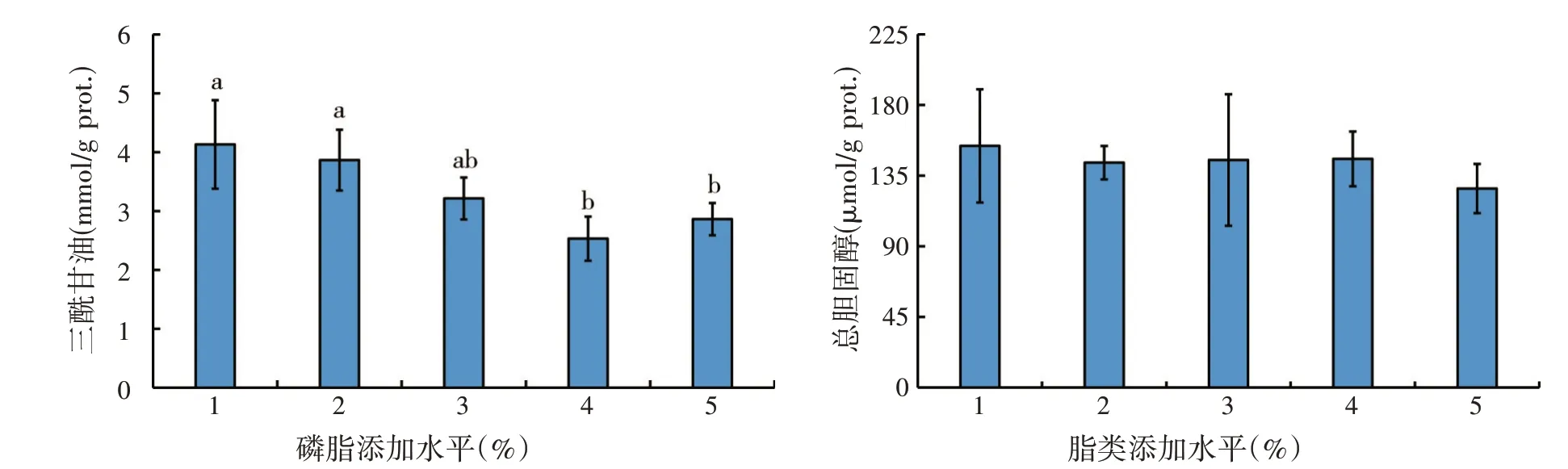
图3 磷脂水平对中华绒螯蟹仔蟹肝胰腺中三酰甘油和总胆固醇含量的影响
2.4 饲料中添加磷脂对仔蟹肝胰腺中Neverland 基因(Nvd)相对表达量的影响
如图4 所示,饲料磷脂添加水平显著影响了仔蟹肝胰腺Nvd基因表达量。随着磷脂添加水平升高至2%,Nvd表达量显著增加了1.9 倍(P<0.05),之后随着磷脂水平的进一步提高,Nvd的转录水平显著降低至对照组水平(P<0.05)。

图4 磷脂水平对中华绒螯蟹仔蟹肝胰腺Neverland表达的影响
3 讨论
本研究中,仔蟹存活率均高于80%,由于甲壳动物个体之间的相互蚕食是不可避免的,因此本实验中仔蟹的成活率是可接受的。本研究发现饲料中添加磷脂未对仔蟹存活率产生显著影响,但适量添加磷脂(1%)显著提高了仔蟹的增重率和特定生长率。本研究结果与三疣梭子蟹[18,42]、斑节对虾[43]、长毛对虾[44]、金头鲷[45]中的研究结果相似,但与中华绒螯蟹[46]、三疣梭子蟹[17]、锯缘青蟹[47-48]中的研究结果不一致,后者发现饲料中磷脂最适添加量为2%~3%。上述研究结果差异的原因可能与不同种类实验动物、不同生长阶段和磷脂源的添加种类有关[24]。磷虾油对中华绒螯蟹幼蟹[初始体质量(0.26±0.01) g]的促生长效果最好,其次是卵黄磷脂,大豆卵磷脂的促生长效果最差[24]。另外,本研究发现饲料中添加磷脂不同程度降低了仔蟹的饲料系数,其中磷脂添加水平为1%时,饲料系数最低,这说明饲料中添加1%磷脂不仅能显著提高仔蟹的生长性能,还可以在一定程度上提高饲料转化效率,降低养殖饲料成本。
肝胰腺是甲壳动物重要的消化器官,它不仅负责营养物质的储存和转运,也参与激素和酶的合成与分泌,在新陈代谢调控中发挥着重要作用[49]。本研究中,与对照组和低磷脂添加组相比,仔蟹胰蛋白酶、纤维素酶和淀粉酶活性在较高磷脂水平(3%~4%)添加时显著降低。这说明大豆卵磷脂过量添加会降低仔蟹的消化率,陈永坡[50]的研究也发现饲料磷脂水平高于3.29%时,幼草鱼肝胰腺的胰蛋白酶和淀粉酶活性降低。一方面可能是由于磷脂添加提高了脂类乳化和消化能力,提高了脂类营养供能比例,从而降低了其他营养素的消化(如脂肪对蛋白质的节约效应[51-53]),另一方面可能是由于大豆卵磷脂中富含的亚油酸引起的炎症反应有关[54-56],特别是肠道炎症反应造成肠道损伤,降低了消化酶的分泌[57-58]。而脂肪酶的活性则是随着磷脂水平的提高表现出先降后升的趋势,在磷脂水平2%时,脂肪酶的活性最低。我们认为这可能与仔蟹对营养物质种类需求的转变有关。当磷脂水平较低时,仔蟹的器官发育尚不完善,消化脂肪的能力较弱,因此需要更多的脂肪酶来消化肠道中的脂质,此时仔蟹的主要供能物质是碳水化合物和蛋白质。当磷脂水平逐渐升高,由于磷脂能够促进脂质乳化,帮助肠道吸收,仔蟹消化脂肪的压力降低,因而脂肪酶的活性也随之下降。而随着磷脂水平的进一步上升,大量脂质被磷脂乳化,导致脂肪酶的活性也随之升高[59],而大量的脂质被仔蟹利用并用于提供能量,因此仔蟹降低了对于碳水化合物的依赖[60]。本研究中三酰甘油这种供能脂类的含量在磷脂水平为3%时出现显著降低,这与林志灯[46]的研究一致,他认为磷脂水平的提高会促进供能脂类从肝胰腺向肌肉组织转运以满足生长所需。
钙是构成蟹壳的主要成分也是多种酶的激活剂,对激素、神经和肌肉的正常功能起着重要作用[61]。钙对中华绒螯蟹蜕壳有着重要影响,中华绒螯蟹会在蜕壳前摄取大量钙质储存于血淋巴和肝胰腺以确保蜕壳[62],并在蜕壳后期摄取钙来进行外壳钙化及促进机体机能恢复[63]。中华绒螯蟹会通过肠道和鳃来吸收水体中的钙[64],再通过血液将钙运输到组织中去。胆固醇是维生素D的前体,它先脱氢转化为7-脱氢胆固醇,然后在酶的催化作用下转化成维生素D3,而维生素D3对促进水产动物肠道钙的吸收和调节血钙浓度有着重要的影响[65-66],因此胆固醇有可能通过转变为维生素D3来影响中华绒螯蟹血钙水平。不过,有学者认为中华绒螯蟹身披碳酸钙质外壳,这可能会使表皮无法通过接触紫外线7-脱氢胆固醇转变为维生素D3。但根据实际观察,中华绒螯蟹喜在水浅、阳光明媚的白天蜕壳,中华绒螯蟹从旧壳中蜕出来,表皮会裸露出来,暴露在紫外线下,刚蜕完壳的中华绒螯蟹背部呈黑色,这可能会有助于中华绒螯蟹吸收阳光产生维生素D3,有报道称不同的光照强度会影响中国对虾的生长[67]。Nvd的转录产物能将胆固醇转化成7-脱氢胆固醇,在维生素D 的合成过程发挥作用。Nvd的表达水平在一定程度反映了维生素D的合成水平,而甲壳动物获得维生素D 的途径除了自身合成,还有从食物中获取,Liu 等[39]发现由于维生素D 是一种脂溶性维生素,充足的脂肪摄入可以帮助机体吸收更多的维生素D,脂肪酶的活性在磷脂水平为1%~2%是下降的,这说明机体吸收的维生素D 会减少,为了满足蜕皮和生长所需,仔蟹需要合成更多的维生素D,因此Nvd的表达水平在磷脂水平为1%~2%有明显的提高。
4 结论
综上所述,饲料中添加1%磷脂显著提高了中华绒螯蟹仔蟹的生长和饲料转化率,2%磷脂显著提高了仔蟹肝胰腺维生素D 合成调控基因Nvd的表达量,而较高磷脂添加水平(3%~4%)显著降低了仔蟹肝胰腺中胰蛋白酶、纤维素酶和淀粉酶的活性。综合存活率和生长性能,中华绒螯蟹仔蟹饲料中磷脂的最适添加水平为1%。
