帝王大丽花初始外植体褐变影响因素及控制措施研究
2023-10-31韩胜男张映婵牛善策郝丽红向地英郑志兴陈段芬
韩胜男,王 璐,张映婵,梁 娟,牛善策,3,郝丽红,向地英,郑志兴,陈段芬
(1.河北农业大学 园艺学院,河北保定 071001;2.石家庄市植物园,石家庄 050073;3.河北农业大学 华北作物改良与调控国家重点实验室,河北保定 071001;4.张家口市农业科学院,河北张家口 075000)
帝王大丽花(Dahliaimperialis),又名树状大丽花,是菊科大丽花属多年生大型草本或半灌木植物,原产于墨西哥南部至哥伦比亚之间海拔1500~1700m的山地,是近年来新引入国内的珍稀大丽花种类。帝王大丽花株高可达5~6m,是大丽花属中最高大的种类;其地下部分为大型棒状块根;茎具四棱;节膨大;2~3回大型奇数羽状复叶对生[1];在晚秋至初冬季节开花,大量头状花序自茎端及叶腋伸出,花序直径可达7.5~15cm,舌状花颜色为淡紫色或粉紫色,管状花颜色为橙黄色。因此,帝王大丽花因其株型高大、花繁叶茂成为园林绿化不可多得的优良材料。
帝王大丽花目前通过扦插和分根繁殖,但其球根萌芽率低、分枝数量少、扦插生根慢,所以繁殖系数较低,难以满足市场需求。并且随着扦插、分根等繁殖代数的增加,品种退化问题也会逐渐显现[2]。针对上述问题,利用帝王大丽花各类器官或组织作为外植体,建立高效离体组培快繁体系,不仅能够加快帝王大丽花的繁殖速度,还能规模化生产优质种苗,同时也为帝王大丽花种质资源的离体保存提供技术支持。但是,在切取帝王大丽花茎段外植体时,切口处存在极其快速的褐变现象,即使在取材后快速地浸入水中,在之后的消毒过程中或外植体接种到培养基后仍然会出现严重的褐变问题,导致后续组培试验不能正常进行。目前大丽花属植物在组培快繁方面围绕愈伤组织诱导[3]、不定芽再生[4]、试管苗生根[5]、茎尖脱毒[6]等做了大量研究,但鲜见有外植体褐变问题的报道。因此,研究帝王大丽花外植体褐变原因及影响因素,可为帝王大丽花组培快繁提供理论和技术支持,对推动大丽花产业健康发展具有十分重要的现实意义。
1 材料与方法
1.1 试验材料
试验于2020年12月—2021年10月在河北农业大学西校区园艺学院进行。供试材料为栽植于河北农业大学东校区试验基地的1 a生帝王大丽花枝条,取样时腋芽处于刚萌发状态,挑选的枝条直径不超过1 cm,其长势一致、无病虫害、无机械损伤,取下后立即将基部切口浸入水中。
1.2 试验方法
外植体切割环境处理:将消毒处理后的不带芽茎段放在不同环境下进行切割,分别记为A:空气中切割;B:无菌水中切割;C:在1.0%的维生素C溶液中切割。
枝条水插处理:将离体枝条放在18 ℃的培养箱中进行不同时间的水插处理,期间每天定时换水,并及时剪掉枝条基部变色部分,分别记为S1:水插0 d;S2:水插2 d;S3:水插5 d;S4:水插7 d。
水插枝条低温处理:将水插处理5 d后的枝条放在 4 ℃冰箱进行不同时间的低温处理,分别记为W1:4 ℃处理0 h;W2:4 ℃处理5 h;W3: 4 ℃处理10 h;W4:4 ℃处理15 h;W5:4 ℃处理20 h;W6:4 ℃处理24 h。
接种后黑暗处理:用黑布将接种后的外植体遮盖,分别进行不同时间的黑暗处理,分别记为H1:暗培养0 d;H2:暗培养2 d;H3:暗培养7 d;H4:暗培养14 d。
接种后低温处理:将接种后的外植体放在 4 ℃的光照培养箱中进行不同时间的低温处理,同时在接种前7 d内进行黑暗处理,分别记为Wa:暗+4 ℃处理0 d;Wb:暗+4 ℃处理2 d;Wc:暗+4 ℃处理4 d;Wd:暗+4 ℃处理6 d,外植体在黑暗和温度处理后转组培室正常培养。
1.3 无菌外植体的获取与接种
2021年9月1日取样后,截取第2节位的带芽茎段和靠近第2节位上下部分1~2 cm的不带芽茎段均剪成3~4 cm的长度,于洗洁精溶液中搅拌清洗10 min后,放在流水下冲洗1 h,材料冲洗干净后放在超净工作台上进行消毒和接种。先采用75%酒精处理30 s,无菌水冲洗2次;再用质量分数为0.1%升汞处理6 min,无菌水冲洗5次,最后将冲洗干净的外植体浸泡在无菌水中待用。接种时用无菌手术刀切去切面与消毒剂接触的部分直至露出新鲜组织,按照形态学方向竖直接种到培养基中。初代培养时接种的培养基为启动培养基,培养基配方为:MS+2.0 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+6 g/L琼脂,pH为5.8。培养条件为:培养温度(25±2) ℃,光照周期16 h/d,光照度1 500~2 000 lx。每瓶分装培养基30 mL,接种1个外植体,每个处理接种30个外植体,重复3次。接种后每隔7 d观察外植体的褐变情况,培养周期为21 d或28 d。
1.4 测定指标及方法
用褐变指数表示外植体褐变的程度,将外植体的褐变程度分以下4级标准进行统计。褐变等级(L)=外植体褐变面积/外植体体积。0级:外植体外表鲜绿色,无褐变(L=0);1级:轻度褐变,外植体基本为绿色(L≤1/4);2级:褐变,外植体褐色(1/4
褐变指数=∑(褐变级数×该级株数)/(总株数×最高级数)×100%
污染率=污染的外植体数/接种的外植体 数×100%
多酚氧化酶(PPO)活力的测定采用儿茶酚法[7],单位为U/(g·min);苯丙氨酸解氨酶(PAL)活力的测定采用巯基乙醇法[8-9],单位为U/(g·h);总酚的测定采用福林酚试剂法[10],总酚含量单位为mg/g。
色度测定:使用CR410型色差计于室温下测定,得出L*值,分析不同取材部位纵切面的褐变程度(L*值为亮度指数,从0~100变化,L*=0表示黑色,L*=100表示白色,其值越大亮度越高,表面褐变越轻,反之褐变越严重)。
1.5 数据统计与分析
采用Microsoft Excel 2016对试验数据进行统计整理,用SPSS 20.0进行差异显著性分析。
2 结果与分析
2.1 枝条切口褐变的影响因素
2.1.1 枝条不同节位切口的褐变程度差异 将帝王大丽花不同节位切开后暴露在空气中,测定在不同时间点L*值,结果发现不同节位L*值随时间变化都呈下降趋势(图1),其中以顶芽、2节和3节下降的较多,分别下降2.11、1.74和 1.99,4节和5节下降的少,分别为0.92和0.79,说明帝王大丽花上端枝条比下端枝条褐变严重。
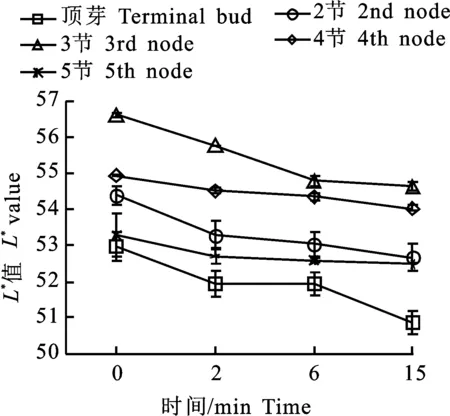
图1 枝条不同节位切口的褐变程度差异Fig.1 Difference in browning degree of different nodal incisions on branches
2.1.2 外界条件对枝条切口褐变的影响 空气暴露时间对枝条切口褐变的影响:将帝王大丽花枝条切开后暴露于空气中观察切口颜色变化,结果发现,切开后5 s枝条切口即发生轻微褐变, 2 min后切面全部变成浅褐色。随着切面在空气中暴露时间延长,褐变程度加重,由初期的浅褐色变为红褐色,30 min时全部变为黑褐色(图2)。
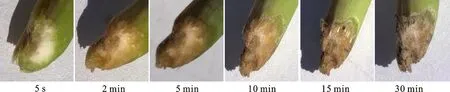
图2 帝王大丽花枝条切口在空气中暴露时间与褐变程度变化Fig.2 Exposure time and browning degree of branch incisions of D.imperial
浸水与浸水加氧处理对褐变的影响:分别选取帝王大丽花植株顶芽至第5节位的带芽茎段(从左到右),分别在浸水条件(图3-a)和浸水加氧条件下(图3-b)培养24 h后发现,两个处理的茎段上部幼嫩部分出现褐变的时间早于下部成熟部分,且枝条上端褐变程度高于下端褐变程度。其中,浸水处理除顶芽外其他茎段只有叶柄部位出现严重褐变,整体可以保持基本绿色,而浸水加氧处理的顶芽和茎段全部褐变死亡。综合比较5个节位的褐变程度,浸水加氧处理褐变比浸水处理更为严重(图3)。由此可以初步确定,外界氧气可以加剧帝王大丽花的褐变程度,其切口褐变的类型为酶促褐变。

图3 浸水(a)和浸水加氧(b)处理24 h后不同节位茎段褐变情况Fig.3 Browning of stem segments at different nodes after water insertting (a) and water insertting with oxygen(b) for 24 hours
不同温度下褐变程度差异:在不同季节取样后,5 min时观察帝王大丽花相同节位切面伤口的褐变程度,以7月份取样后伤口褐变严重(图4-a),颜色表现为黑褐色;12月份取样后切面出现轻微褐变(图4-b),相比7月份褐变程度显著降低,说明冬季较低的温度可能对褐变起到显著的抑制作用。

图4 7月(a)和12月(b)取样后切口的褐变情况Fig.4 Browning of incisions after sampling in July and December
2.2 枝条不同节位切口褐变程度与相关酶活性的相关性
帝王大丽花枝条不同节位PPO活性的测定结果见图5。从枝条形态学上端到形态学下端,不同节位中PPO活性呈逐渐下降的趋势。其中,顶芽与第2、3节的PPO活性均在812.30 U/(g·min)以上,差异不显著;第4节PPO活性为552.90 U/(g·min),与其上端或下端节位差异显著;第5节位PPO活性最低,为190.30 U/(g·min),与上端的所有节位差异显著。
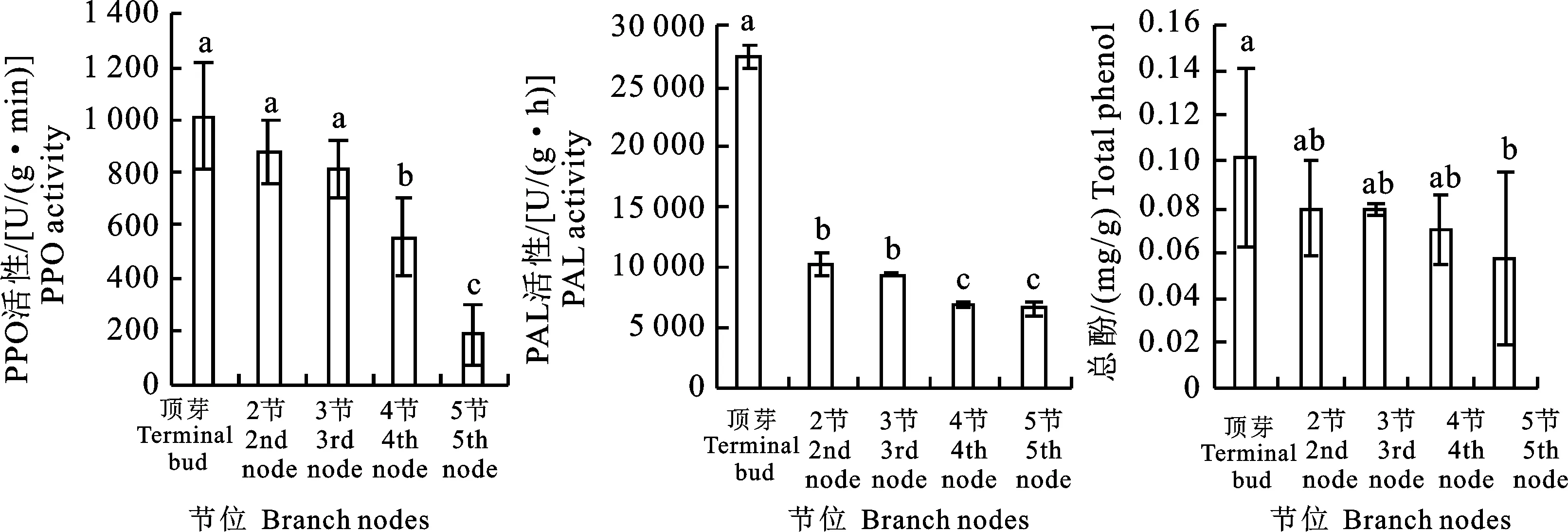
不同小写字母表示在P<0.05水平上差异性显著
帝王大丽花枝条不同节位PAL活性差异从枝条形态学上端到下端,PAL活性呈下降趋势,其中,顶芽PAL活性最高,与其下端部位之间具有显著性差异;第2节与第3节之间酶活性无显著差异,但与下端部位差异性显著;第4节与第5节之间的PAL活性无显著性差异。
帝王大丽花枝条不同节位总酚含量从枝条形态学上端到下端,总酚的含量呈下降趋势,其中,顶芽总酚含量最高,为0.10 mg/g,但与第2、3、4节之间无显著性差异;下端第5节位的总酚含量最低,仅有0.05 mg/g,与顶芽总酚含量差异显著。
2.3 不同处理措施对外植体褐变的影响
2.3.1 不同切割环境对外植体褐变的影响 由表1可知,不同处理的外植体均在接种后出现不同程度的褐变,其中,在1.0%维生素C溶液中切割(C)褐化程度最轻;虽然接种2 d时1.0%的维生素C溶液中切割(C)比正常切割(A)和在无菌水中切割(B)褐变指数高出15.25%和19.30%,但在接种14 d时,C处理比A、B褐变指数分别低4.86%和3.52%;到接种21 d时,与A、B相比,C处理褐变指数最低,且在整个培养期间,C处理褐变指数增长幅度最小,能够基本保持稳定状态,但A、B处理的褐变指数随着时间延长一直呈增长趋势。虽然B、C处理的外植体污染率比A处理分别高出25.93%和14.81%,但污染率在培养期间内并未对外植体褐变造成影响。
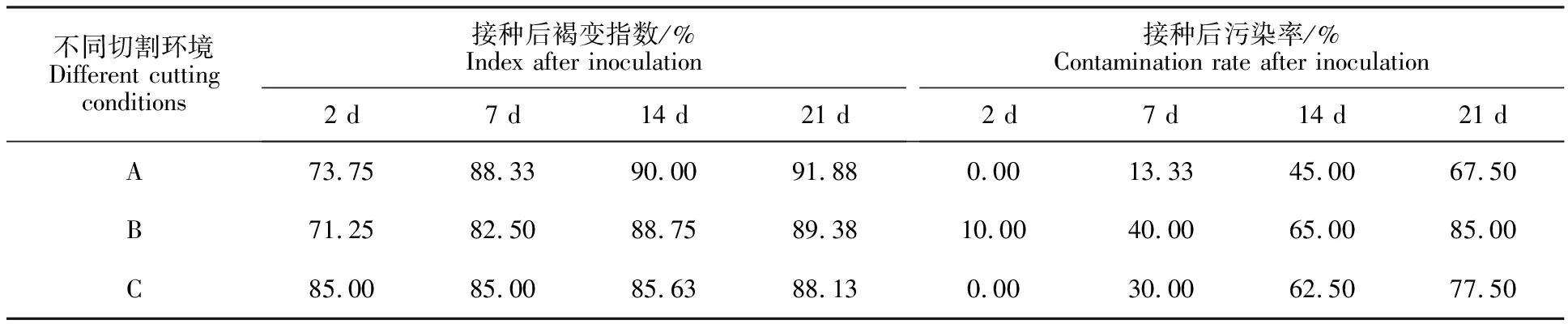
表1 接种时不同切割环境外植体褐变指数和污染率Table 1 Browning index and contamination rate of explants under different cut environments during inoculation
对接种到培养基的外植体进行观察发现:A处理后接种到培养基时,外植体会立刻发生严重褐变,褐变部分颜色逐渐加深,直至表面全部变成黑褐色,与培养基接触部分可见红褐色物质析出,且面积相对较大;B处理接种到培养基后,外植体褐变程度相比A稍有减轻,仅有少量红褐色物质析出,培养基红褐色面积较小;C处理后接种到培养基,外植体只出现轻微褐变,与培养基接触部分颜色正常,没有红褐色物质析出(图6)。

图6 A、B、C接种后正、底面褐变比较Fig.6 Comparison of browning on front and bottom surfaces of A,B and C after inoculation
2.3.2 水插和低温处理对外植体接种后褐变的影响 帝王大丽花枝条下部进行不同时间水插处理对外植体接种后褐变的影响见表2。随着培养时间的增加,所有处理的外植体在接种后褐变指数均呈现增加趋势。接种28 d时的统计结果表明,水插处理的外植体褐变指数均低于对照S1(未水插),其中以水插5 d(S3)和水插7 d(S4)处理效果好,与对照处理S1相比,褐变指数分别降低12.60%和12.45%,而水插2 d(S2)比对照S1褐变指数仅降低5.06%。所有接种的外植体污染率虽然保持在70.00%~81.82%,但并未对褐变程度造成影响(表2)。
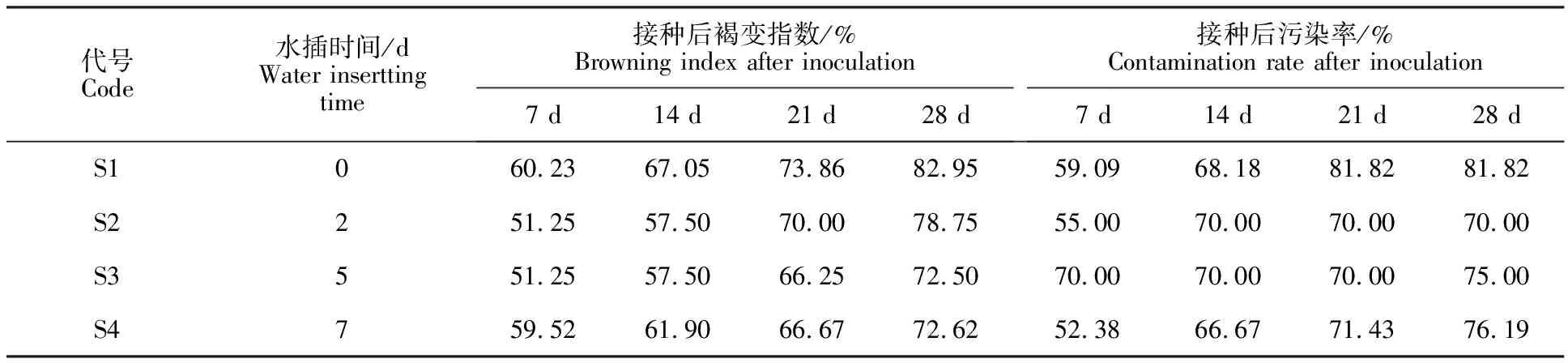
表2 不同的水插时间外植体褐变指数和污染率Table 2 Browning index and contamination rate of explants under different waterinserttingtime
接种21 d后,对照S1处理的带芽茎段褐变严重,颜色呈现黑褐色,其幼芽生长不正常,叶片蜷曲不能展开并伴有褐变;S2和S4处理后的带芽茎段,新长出来的幼芽状态较S1好,整体褐变程度也低;S3处理后效果最好,萌发的幼芽生长健壮,叶片浓绿,展开正常(图7)。

图7 接种21 d时不同水插时间处理外植体褐变及幼芽长势情况Fig.7 Browning of explants and bud growth at 21 days after inoculation with different water insertting time
水插5 d后4 ℃低温处理时间对外植体褐变的影响见表3。结果表明,将帝王大丽花枝条先放在18 ℃的培养箱中水插处理5 d,然后放在 4 ℃冰箱低温处理5 h后抑制褐变效果最好,相比处理W1外植体褐变指数降低5.17%,相比处理S1褐变指数降低17.12%,但是随着4 ℃低温处理时间的增加,褐变指数都快速升高,表现出比对照W1更明显的褐变。其中,4 ℃处理10 h(W3)和4 ℃处理15 h(W4)褐变指数分别为 91.00%和90.00%,4 ℃处理20 h(W5)和4 ℃处理24 h(W6)褐变指数分别为82.29%和 80.95%。污染率能够保持在80%以下,未对褐变指数造成影响(表3)。
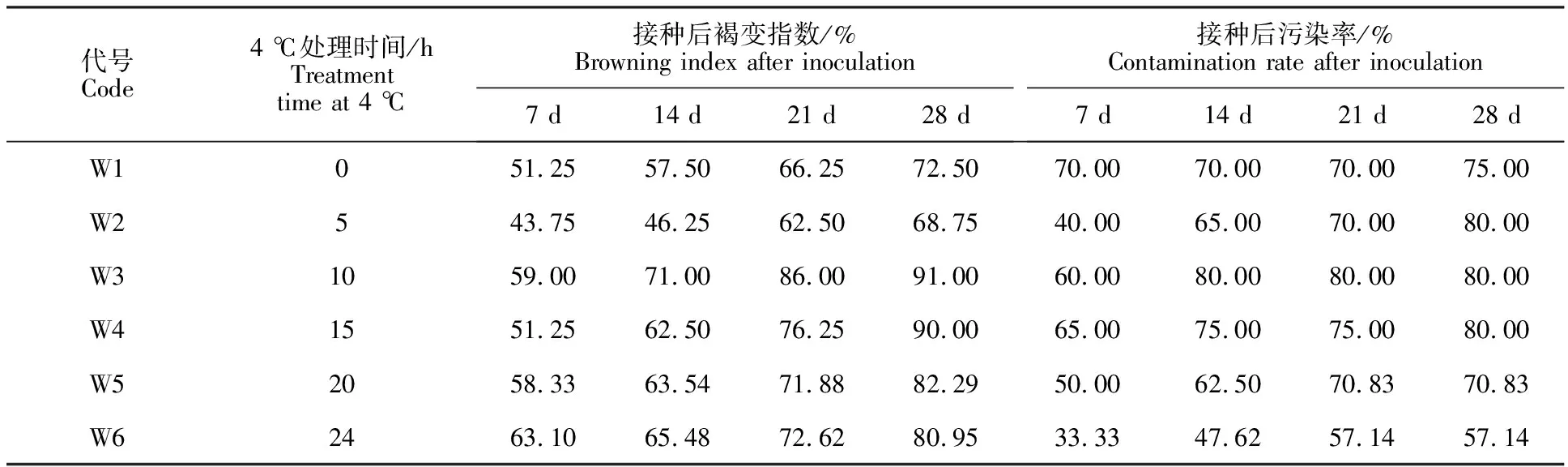
表3 外植体进行不同时间的低温预处理褐变指数和污染率Table 3 Browning index and contamination rate of explants after different time of low temperature pretreatment
培养21 d后比较不同处理下外植体的生长情况,W1和W2处理后的带芽茎段其萌发的幼芽能够正常生长,且不发生褐变。W3和W4处理后的带芽茎段在萌发的幼芽基部即发生褐变,并逐渐蔓延至全株;W5和W6处理后的带芽茎段其幼芽生长停滞,并伴有轻微褐变现象(图8)。
2.3.3 接种后暗处理和低温处理对外植体褐变的影响 接种后不同时间暗处理对外植体褐变的影响:由表4可知,随着暗培养时间增加,外植体褐变有减轻趋势。在不同时间节点对外植体褐变情况进行统计分析发现:暗培养0d(H1)和暗培养2 d(H2)随接种后培养时间变化褐变指数呈上升趋势。在接种21 d时,暗培养7 d(H3)和暗培养14 d(H4)褐变指数比对照H1分别降低 5.36%,H4在暗培养结束后转正常培养,其褐变指数能基本保持稳定。H2、H3的污染率高于H1、H2。
接种培养14 d时,对照暗培养0 d(H1)的外植体,其接触培养基部分随着培养时间的增加一直呈现红褐色,且面积较大;经过暗培养2 d(H2)的外植体,接触的培养基颜色为黑褐色;经过暗培养7 d(H3)和暗培养14 d(H4)的外植体,培养基颜色正常(图9)。
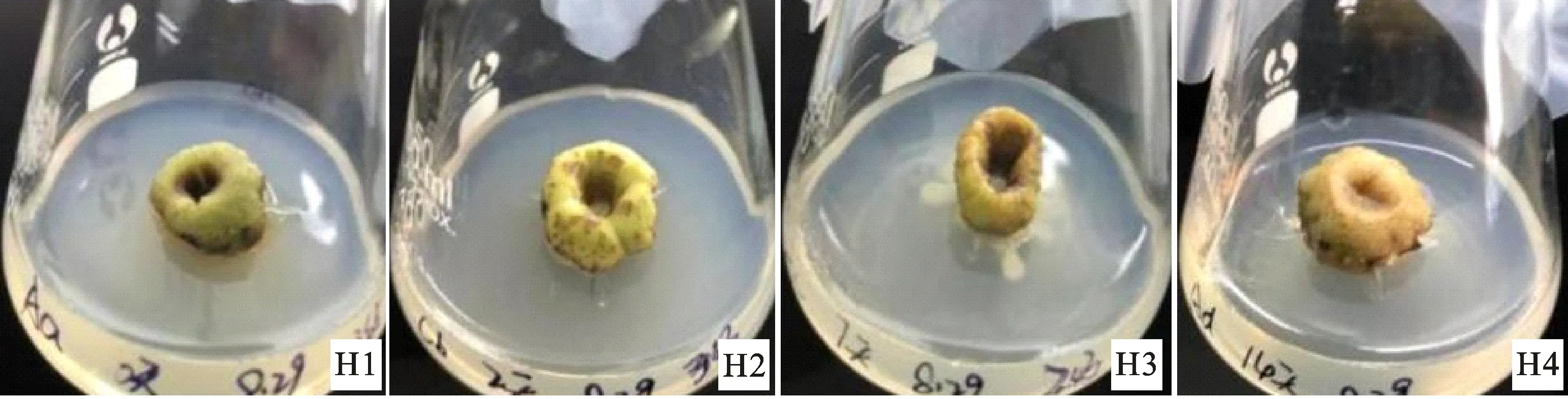
图9 接种14 d时不同时间黑暗处理的外植体情况Fig.9 Dark treatment of explants at different time at 14 days after inoculation
接种后暗处理+低温处理对外植体褐变的影响:接种后暗处理+不同时间4 ℃低温处理对外植体褐变的影响见表5。结果表明,在黑暗条件下,所有经过4 ℃低温处理的外植体在培养周期(28 d)内的褐变指数均呈现先增加后趋于稳定的变化趋势。暗处理+4 ℃ 0 d(Wa)和暗处理+ 4 ℃ 2 d(Wb)在培养14 d后褐变指数趋于稳定;暗处理+4 ℃ 4 d(Wc)在培养21 d后褐变指数趋于稳定;暗处理+4 ℃6 d(Wd)在培养21 d后褐变指数不再变化。相同时间节点获得的数据表明,暗处理+4 ℃6 d(Wd)的褐变指数均低于其他处理,效果最好。接种28 d时发现,Wd褐变指数比Wa低31.25%,比Wc低21.05%,比Wb低 18.42%。污染率数据表明,暗处理+4 ℃低温处理的时间越长,污染出现的时间越晚,所有处理在培养周期结束时(28 d)虽然全部污染,但污染未对外植体褐变程度产生影响。
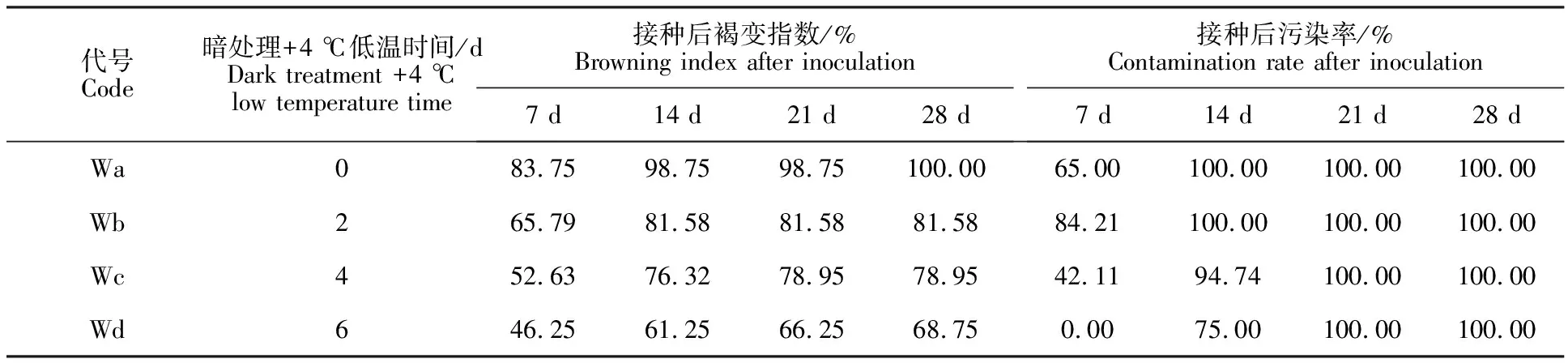
表5 接种后暗处理+4 ℃低温处理不同时间外植体褐变指数和污染率Table 5 Browning index and contamination rate of explants dark treatment under +4 ℃ low temperature treatment time after inoculation
研究发现,接种6 d时,外植体褐变情况以Wa褐变程度最严重,外植体几乎全部变褐,Wb相比对照Wa褐变程度较轻,颜色较浅,Wc和Wd的效果最好,褐变程度最浅,此时所有带芽茎段均未出芽(图10);接种28 d时观察,Wa处理下的带芽茎段褐变死亡,幼芽始终处于萌发状态而不生长,Wb和Wc处理下的外植体幼芽萌发生长,叶片呈现黄绿色,Wd处理下的外植体幼芽萌发生长,并且叶片浓绿,展开正常,长势健壮 (图11)。

图11 接种28 d时暗处理+4 ℃处理不同时间外植体褐变及幼芽长势Fig.11 Browning and bud growth of explants at 28 days after dark treatment of +4 ℃ low temperature at different time
3 讨 论
褐变按其发生机理分为酶促褐变和非酶促褐变两大类[11]。新鲜的植物组织受到损伤时多发生酶促褐变,即由于细胞膜结构破坏,组织中多酚氧化酶被激活,酚类化合物被氧化形成褐色的醌类物质,在酪氨酸酶作用下,与植物组织中的蛋白发生聚合,从而抑制很多代谢酶的活性,导致代谢紊乱,生长受阻,最终致使材料逐渐变褐死亡[12]。引起酶促褐变的因素主要是氧、底物、酶等。本研究中,针对帝王大丽花枝条取材时切口严重褐化问题,比较枝条不同节位褐变程度的差异,探究枝条水插和低温预处理对褐变的影响,并对接种后的外植体进行黑暗和低温处理来减轻褐变的发生。
不同取材部位对外植体的褐变程度有着重要影响[13]。程世平等[14]研究不同取材类型对黄连木茎段褐化的影响时发现,外植体木质化程度与褐化程度以及腋芽的诱导发生密切相关,其中半木质化的茎段褐化率相对较低,幼嫩茎段褐变严重。本试验中也得出与上述一致的结论。帝王大丽花从枝条上端到下端木质化程度变化明显,取样时发现上端幼嫩部分比下部成熟部分褐变更严重。通过测定自上而下5个节位的PPO活性、PAL活性和总酚含量,结合不同节位茎段切口的褐变程度,结果发现上端幼嫩部分PPO活性、PAL活性和总酚含量明显高于下端老熟部分,这种变化趋势与枝条自上而下的褐变减轻相伴随,说明幼嫩组织中PAL活性较高,导致PAL诱导产生的酚类物质较多,而幼嫩组织中诱导酚类物质氧化形成醌类物质的关键酶PPO活性较高,从而导致醌类物质在幼嫩组织中的增加而出现组织褐变。随着取样部位从幼嫩到老熟的变化,木质化程度越高的老熟部位中PAL活性、PPO活性和总酚物质含量的降低,因此褐变现象减轻。
外植体切割环境对帝王大丽花外植体的褐变程度有明显影响。王仁睿等[15]将蝴蝶兰茎尖放在1%维生素C溶液切割,再接种到添加0.2%PVP的培养基上,防止蝴蝶兰茎尖褐化效果显著。本研究在培养周期结束后,相比于空气中切割外植体(A),无菌水中切割(B)和在1%的维生素C溶液中切割(C)对于减轻褐变都有效果,但以在1%的维生素C溶液中切割效果最好。B处理比A处理效果略好,但仅比A降低2.72%,原因是在水中切割时减少了材料与空气之间的暴露时间,减少了酶促反应的发生[16],但在接种时外植体不可避免地又会接触空气,所以效果并不理想;C处理在接种到培养基2 d后,褐变指数能够基本保持稳定,原因考虑植物组织在遭到机械破坏时,其体内的多酚氧化酶会增多以保护自身,而维生素C并不能抑制多酚氧化酶活性[17],因此在接种后褐变指数快速上升,但是维生素C具有还原性,能将褐变产生的有色物质邻二醌还原成无色物质邻二酚[18],从而起到抑制褐变加剧的效果。
接种后进行暗处理能有效防止褐化现象的发生[19]。余慧琳等[20]研究表明,适当的暗培养有利于减轻外植体的褐变,当外植体暗培养1周后再转入光下正常培养,比接种后直接放在光下培养外植体发生褐变的程度要轻,并且发生褐变的时间会推迟。王宝宁等[21]对春兰花梗外植体进行暗培养10 d后完全褐化率相对较低,但在培养后期完全褐化率比暗培养5 d快速升高,这与本试验暗处理的结果相似,即相对较长的暗培养时间有利于降低褐化率,其中以黑暗处理7 d(H3)褐变指数最低;虽然暗处理14 d后(H4)的褐变指数和H3的相同,但H4茎段愈伤表现颜色比H3颜色深;在正常情况下,帝王大丽花外植体培养到第2天褐变指数就达到82.50%,而通过黑暗处理,第7 天后褐变指数才达到83.33%,黑暗处理后褐化现象明显延迟,但随着时间增加褐化现象也随即产生,说明黑暗处理只是在短时间内抑制了褐化物质的产生。暗培养对外植体褐化起到了一定的抑制作用,可能是外植体在黑暗中减少了酚类物质的渗出,从而降低了褐变率[22-23],因为在酚类化合物合成和氧化过程中,需要许多酶系统参与,其中一部分酶系统的活性是受光诱导的[24],因此在前期暗培养时褐变会受到一定程度的抑制。
低温处理可在不同程度上降低植物材料的褐变率[25]。张卫芳等[26]将核桃茎尖接种到培养基后,置于5 ℃冰箱中黑暗培养7 d后取出,置于 25 ℃无光照下培养,褐化率有所降低;李焕秀等[27]将采集的苍溪梨外植体进行低温预处理对降低褐变有一定作用。本试验结果表明,无论是在取样后对帝王大丽花枝条进行低温处理,还是对接种后的外植体进行低温处理,均可明显降低褐变率,原因可能是低温抑制了酚类化合物的合成,抑制了多酚氧化酶的活性,减少了酚类氧化,从而使褐变减轻[28]。
本试验发现,取样时间、取样位置、外植体切割环境以及接种前后材料的低温和黑暗处理对帝王大丽花的褐变率均可产生不同影响,所采取的措施也一定程度上控制了褐变的发展,并获得了部分不褐变的瓶苗,但是,探索更加有效的防止褐变的措施组合仍然很有必要,而且不同因素对褐变的影响机理以及各因素间的交互影响仍有待深入研究。此外,试验获得的无菌瓶苗经过后期继代培养,并未再次出现褐变情况,其中原因尚待继续研究。
