复合改性污泥生物炭对Mn2+的吸附研究
2023-10-31鲍福星岳正波高义军王绍平吴文涛
鲍福星, 岳正波, 高义军, 王绍平, 揣 新, 吴文涛
(1.合肥工业大学 资源与环境工程学院,安徽 合肥 230009; 2.纳米矿物与污染控制安徽普通高校重点实验室,安徽 合肥 230009; 3.安徽马钢矿业资源集团南山矿业有限责任公司,安徽 马鞍山 243000)
锰(Mn2+)是人体所需微量元素之一,但当水体中的Mn2+质量浓度超过0.1 mg/L时,不仅会使水体产生异味,还会对人类神经系统造成损伤,导致智力障碍[1]。氧化法、沉淀法、生物法、吸附法是目前去除废水中Mn2+的主要方法[2]。其中,吸附法具有操作简便、成本低、污泥产量少、再生能力强等优点,是治理Mn2+污染的一种有效技术[1]。沸石、黏土矿物、纳米颗粒、聚合物等吸附剂已广泛用于Mn2+去除工艺[1,3],但这些吸附剂存在吸附效率低、选择性低、制备过程复杂等缺点。因此,寻找低成本、来源广、适用性强、吸附效率高的Mn2+吸附剂是目前相关研究的焦点。
截至2020年,我国污泥产生量达(6 000~9 000)×104t[4]。热解是处置污泥的一种有效技术,可以根除病原菌,还可得到大量的生物炭吸附材料,并且高温热解后污泥中的重金属会得到进一步稳定,有效降低原始污泥重金属环境风险[4-5]。
原始污泥生物炭(sludge biochar,SB)的比表面积低、表面官能团较少,对重金属离子的吸附能力较差[6],因此需要进行改性处理。在物理改性方法中,采用CO2改性得到的生物炭具有更高的比表面积[7]。化学改性方法主要有酸处理、碱处理、氧化、硫化、金属掺杂[6]等,其中KOH改性SB的比表面积更高,其表面负电荷和官能团数量也显著增加[8-9]。文献[10-11]研究表明,与单一改性方法相比,采用物理改性与化学改性联用的复合改性方法时,所制备的生物炭吸附性能更佳。
本研究以城市污水处理厂污泥为生物质,使用复合改性方法(即CO2物理改性与KOH化学改性联用)制备SB,以期制备适用性广、吸附性能高的SB吸附剂,并进一步研究其处理含Mn2+废水的吸附特性与主要作用机制。
1 实验材料与分析方法
1.1 材料与试剂
污泥从安徽省合肥市某污水处理厂取得,含水量为80%,将其置于105 ℃烘箱中烘至恒质量,经破碎机破碎后过200目筛,装入样品袋中标记备用。Mn2+溶液使用硫酸锰(MnSO4·H2O)(分析纯,天津市致远化学试剂有限公司)制备。KOH试剂为分析纯,购自上海阿拉丁生化科技股份有限公司。
1.2 SB材料的制备
1) CO2物理改性。首先称取5 g干燥后的SB,放入瓷舟并置于管式炉中,以CO2为载气,流量为200 mL/min,在升温速率5 ℃/min、热解温度550 ℃、停留时间1 h的条件下进行热解,并在CO2气氛下冷却至室温,得到CO2物理改性污泥生物炭(CO2-sludge biochar,CSB)。
2) KOH化学改性。将制取的1 g CSB浸入10 mL 3 mol/L KOH溶液中,并在摇床中反应24 h(室温,120 r/min),然后过滤分离,使用离子水清洗固体残留物至上清液为中性。将样品放入恒温鼓风干燥箱(60 ℃)烘干,研磨后过200目筛,得到粉末状的复合改性污泥生物炭(composite modified sludge biochar,CMSB)。吸附Mn2+后的CMSB表示为CMSB-Mn。
1.3 实验设计与分析
使用Design Expert 软件(8.0.4 版,美国Stat-Ease,Inc.公司)在响应面法 (response surface methodology,RSM) 下应用 Box-Behnken 模型进行实验设计,考察pH值(取值为4、6、8)、吸附剂CMSB投加量(取值为1.0、1.5、2.0 g/L)和初始Mn2+质量浓度(取值为25、50、75 mg/L)对Mn2+吸附量的影响。按照设计方案,在250 mL锥形瓶中将一定量的CMSB投入Mn2+溶液,然后在25 ℃以120 r/min机械摇动10 h。吸附后,通过0.45 μm微孔过滤器过滤后测试剩余的Mn2+质量浓度。Mn2+吸附量Q、去除率R的计算公式为:
Q=[(ρ0-ρe)V]/m
(1)
R=[(ρ0-ρe)/ρ0]×100%
(2)
其中:ρ0为吸附前溶液中Mn2+质量浓度,即Mn2+初始质量浓度;ρe为吸附后溶液中Mn2+质量浓度;V为溶液体积;m为吸附剂CMSB的质量。
动力学数据采用准一级动力学模型和准二级动力学模型描述[12];吸附等温线数据采用Langmuir模型和 Freundlich模型拟合[13-14];使用 van’t Hoff 方程研究热力学特性[15]。
1.4 分析方法
SB和CSB样品依据美国环境保护署 3050B方法[16]消解后,使用Agilent 7500cx电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometer,ICP-MS)(美国安捷伦科技公司)检测样品中Mn、Zn、Cr、Pb、Ni、Cu、As的质量比。使用ESCALAB 250 Xi 型X射线光电子能谱仪(美国赛默飞世尔科技公司)进行X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)分析,测定CMSB和CMSB-Mn的元素类型和价态分布。使用D/MAX-2500型X射线衍射仪(日本理学株式会社)进行X射线衍射(X-ray diffraction,XRD)分析,测定CMSB、CMSB-Mn表面的结晶物。采用Nicolet 6700傅里叶变换红外光谱仪(美国赛默飞世尔科技公司)进行傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析,对CSB、CMSB、CMSB-Mn的表面官能团组成进行定性测定。使用SU8020场发射扫描电子显微镜(field emission scanning electron microscope,FESEM)(日立公司)观察样品形貌。使用Zeta电位计测量CMSB的表面电位。采用Autosorb-iQ3比表面积及孔径分析仪(美国康塔仪器公司)测量CSB和CMSB孔结构和比表面积。采用Agilent 7500cx ICP-MS检测吸附过程中析出的阳离子K+、Na+、Mg2+、Ca2+。
采用高碘酸钾分光光度法[17],用722N可见分光光度计(上海佑科仪器仪表有限公司)检测Mn2+质量浓度。所有吸附实验均为3个重复,以无吸附剂作为对照组。所得数据使用Origin Pro 8.0进行分析。
2 实验结果与讨论
2.1 重金属质量比变化
污泥热解前后的重金属质量比变化见表1所列。由表1可知,热解后的CSB中各重金属质量比均高于SB,这主要是由于在550 ℃时污泥中有机物减少的质量远大于其中重金属减少的质量,从而使CSB中富集大量重金属[18]。但CSB中的重金属质量比均符合文献[19]中A级污泥标准,而且高温热解后污泥中的重金属会得到进一步的稳定,不存在析出风险[4]。
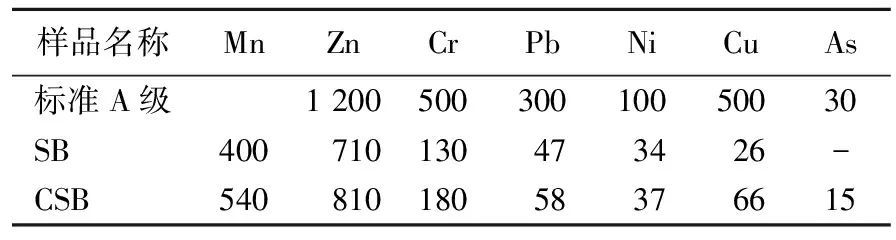
表1 污泥热解前后的重金属质量比变化 单位:mg/kg
2.2 材料的表征
CSB、CMSB的BET比表面积和孔隙特性见表2所列。

表2 CSB、CMSB的BET比表面积和孔隙特性
CSB、CMSB的比表面积分别为56.77、171.46 m2/g,经过KOH改性后比表面积和孔容都增加3倍以上,形成的孔隙主要为中孔(2~50 nm),而中孔在吸附过程中起着至关重要的作用[20]。
CSB、CMSB的FTIR谱图和FESEM图像如图1所示。

图1 CSB、CMSB的FTIR谱图和FESEM图像
由图1a可知:3 349、1 608 cm-1吸收峰分别对应于—OH、C=C或C=O吸收振动峰[21];1 461 cm1处峰是由于 CO32-或—COOH的伸缩振动[14];1 365 cm-1处峰是由于—CH的伸缩振动;998 cm-1处观察到非常强的吸收峰,表明存在Si—O—Si或Si—O—C键[1];875 cm-1处峰归因于芳烃的C—H弯曲振动[3]。通过KOH的活化,出现一系列新的吸收峰,如—OH、CO32-或—COOH,而C=C或C=O的吸收峰也有所增强,说明KOH碱处理改性可以增加CMSB的含氧官能团数量[3];芳烃C—H吸收峰的出现说明KOH碱处理增加了CMSB的芳香官能团数量[20];而Si—O—Si或Si—O—C吸收峰有所减弱,这是由于KOH碱处理的脱矿作用[20]。由图1b、图1c可知,CSB具有相对平坦的表面结构,而经过KOH处理的CMSB具有较好的多孔结构,表面有大量的孔和坑,可以提供更多的吸附位点。
2.3 Box-Behnken设计与统计分析
采用RSM的Box-Behnken模型设计来实现一个由12次实验加5个中心点组成的二次模型。CMSB对Mn2+的吸附量实验值Box-Behnken设计方案见表3所列。

表3 Box-Behnken设计方案及结果
通过Box-Behnken设计和输入变量得到预测最佳点的二次方程,然后根据CMSB的实验结果,得出响应值(吸附量Q)与3个自变量 (因素A为pH值、因素B为CMSB投加量、因素C为Mn2+初始质量浓度ρ0)之间的关系为:
Q=34.02+1.46A-7.98B+9.65C-
1.82AB+1.09AC+0.51BC-
1.57A2+0.686 9B2-4.76C2
(3)
为了讨论基于RSM分析建立的回归模型是否接近真实的函数关系,需对模型进行方差分析和显著性检验。通常模型的F值越大、P值越小表示模型越显著,而失拟项不显著(P>0.05)则表示该模型在整个回归区域内能实现较好的拟合分析[9]。基于RSM的吸附量模型方差分析结果见表4所列。由表4可知,响应值拟合得到的回归模型具有高度的显著性(P<0.000 1),且均未出现失拟现象(P>0.05),这表明本文实验条件下得到的回归方程能较好地反映吸附过程中3种影响因素对CMSB吸附能力的影响。P<0.05表示模型项显著,因此,A、B、C、AB、A2、C2是重要的模型项。
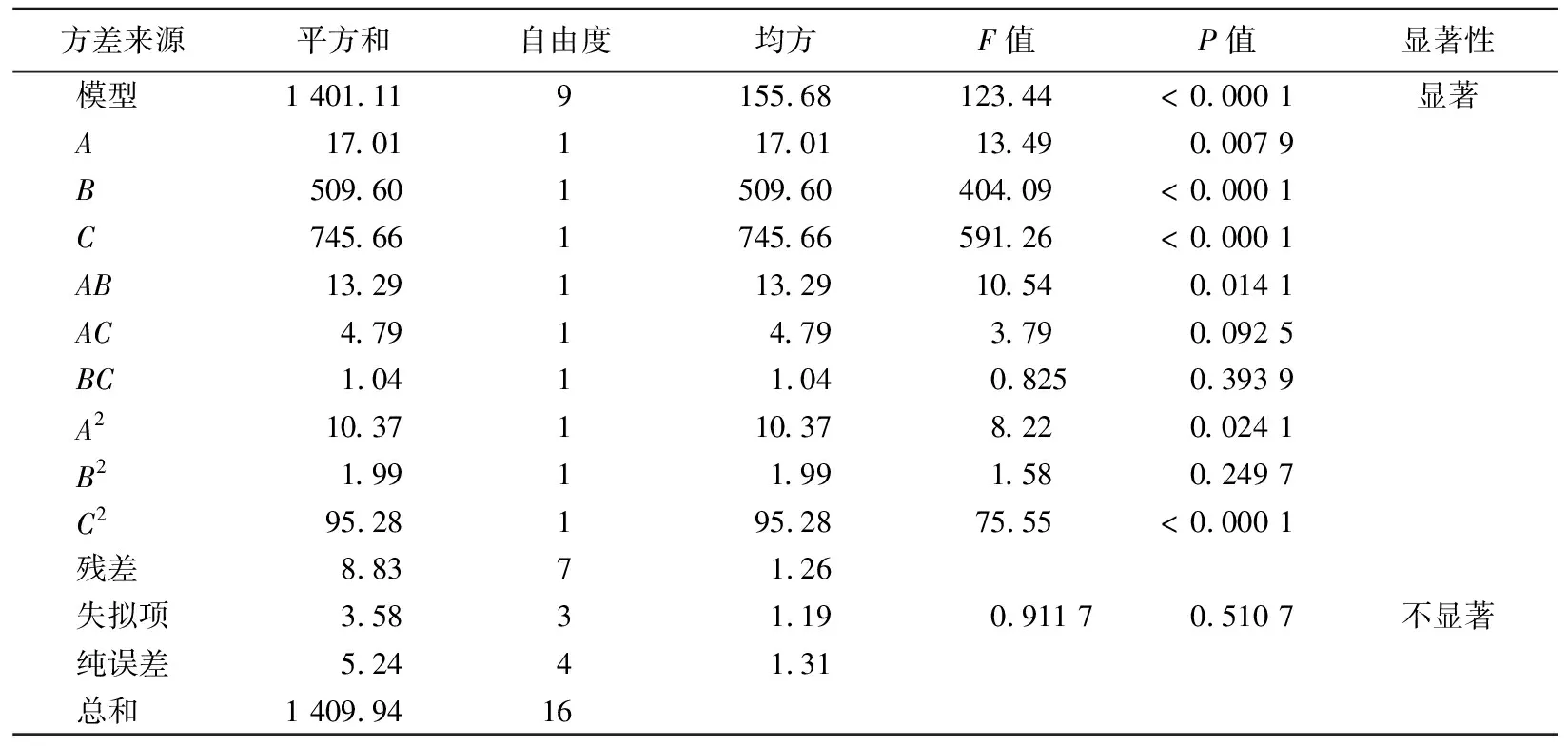
表4 基于RSM的吸附量模型方差分析结果
不同pH值和CMSB投加量下的Q三维响应面图如图2所示。
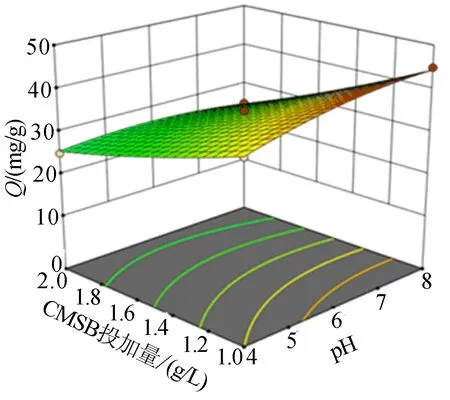
图2 不同pH值和CMSB投加量下的Q三维响应面图
从图2可以看出,在pH=4、CMSB投加量为1.0 g/L的条件下,CMSB对Mn2+的吸附量为37.63 mg/g,去除率为75.26%。CMSB在低pH值条件下依然保持优异的吸附性能,表明CMSB具有很强的适用性和实际应用性。
当CMSB投加量为1.0 g/L时,对Mn2+的吸附量最大,而随着投加量增加,吸附量逐渐减小,说明在较小的投加量下,CMSB可以完成对Mn2+的高效吸附,即CMSB用于含Mn2+废水的处理是经济有效的。但值得注意的是,只有在pH=6、CMSB投加量为1.5 g/L时,CMSB对Mn2+的去除率才能达到100%,此时吸附量为35.00 mg/g。
2.4 吸附动力学分析
2种动力学模型拟合曲线如图3所示。图3中,Qe为平衡吸附量。
图3 2种动力学模型拟合曲线
2种动力学模型拟合参数取值见表5所列。表5中,R2为拟合优度。由表5可知:准二级动力学模型拟合Mn2+吸附动力学数据(R2=0.99);准一级动力学模型(R2=0.96),准二级动力学模型拟合的最大吸附量为34.70 mg/g,与实验吸附量35.00 mg/g较为接近。由此可知,CMSB对Mn2+的吸附为化学吸附,Mn2+与CMSB发生电子共享或电子转移[12]。

表5 2种动力学模型拟合参数取值
2.5 吸附等温线分析
Langmuir模型、Freundlich模型等温线拟合图如图4所示,2种模型拟合的吸附常数见表6所列。

图4 Langmuir模型、Freundlich模型等温线拟合图

表6 Langmuir模型、Freundlich模型吸附等温线拟合数据
与Freundlich模型的拟合效果相比,Langmuir模型拟合数据较好,在298、308、318 K的情况下,R2都大于0.99,表明CMSB对Mn2+吸附是单层的[12]。
随着温度升高,CMSB对Mn2+的吸附量也逐渐提高,说明对Mn2+的吸附过程是吸热的。当RL值在0~1之间时,吸附过程是有利的,当RL>1时,吸附过程是不利的[13]。在本研究中,RL值均在0~1范围内,表明CMSB对溶液中Mn2+的吸附效果较好。
2.6 热力学分析
将lnK与1/T拟合绘制线性曲线(K为无量纲平衡常数),结果如图5所示,拟合得到的线性曲线斜率为吸附焓ΔH,截距为吸附熵ΔS。
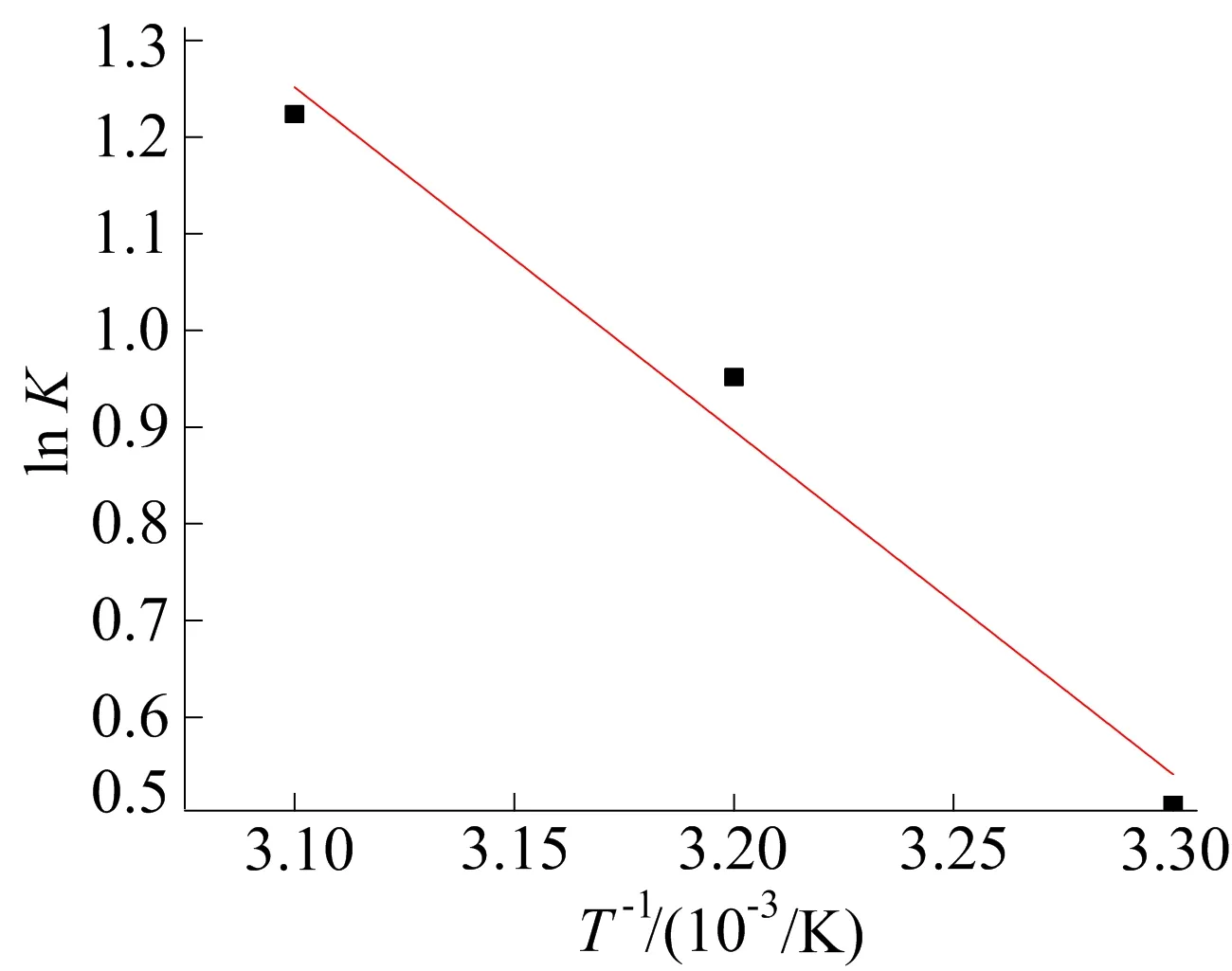
图5 热力学拟合曲线
通过线性回归计算,得到热力学参数吉布斯自由能ΔG以及ΔH、ΔS,见表7所列。由表7可知,ΔG<0、ΔH>0、ΔS>0,此结果表明CMSB对Mn2+的吸附是自发、吸热和熵增的。随着温度升高,|ΔG|增大,表明在高温环境下吸附变得更加自发。ΔS>0,表明Mn2+在CMSB表面吸附时,固液系统的无序程度增加[15]。
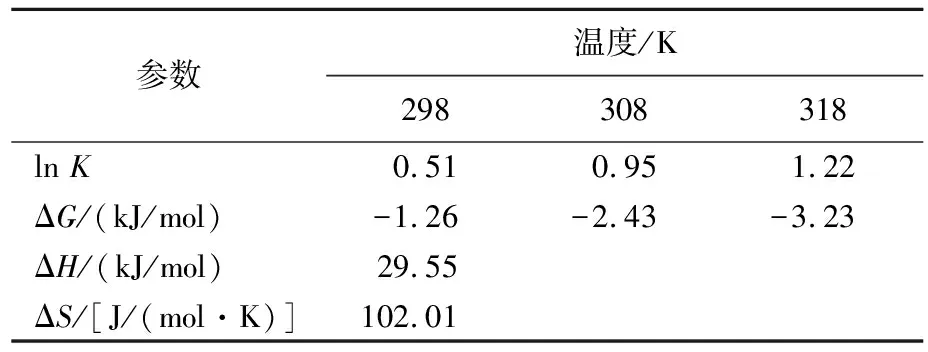
表7 热力学分析拟合参数取值
2.7 吸附机制分析
CMSB、CMSB-Mn的FTIR谱图和XPS谱图如图6所示。由图6a可知:吸附Mn2+后,—COOH(1 461 cm-1)峰消失,说明含氧官能团,尤其是—COOH参与反应,即含氧官能团与Mn2+之间发生表面络合作用;芳烃的C—H弯曲振动吸收峰(875 cm-1)消失,C=C的振动峰也明显发生了变化,由CMSB 的1 608 cm-1处偏移到1 590 cm-1处。这些结果证实了Mn2+-π键作用对Mn2+吸附过程的影响[22]。

图6 CMSB、CMSB-Mn的FTIR谱图和XPS谱图
为进一步探究CMSB对Mn2+的吸附机理,采用XPS分析吸附前后CMSB表面化学特征变化。由图6b可知,CMSB的高分辨率C1s XPS光谱可以分为3个子峰,分别代表C—C(284.80 eV)、C—O(285.80 eV)、C=O(288.98 eV)[8],峰形比例分别为56.54%、30.72%、12.73%。
从图6c可以看出,吸附Mn2+后,CMSB-Mn的C—O、C=O峰值位置分别移至286.05、288.33 eV,C—O、C=O峰形比例也分别降至19.35%、8.96%,这进一步说明C—O、C=O等含氧官能团与Mn2+发生化学相互作用[15]。
由图6d可知,吸附Mn2+后,CMSB-Mn的Mn 2p光谱被分为4个峰,包括 653.52 eV 处的 Mn 2p1/2、642.01 eV 处的 Mn 2p3/2及646.10、 657.10 eV 处的卫星峰,Mn 2p1/2与Mn 2p3/2之间约12.00 eV的能量差和卫星峰的出现表明,Mn在吸附后以二价离子的形式存在[3]。
CMSB、CMSB-Mn的XRD分析结果和CMSB-Mn的FESEM图像如图7所示。

图7 CMSB、CMSB-Mn的XRD分析结果和CMSB-Mn的FESEM图像
由图7a可知,吸附前后XRD谱图相似,在2θ为20.83°(100)、26.59°(101)、36.49°(110)、50.05°(112)、59.86°(211)、68.20°(301)处的衍射峰均为SiO2(PDF#83-0539)特征峰,没有检测到新的物相,表明Mn2+吸附不是由于沉淀,而是通过在CMSB表面形成复合物而被去除。
由图7b可知,吸附Mn2+后的CMSB-Mn表面可以观察到大量的片状物,这些片状物可能是CMSB与Mn2+形成的络合物[23]。结合FTIR谱图和XPS谱图分析可知,吸附后形成了—COOMn+。
CMSB的零电荷点(point of zero charge,PZC)和阳离子释放结果如图8所示。由图8a可知,CMSB的PZC是在pH=2.89,因此,当溶液pH<2.89时,CMSB表面带正电荷,当pH>2.89时,CMSB的表面电荷变为负电荷,这是由于羟基离子(OH-)和氢离子的去质子化,增强了与带正电荷的Mn2+溶液的静电相互作用[24]。
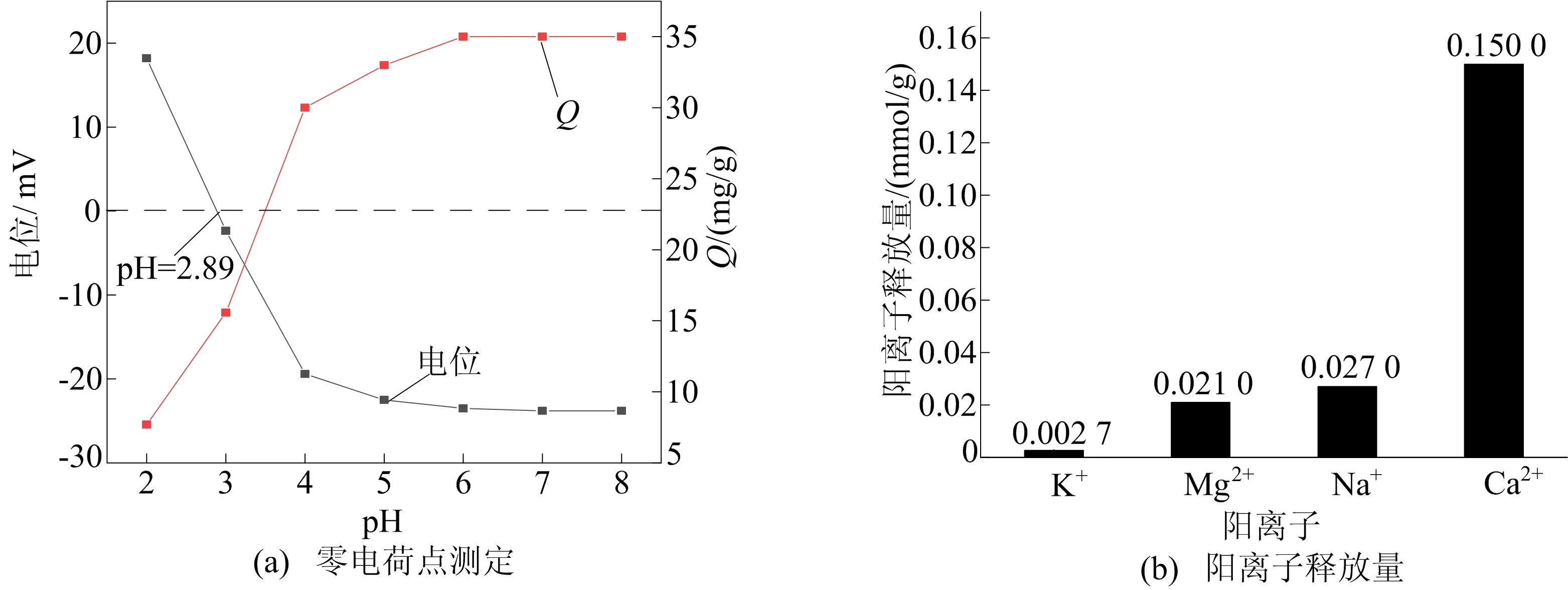
图8 CMSB的零电荷点测定结果和阳离子释放结果
由图8b可知,K+、Na+、Mg2+、Ca2+呈现净释放量。K+和Na+不能与CMSB表面的官能团配位或形成沉淀物,因此其释放量应与Mn2+的静电离子交换有关;Ca2+、Mg2+的释放是由于表面官能团在吸附过程中的溶解或解离[25]。其中Ca2+净释放量达到0.150 0 mmol/g,溶液中Mn2+与吸附剂CMSB表面Ca2+发生的离子交换可以模拟[26]为≡Ca+Mn2+→≡Mn+Ca2+。
综上所述,CMSB对Mn2+的吸附机制如下:① 含氧官能团,尤其是—COOH与Mn2+之间发生表面络合作用,形成了—COOMn+;② 芳烃C—H或C=C与Mn2+形成Mn2+-π键;③ 带负电荷的CMSB与阳离子Mn2+的静电吸引作用;④ K+、Na+、Mg2+、Ca2+等阳离子与Mn2+离子交换作用。
2.8 经济性分析
生物炭生产系统的经济可行性在很大程度上取决于原料、生产成本和产生价值。由于污泥属于废弃物,有关污泥经济性的研究中通常将其价格视为0;并且从城市污水厂获得污泥还可以获得政府补贴费用[27],通常为95 元/t,与成本为200~250元/t的秸秆等农林废弃物相比[28],原料成本大幅减少。参照文献[29]的计算方法,在实验室条件下,制备1 kg CMSB的生产成本中,干燥费用为7.04元,水费为0.009 75元,破碎费用为0.117元,CO2费用为3.96元,热解费用为5.04元,KOH费用为50.4元,总计约为66.57元;如果使用工业规模的KOH(3.00元/kg),KOH费用仅为5.04元,那么总价约为21.21元。与成本为32.50~39.00元/kg的商业活性炭相比[30],CMSB是一种潜在的高性价比吸附剂,可以合理地用于处理含Mn2+废水。
3 结 论
本文以城市污水处理厂污泥为原料,对其采用CO2气氛热解物理改性和KOH化学改性的联合改性方法进行处理,成功制备一种经济且高效的复合改性污泥生物炭(CMSB)。复合改性不仅可以改善SB的比表面积和孔隙结构,还可增加其表面含氧官能团数量。使用 Box-Behnken 模型进行实验设计,发现CMSB在pH=4、投加量为1.0 g/L时,对Mn2+的吸附量可达37.63 mg/g。Mn2+在CMSB上的吸附行为可以用准二级动力学模型和Langmuir等温线模型很好地进行拟合,热力学分析结果表明吸附过程是自发、吸热、熵增的。CMSB对Mn2+的吸附机制为含氧官能团的络合作用形成—COOMn+、π键作用、静电吸引作用、离子交换作用。
