26例儿童发热感染相关性癫痫综合征的脑电图分析
2023-10-31张伊丁昌红李华王晓慧陈春红方方
张伊 丁昌红 李华 王晓慧 陈春红 方方
(国家儿童医学中心/首都医科大学附属北京儿童医院神经中心神经内科,北京 100045)
发热感染相关性癫痫综合征(febrile infectionrelated epilepsy syndrome, FIRES)是近年来逐渐被认识的一种严重的癫痫性脑病,治疗困难,病死率高,幸存者多遗留药物难治性癫痫和严重的认知功能障碍[1]。本病病因不明,部分学者推测可能与炎性介导及免疫反应相关[2-4]。Serino等[5]研究表明,FIRES发病为多因素共同作用,全身感染是“神经炎症级联反应”的触发因素,最终形成难治性癫痫的恶性循环。本病的癫痫发作呈暴发性,临床过程分为急性期和慢性期。在急性期早期引入大麻二酚、人重组白细胞介素-1受体拮抗剂或生酮饮食治疗可能减轻癫痫持续状态的程度及持续时间[6]。迄今为止,国内外大都是关于FIRES急性期的脑电图研究[7-9],缺乏不同病程时期脑电图的系统性研究。现分析北京儿童医院收治的26例FIRES患儿的临床及脑电图资料,探讨其急性期、慢性期脑电图特征及动态演变,有助于临床诊治。
1 资料与方法
1.1 研究对象
26例患儿均为2017年5月—2021年12月首都医科大学附属北京儿童医院神经内科收治的、明确诊断为FIRES的患儿。全部患儿均符合van Baalen等[10]提出的FIRES诊断标准,主要包括:(1)发病年龄在儿童期;(2)病初有发热或其他感染性疾病,随之出现癫痫持续状态或频繁地局灶性或全面性癫痫发作,持续数天或数周后演变为药物难治性癫痫和神经心理学障碍;(3)无异常行为和运动障碍;(4)既往无神经系统疾病;(5)缺乏感染性脑炎和代谢性脑病的证据,神经元抗体检测结果阴性,头颅磁共振成像缺乏特异性改变等;(6)个别患儿可有脑脊液细胞数和/或蛋白升高和/或寡克隆带阳性。本研究获得我院医学伦理委员会批准(2021-E-128-R),豁免知情同意。
1.2 研究方法
收集患儿资料,包括:(1)临床表现,如发热持续时间及伴随症状、抽搐发作形式及持续时间、昏迷持续时间等;(2)实验室检查,如血液和脑脊液常规、生化、病原学、免疫学结果,遗传代谢筛查、头颅磁共振成像及脑电图结果。
脑电图采用美国Natus Nicolet 32通道视频脑电图监测系统,每例患儿根据病情进展,于病程各个阶段进行多次视频脑电图监测,每次监测2 h以上,按照国际标准10-20系统安放电极。脑电图主要分析内容包括背景活动、睡眠期生理性波形、发作期和发作间期的脑电活动特征,并总结急性期、慢性期脑电图演变特征。
急性期界定是指发热后突发局灶性或继发全面性癫痫发作,这些癫痫发作直接演变为超难治性癫痫发作持续状态,伴有意识障碍,通常需要重症监护室支持治疗[11]。慢性期是指癫痫持续状态停止,无需呼吸支持,体温降至正常,意识水平逐渐恢复,遗留有药物难治性癫痫和神经心理障碍,急慢性期之间没有明确静止期[12]。
2 结果
2.1 一般资料
26例患儿,其中男19例(73%),女7例(27%)。就诊年龄范围1岁10个月至13岁1个月,平均6岁2个月。就诊时病程3~59 d,平均17.5 d。23例(88%)接受重症监护室治疗,治疗时间3~61 d,平均21.5 d。3例(12%)于既往2~4岁时有发热抽搐病史,3例(12%)有家族性抽搐史,2例(8%)为胎龄34周早产儿,2例(8%)有生后缺氧史,1例(4%)为试管婴儿。
2.2 临床表现
所有患儿均以发热起病,发病初期有头痛6例(23%),呕吐4例(15%),咽痛2例(8%),头晕、腹痛各1例(4%)。首次癫痫发作出现在发热后0~6 d(平均3.9 d)。局灶性发作伴局灶性继发全面性发作16例(62%),全面性发作10例(38%),其中全面性发作合并不对称痉挛发作1例。26例患儿首次癫痫发作后迅速进展为惊厥持续状态,惊厥持续状态持续1~93 d(平均28.5 d),昏迷时长为5~97 d(平均37.6 d)。16例(62%)患儿行气管插管,6例(23%)行气管切开术。急性期病程持续2~15周(平均5.2周)。
2.3 实验室检查
26例患儿血生化、乳酸、血尿代谢筛查等检查均大致正常,血氨水平正常或轻度升高;血清自身抗体及肿瘤标志物均阴性。脑脊液白细胞数增高1例(4%),病程第7天为28×106/L,病程第10天为22×106/L;生化蛋白轻度增高2例(8%),分别为531 mg/L和550 mg/L,糖和氯化物均正常。血液和脑脊液细菌培养均阴性,单纯疱疹病毒、带状疱疹病毒、巨细胞病毒、柯萨奇病毒、埃可病毒抗体检测均阴性。17例行脑脊液病原学二代测序检测均未见异常。1例染色体核型提示Turner综合征;9例行家系全外显子组检测,1例为IRF3基因c.175G>A(p.E59K)突变,来源于母亲,该基因为急性感染诱发性脑病易感性7型的致病基因。
2.4 头颅影像学检查
26例患儿住院期间均行1~5次头颅磁共振成像检查,其中9例(35%)病程8 d内影像学未见异常;住院期间23例(88%)患儿于病程5~31 d内发现影像学异常,其中颞叶异常信号9例,额叶异常信号8例,海马或海马边缘异常信号7例,顶枕叶异常信号6例,基底节区异常信号4例,岛叶异常信号2例。
2.5 脑电图结果
26例患儿住院期间行2~18次视频脑电图监测,其中急性期1~15次,慢性期1~5次。患儿各期脑电图特征见表1。

表1 26例FIRES患儿病程各期的脑电图表现 (例)
急性期脑电图特征如下。(1)背景活动及生理性睡眠结构:全部患儿脑电图正常背景活动消失,为双侧导联弥漫性中高波幅1~3 Hz慢波,未见枕区优势节律;睡眠期21例(81%)表现为生理性睡眠结构消失,5例(19%)睡眠期可见少量睡眠纺锤波,但睡眠周期图形被大量发作间期异常波掩盖。(2)发作期:26例(100%)均捕捉到局灶性低波幅快节律起始临床发作(图1),其中6例(23%)合并有局灶性棘慢波节律起始的发作;1例(4%)合并不对称痉挛发作。发作期脑电图为慢波复合快波节律。发作起始部位为颞区的有11例(42%),颞区合并枕区8例(31%),颞区合并额区7例(27%)。每个患儿发作期脑电图的起始部位通常是不固定的,在各个脑区呈游走性交替出现,通常由一个部位起始的发作期图形尚未结束,由另外一个脑区起始的发作图迅速出现,数次发作期脑电图紧密相连。(3)发作间期:25例(96%)表现为弥漫性不规则慢波合并多灶性棘慢波,1例(4%)为双侧导联弥漫性不规则慢波,2例(8%)于外院监测到暴发-抑制图形。(4)临床下电发作:15例(58%)捕捉到临床下电活动,图形与发作期相同的有11例(42%),1例(4%)为外院监测到的持续性临床下电发作,3例(12%)为局灶性棘慢波节律起始的临床下电活动。

图1 局灶性低波幅快节律起始的发作图
慢性期脑电图特征如下。(1)背景活动及生理性睡眠结构:2例(8%)监测到枕区α节律;9例(35%)枕区节律减慢为4~7 Hz θ节律;余15例(58%)未见枕区优势节律,背景活动以θ或δ频段慢波为主。睡眠期18例(69%)可观察到生理性睡眠周期,另外8例(31%)可见少量睡眠纺锤波。(2)发作期:11例(42%)监测到发作期图形,其中9例发作起始脑电图为局灶性中波幅慢节律(图2),1例为局灶性低波幅快节律起始,1例为棘慢波节律起始。(3)发作间期:23例(88%)为多灶性不规则棘慢波、慢波,3例(12%)为双侧导联不规则慢波。
4例(15%)患儿监测到极度δ刷(extreme delta brush, EDB)现象(图3),分别见于病程的第56、159、12、31天。
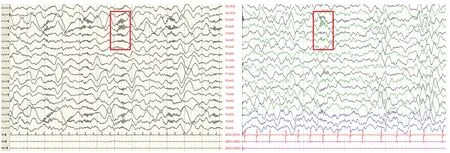
图3 EDB现象
2.6 治疗
26例患儿住院期间23例(88%)转入重症监护室密切监护,22例(85%)需要呼吸机辅助通气。26例(100%)患儿急性期均给予麻醉镇静药物控制惊厥发作,包括咪达唑仑(26例,100%)、丙泊酚(8例,31%);由于癫痫发作频繁,全部患儿采用3~6种(平均4.6种)抗癫痫发作药物联合治疗,包括丙戊酸、左乙拉西坦、奥卡西平、托吡酯、拉考沙胺、氯巴占、苯巴比妥、硝西泮、氯硝西泮;全部患儿均接受了免疫治疗,包括甲泼尼龙冲击(26例,100%)和静脉注射免疫球蛋白(23例,88%),3例(12%)行托珠单抗治疗;20例(77%)接受生酮饮食,2例(8%)行迷走神经刺激器植入术,2例(8%)行血浆置换治疗;其他治疗包括阿昔洛韦、头孢曲松、阿奇霉素等抗感染、甘露醇降颅压等。
2.7 结局
26例患儿住院时长22~124 d(平均44 d),治疗后病情明显好转,体温恢复正常,癫痫持续状态停止,运动能力和意识状态逐渐好转。26例患儿随访时病程为9~59个月(平均56个月),其中1例死亡,余25例服用3~5种抗癫痫发作药物,并遗留有药物难治性癫痫,发作频率为每天2~3次至3~4个月发作1次不等,发作形式为局灶性发作或局灶性继发全面性发作。智力水平均不能达到发病前状态,25例(96%)均有轻至重度智力障碍,表现为不同程度的理解力和语言表达受损,如反应迟钝、记忆力差、可简单定向交流或不能完成指令。12例(46%)运动能力受损,表现为不能独站、不能独走或走路不稳。
3 讨论
FIRES为既往健康的患儿,在发热后出现癫痫发作,并迅速恶化为难治性癫痫持续状态。发病年龄多见于3~15岁,男孩多见[13],癫痫发作通常表现为局灶性发作伴继发全面性发作,或仅为全面性发作[14]。本研究中26例患儿平均发病年龄为6岁2个月,男女比例为2.7∶1。进入慢性期后的发作形式均与急性期相同。
Fox等[15]对71例FIRES患者致痫灶进行总结分析,结果表明起源脑区最多是颞叶、额颞叶,其次为额叶,与Culleton等[16]研究头颅磁共振成像信号异常的部位多一致,表明FIRES患儿以前头部受累为主。本研究的26例患儿发作期脑电图起始部位主要为颞叶,其次是颞枕叶、额叶,且部位常常不固定,呈游走性。与国外文献[15-16]报道基本相符。
本研究中急性期全部患儿发作期及临床下电发作均捕捉到了局灶性低波幅快节律起始的脑电图,起始部位在各个脑区呈游走性,通常由一个部位起始的发作期图形尚未结束,另一个脑区起始的发作图形迅速出现,数次发作期图形紧密相连。多灶性、游走性放电模式可能是FIRES急性期的脑电图特征,既往文献未见报道,对FIRES的早期识别有一定提示意义,同时此特点可与其他急性期脑损伤疾病如脑炎、脑病的脑电图多呈双侧导联弥漫性慢波相鉴别。近年来国内外研究总结了FIRES患者急性期3个共同特征[7-9]:第一,由短暂的、相对不频繁的癫痫发作起病,迅速演变为癫痫持续状态;第二,观察到额、中央区EDB现象;第三,癫痫发作期通常开始是持续的局灶性快波。本研究患儿急性期特征及脑电图改变均符合上述特征。目前国内外对于FIRES慢性期的脑电图特征研究较少。本研究中观察到病程1~4个月时患儿均处于病情恢复阶段,此时患儿发作期脑电图表现多由局灶性慢波节律起始,很快演变为波幅更高、范围更广的中高波幅慢波节律或棘慢波节律,考虑这样的发作图形可能提示患儿进入慢性期,对FIRES的病程分期有一定提示意义。目前国内外文献中尚未见相关报道。
FIRES患儿的另外一个脑电图特征是EDB现象,本研究中有4例患儿监测到了EDB现象。EDB是Schmitt等[17]在抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate-receptor, NMDAR)脑炎患者队列研究中观察到的特征性图形,多见于中央、枕区和颞区,与疾病严重程度呈正相关。既往报道中,FIRES患者的EDB现象均见于急性期,于额、中央区出现。本研究中4例EDB现象有3例出现于急性期,1例见于慢性期,EDB均位于额、颞区明显,4例患儿急性期头颅磁共振成像均可见到病变累及双侧海马部位,考虑EDB的出现可能与颞叶深部皮质功能异常有关。病例10为2岁11个月女孩,急性期病程长达100 d,慢性期表现为发育落后,不能听懂指令,走路不稳,于病程第159天监测到EDB现象,该患儿急性期脑损伤情况较重,慢性期遗留严重脑病,脑功能尚未恢复,导致慢性期出现EDB现象,病程慢性期大脑环路异常兴奋性较急性期降低,其EDB现象中慢波复合快波频率为18~20 Hz,快波频率呈减慢趋势。EDB产生原因尚不清楚,据推测可能与NMDAR介导的电流调节有关[18]。本研究26例患儿的NMDAR抗体均为阴性,EDB的出现考虑与FIRES病因可能是由于炎性介导及免疫反应导致的脑功能障碍相关,FIRES的致病机制可能与抗NMDAR脑炎的致病机制存在一些重叠。
FIRES是一种逐渐被认识的癫痫性脑病,由于缺乏特异性血液或脑脊液标志物,使得该病早期识别、诊断困难。本研究中观察到的急慢性期特征性脑电图发作模式,希望对该病的早期识别和分期提供帮助,并指导临床尽早、足量地使用麻醉镇静及抗癫痫发作药物,减少癫痫持续状态的时间,减少急性期脑损伤。由于部分患儿就诊我院时病程较长,病程早期的脑电图资料较少,且本研究样本量较小,可能导致本研究存在一定局限性,未来有待进一步扩大样本研究。
利益冲突声明:所有作者声明无利益冲突。
