患者源性非小细胞肺癌异种移植模型的建立及个体化治疗策略研究
2023-10-30刘建辉李惠谭邓旭秦靖张彩勤师长宏
刘建辉,李惠,谭邓旭,秦靖,张彩勤,师长宏*
(1. 西安医学院附属宝鸡医院宝光分院,陕西 宝鸡 721006;2. 空军军医大学实验动物中心,陕西 西安 710032)
肺癌是当前全球发病率及死亡率均居于前列的恶性肿瘤[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%~85%,约30%的NSCLC患者在就诊时已达到Ⅲ期,且大多失去了最佳手术治疗时机[2]。除了手术,化疗和表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂等分子靶向药物也已成为可行的治疗选择。
靶向疗法的临床前评估在很大程度上依赖于动物肿瘤模型的使用[3],将标准肿瘤细胞系移植到小鼠体内以产生异种移植模型是临床前药物开发的常见模型[4]。然而,这些移植的肿瘤细胞在体外经过长时间培养很难保持患者肿瘤的原始分子生物学特征,将临床前疗效转化为临床结果方面的预测能力差。因此,在上述模型的基础上,通过将新鲜的患者肿瘤组织植入免疫缺陷小鼠,建立患者源性异种移植(patient-derived xenograft,PDX)模型,可以较好地保持原发瘤的病理学和分子生物学特征,能够更好地预测临床肿瘤对药物的反应[5]。研究[6]发现患者衍生异种移植模型产生的抗肿瘤疗效与患者临床反应之间高度相关(90%~96%),且能准确地反映人类肿瘤的复杂性和异质性。因此,PDX模型的建立和应用将为非小细胞肺癌患者的个性化治疗提供机会。
抗EGFR药物和单胺氧化酶A(non-small cell lung cancer,MAOA)抑制剂均为目前非常具有临床应用前景的靶向药物[7-8],其治疗效果需要模拟临床特征的个体化肿瘤模型进行验证。有鉴于此,本研究中构建了患者源性NSCLC异种移植模型,检测到了肿瘤模型中EGFR和MAOA的表达;并进一步评价EGFR抑制剂奥希替尼、MAOA抑制剂氯吉林靶向药物的治疗效果,期望为NSCLC患者的个性化治疗提供理想的实验工具。
1 材料和方法
1.1 患者样本来源
获得患者本人及其家属知情同意后使用NSCLC患者肿瘤标本及临床资料,相关实验获得西京医院福利伦理委员会批准(ID:KY20203128-1)。收获的新鲜NSCLC标本在无菌条件下切成约1.5 mm3的碎片,放入含有90%的胎牛血清(FBS)(Gibco,Cat#10099-141,澳大利亚)和10%的二甲基亚砜(DMSO)(Sigma,Cat#D2650,美国)的冷冻培养基中,然后储存在液氮中供植入。
1.2 实验动物
7-8周龄雄性BALB∕c裸小鼠,由成都药康生物科技有限公司提供[SCXK (川)2020-0034],饲养于空军军医大学实验动物中心SPF级屏障设施中[SYXK(陕)2019-001],动物房环境温度和相对湿度分别维持在22 ℃~26 ℃和40%~60%,饲料及饮用水均经无菌处理,小鼠自由摄食和饮水。相关动物实验获得空军军医大学实验动物福利伦理委员会批准(ID:20200602)
1.3 主要试剂与仪器
SP Rabbit HRP Kit( DAB)试剂盒(北京康为世纪生物科技有限公司);重组Anti-Ki67抗体(美国,abcam);Anti-Mitochondria抗体(美国,abcam);重组Anti-Carcino Embryonic Antigen CEA抗体(美国,abcam);重组Anti-ErbB2 ∕ 人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)抗体(美国,abcam);重组Anti-EGFR抗体(美国,abcam);CK5∕6抗体(Cell Signaling Technology);TTF-1抗体(Cell Signaling Technology);EGFR抑制剂奥希替尼(阿斯利康制药有限公司),MAOA抑制剂氯吉林(MCE)和顺铂(齐鲁制药有限公司)。
1.4 实验方法
1.4.1 PDX模型的建立 使用从NSCLC患者中手术切除的组织建立了患者源性NSCLC异种移植小鼠模型。含有90%FBS的冷冻介质中的NSCLC组织在37 ℃下解冻,并通过Trocar针皮下植入裸鼠体内。观察植入肿瘤的小鼠,每隔1 d用卡尺测量肿瘤体积,以确定皮下生长速度。待裸鼠的异型移植非小细胞肺癌肿瘤约500 mm3时被转植入别的裸鼠皮下,以支持该模型的传代。在连续3次对小鼠NSCLC组织肿瘤传代后,异种移植模型可稳定生长,然后进行模型表征,包括组织病理学苏木精-伊红染色(hematoxylin-eosin staining,HE)染色确认、HER2和EGFR等基因表达。
1.4.2 HE及免疫组织化学染色 取患者肿瘤标本及PDX肿瘤组织,分别进行HE及免疫组织化学染色。HE染色:组织切片,经二甲苯脱蜡、梯度酒精水化、伊红染色后经梯度酒精与二甲苯脱水后封片。免疫组织化学染色:组织切片,经二甲苯脱蜡、梯度酒精水化、抗原修复后,滴加一抗,4 ℃孵育过夜。次日滴加二抗,DAB显色后苏木精复染,经梯度酒精与二甲苯脱水后封片,光学显微镜采图,并用 Image-Pro Pus 软件进行定量分析。
1.4.3 实验分组及治疗 PDX肿瘤组织皮下移植后,每周2次动态监测小鼠肿瘤体积ab2∕2(a为长径,b为短径),待肿瘤达到150~200 mm3时,根据实验模型靶点的不同表达,分为两部分动物实验。第一部分:将小鼠随机分为4组,每组5只,并开始治疗:① 模型对照组:PBS,腹腔注射,2 d 1次;② EGFR抑制剂奥希替尼组,15 mg∕kg,腹腔注射,2 d 1次;③ 顺铂组,3 mg∕kg,腹腔注射,5 d 2次;④ 顺铂+奥希替尼组,同时给药,用药剂量及次数同上。第二部分:将小鼠随机分为4组,每组5只,并开始治疗:① 模型对照组:PBS,腹腔注射,2 d 1次;② MAOA抑制剂氯吉林组,15 mg∕kg,腹腔注射,2 d 1次;③ 顺铂组,3 mg∕kg,腹腔注射,5 d 2次;④ 顺铂+氯吉林组,同时给药,用药剂量及次数同上。
1.5 统计学方法
实验数据采用GraphPad Prism 8.0.2软件进行统计学分析,结果用()表示。两组间比较采用非配对t检验法进行差异分析,P<0.05为差异具有统计学意义;多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 建立患者衍生的NSCLC异种移植小鼠模型
收集NSCLC患者新鲜的手术标本,并皮下植入5只裸鼠体内,建立了患者衍生的NSCLC异种移植模型,植入后,监测肿瘤生长曲线,如图1A所示。通过HE染色对异种移植组织进行分析,以进行病理学评估,发现患者源性的NSCLC异种移植组织表现出与患者源性组织相似的形态(如图1B)。对PDX组织进行免疫组化线粒体Mito与癌胚抗原CEA染色进一步说明该组织属于人源性肺癌组织(如图1C、D),且没有出现肺、肝脏转移(如图1E、1F)。提示,成功建立NSCLC患者来源的PDX模型,该模型保持了患者的病理学特征。

图1 患者来源的NSCLC异种移植模型的建立
2.2 检测患者衍生的NSCLC异种移植模型中的遗传突变
在已建立的异种移植样本中,对NSCLC进一步明确。细胞角蛋白5∕6(cytokeratin 5∕6,CK5∕6)在正常组织中,鳞状上皮和导管上皮的基底细胞以及部分的鳞状上皮生发层细胞、肌上皮细胞、间皮细胞阳性,腺上皮细胞阴性。因此,可用于鳞癌和腺癌鉴别诊断。同时,甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)表达于甲状腺滤泡上皮和肺泡上皮细胞的细胞核中。肺腺癌中约75%~85%表达阳性。鳞癌通常不表达TTF-1。如图2A、2B所示CK5∕6阴性,TTF-1阳性,说明该模型中为患者源性NSCLC肺腺癌模型。进一步检测肿瘤组织中HER2、EGFR和MAOA的表达水平,如图2C所示,发现了EGFR和MAOA均表达强阳性,而HER2表达为阴性,这为靶向药物的选择提供了指导。
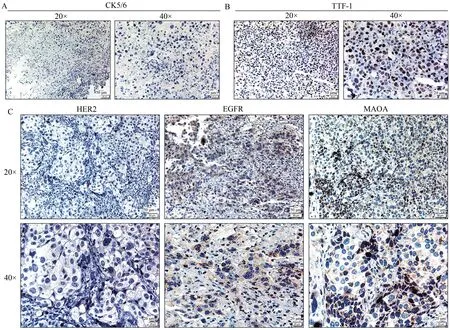
图2 NSCLC异种移植模型肿瘤组织中特异性靶点的表达
2.3 评估EGFR抑制剂奥希替尼的抗肿瘤作用
待肿瘤体积约为100~200 mm3时开始治疗,治疗20 d后,通过测量肿瘤体积和荷瘤裸鼠体重的变化以及病理组织学来评价治疗效果。如图3A所示,与PDX模型对照组相比,顺铂治疗及奥希替尼治疗均不能抑制肿瘤生长(P>0.05),奥希替尼联合顺铂治疗显著抑制了肿瘤生长(P<0.05)。单纯顺铂治疗和奥希替尼联合顺铂治疗均导致荷瘤小鼠体重下降,可能是由于化疗药物毒性及不良反应所致(图3B)。治疗周期结束后,CO2窒息处死小鼠,收集肿瘤组织,进行免疫组化染色,Ki-67增殖指数,发现与PDX模型对照组相比,顺铂治疗组及奥希替尼治疗组中Ki-67增殖指数差异均无统计学意义(P>0.05),而联合治疗可以显著抑制Ki-67增殖指数(P<0.05,图3C、D)。说明奥希替尼联合顺铂治疗在该模型中具有良好的抗肿瘤作用。
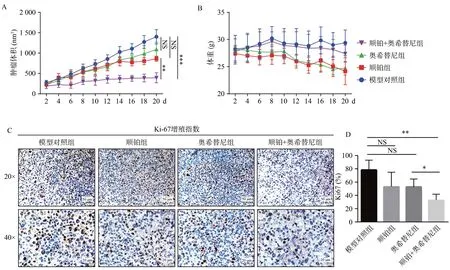
图3 EGFR抑制剂奥希替尼及顺铂的抗肿瘤作用
2.4 评估MAOA抑制剂氯吉林的抗肿瘤作用
待肿瘤体积约为100~200 mm3时开始治疗,通过测量肿瘤体积和荷瘤鼠体重的变化以及病理组织学评价治疗效果。如图4A所示,与PDX模型对照组相比,顺铂治疗不能抑制肿瘤生长(P>0.05),氯吉林治疗显著抑制了肿瘤生长(P<0.05),联合顺铂治疗效果更加明显。顺铂治疗和联合氯吉林治疗均未导致荷瘤小鼠体重下降,说明氯吉林未产生药物毒性及不良反应(图4B)。治疗周期结束后,CO2处死小鼠,收集肿瘤组织,进行免疫组化染色,观察Ki-67增殖指数,发现与PDX模型对照组相比,顺铂治疗组中Ki-67增殖指数差异没有统计学意义(P>0.05),而氯吉林治疗可以明显抑制Ki-67增殖指数,联合顺铂治疗更加显著抑制Ki-67增殖指数(P<0.05,图4C、D)。说明氯吉林、氯吉林联合顺铂治疗在该模型中具有良好的抗肿瘤作用。
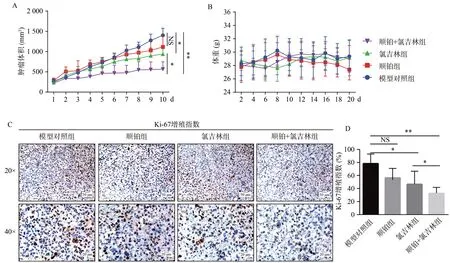
图4 MAOA抑制剂氯吉林及顺铂的抗肿瘤作用
3 讨论
非小细胞肺癌是全球致命性的恶性肿瘤之一,尽管可以使用化疗、靶向分子治疗、手术切除和放射治疗等治疗方法,但其发病率和死亡率仍然较高。近年来,个体化治疗已成为这些患者的一种有效、安全的治疗模式。建立适当的临床前模型对个性化药物评价、癌症转化研究至关重要。作为临床前模型,PDX模型在药物筛选、生物标志物寻找和联合临床试验方面表现出一定优势[9]。大量研究证实,PDX模型可以很好地保留肿瘤的形态特征和蛋白质表达模式,本实验结果与之前研究的发现一致[10]。本项研究选择了患者的肿瘤组织及其相应的PDX模型进行组织学和免疫组织化学分析。HE染色结果表明,PDX模型保留了原发性肿瘤的组织学外观。本研究中选择的免疫组织化学标志物包括CK5∕6和TTF-1。CK5∕6是一种基底细胞角蛋白,在正常组织中,鳞状上皮和导管上皮的基底细胞以及部分的鳞状上皮生发层细胞、肌上皮细胞、间皮细胞阳性,腺上皮细胞阴性。因此,可用于鳞癌和腺癌的鉴别诊断。同时,TTF-1阳性也通常表示肺腺癌;鳞状细胞癌通常为阴性。根据免疫组织化学的结果,确定本研究建立的PDX模型肿瘤组织是典型的肺腺癌。
目前,NSCLC靶向治疗的主要靶点包括EGFR、ALK、ROS1等。基因检测,确定患者基因型,才能精准施策、靶向治疗。PDX模型可以较好地保持患者肿瘤的遗传多样性和分子特征[11]。本研究建立的非小细胞肺癌组织中HER2表达阴性,EGFR和MAOA均呈现阳性表达。奥希替尼是一种抗EGFR药物,已被证明具有治疗EGFR表达阳性NSCLC患者的临床活性[12]。在临床研究中,奥希替尼与一线化疗药物联合治疗具有更加显著的抗肿瘤作用[13]。本研究建立的NSCLC模型中,奥希替尼能轻微抑制肿瘤生长,但差异并无统计学意义。与临床一线化疗药物顺铂联合使用后,可显著抑制肿瘤生长。此外,单纯使用顺铂和联合奥希替尼治疗均导致荷瘤小鼠体重下降,可能是由于化疗药物毒性及不良反应所致,需要在后期使用过程中调整剂量。最后,靶向治疗药物的耐药性问题使靶向治疗仍未在临床得到广泛应用,且不能满足多数肿瘤患者的预期目标,这就需要探索及进一步地分析和研究新的靶点,以提高靶向治疗效果,促使肿瘤患者获益。
MAOA是一种线粒体酶,对膳食胺、单胺神经递质和激素的氧化脱氨进行催化[14]。据报道,MAOA与多种癌症的发生发展相关,如胆管癌、胰腺癌和乳腺癌等[15]。MAOA代表了癌症治疗中一个有前途的新靶标,其抑制剂氯吉林在前列腺癌中显示出了良好的抗肿瘤潜力,与一线化疗药物多西他赛联合使用抑瘤效果更加显著[16-17]。本研究检测到PDX模型中MAOA表达呈阳性。使用MAOA抑制剂氯吉林能抑制肿瘤生长,与临床一线化疗药物顺铂联合使用后,抑瘤效果更加明显。此外,单纯使用氯吉林治疗和联合顺铂治疗均未导致荷瘤小鼠体重下降,说明氯吉林能缓解化疗药物毒性及不良反应,是有希望的抗肿瘤新靶点。
总之,本研究建立了患者来源的NSCLC异种移植模型,检测发现肿瘤组织中EGFR和MAOA均表达阳性。EGFR抑制剂奥希替尼与顺铂联合使用展现出良好的治疗效果,但具有一定的毒性;而联合使用MAOA抑制剂氯吉林与顺铂不仅展现出良好的抗肿瘤潜力,且安全性较好。同时,如何筛选优势人群、指导继发耐药后的靶向治疗、制订合理的联合治疗方案仍是今后相关领域的研究方向。
