RIPK1调控LPS诱导的星形胶质细胞神经炎症的作用机制
2023-10-30钮谷雨乔晨萌权威张梅宣赵丽萍申延琴
钮谷雨,乔晨萌,权威,张梅宣,赵丽萍,申延琴*
(1.无锡市惠山区人民医院,江苏 无锡 214122; 2.江南大学无锡医学院神经退行性疾病和神经损伤实验室,江苏 无锡 214122)
神经炎症在许多中枢神经系统(central nervous system,CNS)疾病发生和发展过程中起着至关重要的作用,而星形胶质细胞作为CNS中重要的免疫细胞之一,它的激活也是诱发神经炎症的因素之一。星形胶质细胞具有重要的稳态功能,包括促进神经突生长和吞噬细胞碎片[1]。在许多神经退行性疾病中,星形胶质细胞的活化及增殖与神经炎症相关,包括在帕金森病[2-3]、阿尔茨海默病[4]、亨廷顿病[5]、肌萎缩侧索硬化[6-7]等疾病中。之前有文献将星形胶质细胞激活状态按不同的转录特征和功能特征进行区分,具有促炎和神经毒性的“A1”型星形胶质细胞以及具有抗炎和神经保护作用的“A2”型星形胶质细胞[8]。
受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)是死亡受体家族和模式识别受体激活的多种信号转导通路的重要调节因子[9],通过调节炎症和细胞死亡信号,在细胞和组织水平上调节稳态。在CNS中,RIPK1在神经元和胶质细胞中都有表达,如在一些神经退行性疾病包括肌萎缩性侧索硬化症[10]、多发性硬化症[11]和阿尔茨海默病[12]中的星形胶质细胞、小胶质细胞和少突胶质细胞中表达。
RIPK1已被认为与CNS疾病的发病机制有关。RIPK1的活性可以调节促炎症细胞因子和趋化因子的产生[13-14]。在神经退行性疾病中,RIPK1可能是一个细胞死亡调节因子,可能导致有害的神经炎症环境[15];RIPK1在阿尔茨海默病中介导疾病相关的小胶质细胞反应[12];RIPK1在多发性硬化症中介导小胶质细胞和星形胶质细胞中的炎症信号[11];RIPK1在脑缺血性疾病中介导小胶质细胞激活引起的神经炎症[16]。
基于上述研究背景,为了验证星形胶质细胞所介导的神经炎症与RIPK1相关,该研究使用脂多糖(lipopolysaccharide,LPS)诱导的小鼠星形胶质细胞[mice astrocytes (MA)细胞]作为神经炎症模型,用Nec-1抑制RIPK1的表达,以期为明确RIPK1与星形胶质细胞介导的神经炎症之间的关系提供新的思路。
通过免疫印迹(western blotting, WB)法检测LPS对MA细胞RIPK1蛋白水平的影响,实时荧光定量PCR(Real-time quantitative PCR, RT-qPCR)检测MA细胞的A1∕A2型标志物、炎症因子和趋化因子的mRNA水平的表达,以探究抑制RIPK1的表达对星形胶质细胞极化和炎症的影响。
1 材料与方法
1.1 主要试剂与仪器
小鼠星形胶质细胞系MA细胞购于广州吉妮欧生物科技有限公司;LPS购于西格玛奥德里奇(上海)贸易有限公司;Nec-1购于美国MedChemexpress生物科技公司;RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂均购于碧云天生物技术公司;GAPDH抗体购于武汉三鹰生物技术有限公司;RIPK1抗体购于上海优宁维生物科技有限公司;HRP标记羊抗兔IgG二抗购于博士德生物工程有限公司;MTT购于北京百灵威科技公司;电泳仪购于伯乐生命医学产品(上海)有限公司;RT-qPCR引物购于上海Invitrogen公司;反转录试剂和荧光定量PCR试剂盒购于宝日医生物技术(北京)有限公司;电泳仪购于伯乐生命医学产品(上海)有限公司;全能型凝胶成像分析系统购于伯乐生命医学产品(上海)有限公司;荧光定量PCR仪购于罗氏(中国)有限公司。
1.2 实验设计与分组
采用小鼠星形胶质细胞细胞系MA细胞,随机分为4组:① Control组:加入DMEM高糖培养基于培养体系30 min后,再加入DMEM高糖培养基继续处理24 h;② LPS组:加入DMEM高糖培养基于培养体系30 min后,向培养体系中加入LPS继续处理24 h;③ Nec-1组:加入Nec-1预处理MA细胞30 min后,向培养体系中加入DMEM高糖培养基继续培养24 h;④ Nec-1+LPS组:Nec-1预处理MA细胞30 min后,向培养体系中加入LPS继续处理24 h。其中,所采用的LPS浓度为0.1 µg∕mL,Nec-1浓度为50 mM。
1.3 LPS刺激MA细胞工作浓度及作用时间的设定
在96孔板中每孔接种1×104个MA细胞;培养24 h后,依次将每个孔中原培养基更换含浓度为0、0.1、1和10 µg∕mL LPS的新鲜培养基(100 µL∕孔)。每个浓度设置6个复孔,培养24 h后,通过细胞活力检测以确定LPS的安全工作浓度。
在12孔板中每孔接种5×105个MA细胞,培养24 h后将原培养基更换为工作浓度的LPS继续刺激MA细胞24 h,提取细胞总蛋白用于WB实验检测RIPK1蛋白的表达,提取细胞总RNA用于RT-qPCR实验检测星形胶质细胞标志物和炎症细胞因子的表达。
1.4 MTT比色法检测细胞活力
向步骤1.3中的96孔板中加入20 µL∕孔的5 mg∕mL MTT溶液,将其置于避光条件下、37 ℃、5% CO2的培养箱中孵育3 h。取出后弃掉上清液,向孔板中加入150 µL∕孔的DMSO溶液,避光。轻轻晃动使结晶体溶解后,可通过在490 nm波长处检测OD值,然后运用下述公式计算细胞存活率:细胞存活率=[(实验孔OD值-空白孔OD值)∕(对照孔OD值-空白孔OD值)]×100%。根据此公式计算出细胞的存活率。
1.5 WB检测MA细胞内RIPK1的表达
在12孔板中每孔接种5×105个MA细胞,细胞给药处理详细步骤同1.5,培养结束后提取细胞总蛋白,向孔板中加入含混合磷酸酶抑制剂和蛋白酶抑制剂PMSF(浓度为1 mM)的150 µL RIPA裂解液,反复吹打混匀后,在冰板上放置20 min。然后将混合物转移到1.5 mL的离心管中,在4 ℃条件下,以13 000 rpm离心5 min,收集离心后含有组织蛋白的上清液。加入4×上样缓冲液将蛋白浓度配平,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离已配平蛋白浓度的蛋白溶液,上样量为15 µL蛋白样品∕每个电泳通道,然后将目标蛋白转移到0.45 µm聚偏二氟乙烯膜上。封闭,然后用稀释比为1∶500特异性RIPK1一抗在4 ℃下孵育12 h。用稀释比为1∶8 000特异性二抗(生物素标记山羊抗兔IgG(H+L)溶液孵育2 h。最后,用化学发光成像系统成像。检测结果采用Image J软件进行定量处理。
1.6 RT-qPCR检测MA细胞内A1∕A2型标志物基因和炎症细胞因子的表达
MA细胞总RNA的提取:将MA细胞接种于6孔板(5×105个∕孔),细胞给药处理详细步骤同1.2,培养结束后使用Trizol法提取其总RNA并检测RNA浓度,然后用DEPC水稀释至200 ng∕µL的最终浓度。依据PrimeScript™ RT reagent试剂盒使用说明将RNA反转录为cDNA,最后使用SYBR Premix Ex TaqTM Ⅱ进行RT-qPCR反应(表1)。
1.7 统计学方法
2 结果
2.1 LPS对MA细胞活力和RIPK1表达的影响
使用LPS刺激MA细胞建立神经炎症模型,根据MTT细胞活力实验结果,使用浓度为0.1 µg∕mL、1 µg∕mL和10 µg∕mL的LPS刺激MA细胞24 h后,与未受LPS刺激的MA细胞相比,细胞活力保持正常水平。因此,可以进行后续实验。(图1A)。WB结果显示,所用不同浓度LPS均能上调RIPK1的表达,并且LPS浓度为0.1 µg∕mL时,RIPK1的表达升高最显著(图1B、1C)。因此,综合上述两个实验结果,选用LPS的工作浓度为0.1 µg∕mL开展后续细胞实验。
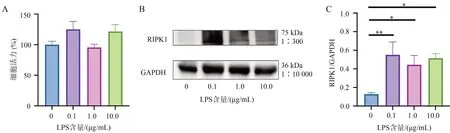
图1 不同浓度LPS对MA细胞活力和RIPK1表达的影响
2.2 Nec-1抑制LPS诱导的MA细胞RIPK1的过表达
用Nec-1(50 µM)预处理MA细胞30 min后[17-18],再用LPS(0.1 µg∕mL)处理24 h。结果显示,Nec-1预处理可以显著抑制LPS刺激引起的MA细胞中RIPK1蛋白的高表达(图2A、2B)。这些结果表明,LPS刺激可使星形胶质细胞RIPK1蛋白水平高表达,使用Nec-1治疗可减轻炎症状态下RIPK1的升高。

图2 Nec-1抑制LPS诱导的MA细胞RIPK1的过表达
2.3 Nec-1抑制LPS诱导的MA细胞A1型标记物C3的过表达
为了分析RIPK1对LPS处理后星形胶质细胞介导的活化作用,通过RT-qPCR检测A1(神经毒性)和A2(神经营养)星形胶质细胞活化状态相关的基因表达水平。在Nec-1预处理MA细胞30 min后,用0.1 µg∕mL LPS处理MA细胞24 h。接下来,通过RT-qPCR检测星形胶质细胞A1∕A2型标志物,评估RIPK1激活是否影响MA细胞向A1∕A2型星形胶质细胞的转化。实验表明,A1型基因C3在LPS诱导的MA细胞中保持高表达,与LPS组相比,Nec-1+LPS组中C3基因mRNA水平明显降低(图3A),而A1型基因H2-D1、H2-T23和A2型基因S100A10、EMP1、PTX3的mRNA水平没有明显变化,这表明LPS只能上调MA细胞中A1型标志物C3基因的表达,而不改变其他基因的表达(图3B-3F),而阻断RIPK1可以显著减少LPS诱导的星形胶质细胞A1型极化相关基因的上调。

图3 Nec-1抑制LPS诱导的MA细胞A1型标记物C3的过表达
2.4 Nec-1改善LPS诱导的MA细胞产生的炎症反应
表达炎症因子是星形胶质细胞激活的主要表现之一,通过RT-qPCR检测促炎类和抗炎类细胞因子,以评估抑制RIPK1表达是否影响在LPS刺激下MA细胞炎症因子的产生。结果发现,与Control组相比,LPS诱导的MA细胞炎症趋化因子CCL2的表达增加,并且通过Nec-1抑制RIPK1的表达可以减轻这一趋化因子的表达(图4A)。其他趋化因子和炎症因子,如IL-6和IL-10,没有表现出显著的表达改变。这可能是由于在MA细胞引起的炎症反应过程中,LPS并不会影响这些炎症因子的表达(图4B、4C)。

图4 Nec-1改善LPS诱导的MA细胞产生的炎症反应
3 讨论
星形胶质细胞的激活往往伴随着神经炎症的疾病进程[19]。有研究[20]表明,神经炎症与大量星形胶质细胞增生和小胶质细胞过度激活有关,其中星形胶质细胞分为具有神经毒性作用的A1型和具有神经保护作用的A2型,小胶质细胞分为具有神经毒性作用的M1型和具有神经保护作用的M2型,星形胶质细胞和小胶质细胞受到刺激后可释放促炎细胞因子,如TNF-α,IL-1β和IL-6,说明星形胶质细胞和小胶质细胞功能障碍参与神经炎症的发病过程[21-22]。以往的研究[11,16]表明,RIPK1除了作为坏死调节蛋白的重要调节因子外,它作为促进神经炎症的关键驱动因子也越来越受到关注,RIPK1与多种神经退行性疾病的神经炎症相关,且被证明在星形胶质细胞[23]和小胶质细胞[24]中均有表达。
有研究[24]发现RIPK1调节脂多糖诱导的神经炎症模型中小胶质细胞的激活,但他们的研究没有涉及到星形胶质细胞在神经炎症中的作用。在本研究中,首次探讨了抑制RIPK1对LPS诱导的小鼠星形胶质细胞神经炎症的影响。
首先,为了明确在炎症环境下RIPK1在星形胶质细胞中的表达情况,探索了适宜浓度的LPS诱导的MA细胞体外炎症模型。实验结果表明,使用0.1 µg∕mL LPS刺激MA细胞24 h后,MA细胞的活力未出现下降;WB实验发现0.1 µg∕mL的LPS刺激MA细胞24 h后显著增加RIPK1蛋白的表达,遂以此为依据设定了LPS的刺激浓度。选用Nec-1抑制RIPK1表达,以探究RIPK1在星形胶质细胞炎症反应中的作用。通过WB实验发现,Nec-1作为一种RIPK1抑制剂,在浓度为50 µM时与LPS共处理24 h后,可以有效地缓解LPS诱导炎症引起的RIPK1表达升高。为了进一步探究RIPK1的表达对星形胶质细胞的作用机制,对RIPK1抑制剂作用下的星形胶质细胞活化和炎症因子相关基因表达进行了更全面的分析。通过RT-qPCR评估RIPK1激活是否影响MA细胞向A1型星形胶质细胞的转化。实验表明,A1型基因C3在LPS诱导的MA细胞中保持高表达。抑制RIPK1的表达显著阻断了LPS诱导的星形胶质细胞活化相关基因的上调。活化的神经胶质细胞通常通过释放促炎细胞因子引起组织损伤[25],因此进一步检测了星形胶质细胞中促炎细胞因子的水平。通过RT-qPCR检测炎症相关趋化因子和炎症因子发现,LPS诱导的MA细胞增加了炎症趋化因子CCL2的表达,并且通过Nec-1抑制RIPK1的表达可以减轻这一炎症表达。研究结果表明抑制RIPK1的表达可以改变LPS诱导的星形胶质细胞的表型,减少炎症因子的表达,进而调节神经炎症。
综上,研究证明Nec-1抑制RIPK1在LPS诱导的神经炎症模型中具有治疗作用。因此,针对星形胶质细胞中抑制RIPK1的手段可能在多种以A1型反应性星形胶质细胞激活为特征且涉及神经炎症性疾病的治疗中具有广阔的应用前景。然而,本文尚且存在一些不足之处,对于RIPK1影响星形胶质细胞免疫应答的精确分子机制还需继续探索,可以尝试在体内实验中通过对神经炎症模型小鼠进行RIPK1基因敲除,进一步探索其关键途径。
