组蛋白去甲基化酶LSD1去除亲代组蛋白H3K4me2促进复制偶联的核小体装配
2023-10-30杨笑菡
杨笑菡
(北京大学基础医学院生物化学与生物物理学系,北京 100191)
真核细胞染色质的基本结构单位是核小体,核小体由约147 bp的DNA缠绕在H2A、H2B、H3和H4各两个拷贝的组蛋白八聚体上形成。在以DNA为模板的转录、复制、重组和修复等诸多细胞生命活动中,核小体结构始终处于动态解聚和再组装过程。尤其在复制期,伴随全基因组的复制,染色质上所有的核小体也发生了解聚与再组装,形成新的染色质,保证了遗传信息的准确传递,这个过程被称为染色质的从头装配[1]。表观遗传一直被认为在染色质从头装配中发挥重要作用,但具体机制仍不清楚[2]。
由于组蛋白碱性强的特征,为了避免与带负电荷的DNA非特异性结合,成为不溶的聚集体,新生组蛋白存在H4K5、K12、K91的乙酰化,乙酰化能够中和组蛋白的正电荷,有利于核小体正确组装。与乙酰化不同,新生组蛋白H3与H4的甲基化修饰程度很低,当其装配为核小体后,新生组蛋白所特有的乙酰化修饰被快速去除,甲基化程度也迅速升高而成为成熟的染色质。很多证据表明,组蛋白的表观修饰在复制期存在动态改变,虽然新生组蛋白乙酰化修饰与核小体装配的关系目前研究得较为清楚,但亲代组蛋白表观修饰如甲基化水平是否对染色质装配起调控作用还不清楚。
组蛋白H3K4去甲基化酶(lysine-specific demethylase 1, LSD1)是第一个被发现的组蛋白去甲基化酶,能够催化组蛋白H3K4二甲基化、一甲基化(H3K4me2∕1)去甲基化[3],它作为转录抑制复合物的成员在转录调节中的作用被广为研究。本实验室的前期研究发现了LSD1不同于其转录调节功能的复制起始与复制时序调节功能[4]。进一步研究[5]表明,LSD1除了能够促进复制起始,同时能够促进复制偶联的核小体组装过程,亲代组蛋白H3K4me2的修饰需要在一定程度上被去除,有助于解聚后的核小体高速、准确地重新装配。
1 材料与方法
1.1 材料
1.1.1 人骨肉瘤细胞系(U2OS细胞)培养与同步化 DMEM培养基(Gibco)含10%胎牛血清(Gibco)和青链霉素(Sigma),胸苷(thymidine)(Sigma),诺考达唑(nocodazole)(Sigma)。
1.1.2 siRNA订购与转染 对照siRNA与靶向LSD1 siRNA购买自GE Dharmacon,序列如下:
siLSD1
UGAAUUAGCUGAAACACAA
siCTR
UGGUUUACAUGUUUUCUGA
siRNA转染试剂为RNAiMAX (Invitrogen)。
1.1.3 点突变试剂盒 (QuikChange mutagenesis,Stratagene公司),微球菌核酸酶(micrococcal nuclease, MNase)(Worthington)。
1.2 方法
1.2.1 U2OS细胞周期同步化 双胸苷(double thymidine)双阻滞:将1.5×105U2OS细胞系接种在六孔板中,转染75 nM对照和LSD1 siRNA,6 h后更换为含有2 mM thymidine的培养基孵育14~17 h,第2天去除thymidine释放细胞10~12 h,再次加入2 mM thymidine孵育14~17 h,去除thymidine释放细胞,在释放的0、3、6、9和16 h收集细胞进行流式细胞术或免疫荧光分析。Double thymidine双阻滞法可以使约90%U2OS细胞同步化在G1∕S临界点。
胸苷-诺考达唑(thymidine-nocodazole)阻滞:U2OS细胞转染对照和LSD1 siRNA后,加入2 mM thymidine的DMEM培养14 h,第2天去除thymidine释放细胞6 h,加入250 ng∕mL nocodazole培养细胞6 h,去除nocodazole后,在0、1、3、7和12 h收细胞进行流式细胞术分析。Thymidine-nocodazole阻滞法可以使约90%U2OS细胞同步化在G2∕M临界点。
1.2.2 抵抗siRNA的点突变质粒构建 以野生型LSD1质粒为模板,合成包含3个点突变的引物,点突变为LSD1 siRNA靶点区域,上游引物: G GAA TAT GAT GAA TTG GCA GAT ACA CAA GGA AAG CTA G;下游引物: C TAG CTT TCC TTG TGT ATC TGC CAA TTC ATC ATA TTC C。按照试剂盒说明进行PCR反应、DpnI去除模板DNA、转化、挑克隆测序鉴定。
1.2.3 免疫荧光共聚焦显微镜观察 将U2OS细胞以25%的密度接种在提前放入盖玻片的六孔板中,采用thymidine双阻滞法同步化U2OS细胞至G1∕S临界点。去除thymidine释放细胞后,在不同时间点收集细胞,固定、打孔、一抗(LSD1、H3K4me2、H3K4me1)孵育4度过夜、荧光二抗孵育室温1 h、封片、共聚焦显微镜观察。
1.2.4 流式细胞术分析 70%乙醇4 ℃过夜打孔、固定细胞,清洗细胞后加入500 µL 含RNA酶和DNA染料碘化丙锭的PBS 37 ℃孵育1 h,300目滤网过滤细胞入流式管分析DNA含量。
1.2.5 微球菌核酸酶(micrococcal nuclease, MNase)消化的染色质空间可及性分析 U2OS细胞转染对照和LSD1 siRNA,48 h后在细胞培养基中加入10 µM胸腺嘧啶核苷类似物EdU(5-Ethynyl-2’-deoxyuridine)标记增殖期细胞新生DNA 10 min,收集细胞,用不同浓度(0.25 U、0.5 U、2 U和5 U)或相同浓度(5 U)不同时间(1、4、8和12 min)MNase处理等量的细胞核[6],经过酚∕氯仿抽提去蛋白、乙醇沉淀DNA等步骤,将纯化后的DNA片段用含核酸染料溴化乙锭(ethidium bromide, EB)的2%琼脂糖凝胶进行电泳。为了检测新生DNA,将琼脂糖凝胶中的DNA在20×SSC缓冲液中转移至尼龙膜上,紫外交联10 min,用Click反应给标记了EdU的新生DNA片段偶联上生物素(biotin),与辣根过氧化物酶标记的链霉亲和素(HRP-Streptavidin)孵育进行免疫印迹分析。DNA条带灰度定量分析采用Image J V1.50b软件[7]。
1.2.6 免疫共沉淀实验(co-immunoprecipitation,Co-IP) 将U2OS细胞同步化在G1∕S临界点,释放3 h收集细胞,用Co-IP裂解液裂解细胞,收集蛋白,预留1%裂解液作为阳性对照组(input),其余加入LSD1抗体过夜孵育,第2天分别加入二抗、Agarose蛋白A琼脂糖凝珠,清洗珠子6遍,每次5 min,和Input一起加入2×上样缓冲液,水浴锅100 ℃煮样10 min,Western blot检测目标蛋白。
1.3 统计学方法
定量数据均录入SPSS进行数据分析,组间比较采用Student′st检验,P<0.05为差异有统计学意义。
2 结果
2.1 LSD1敲低会引起复制期延迟
本研究的前期结果表明,LSD1通过去除H3K4me2激活基因组的早期复制起始点,正调控复制起始,促进复制的进行。为了观察LSD1对细胞周期的影响,采用抑制复制的药物Thymidine双阻滞法将U2OS细胞同步化在G1∕S临界点或采用thymidine与抑制有丝分裂的药物nocodazole双阻滞法将U2OS细胞同步化在G2∕M临界点,去除药物后在不同时间点收集细胞进行流式细胞术分析,结果表明LSD1敲低使得细胞复制期的进程减慢(图1A),但不影响分裂期的进程(图1B)。
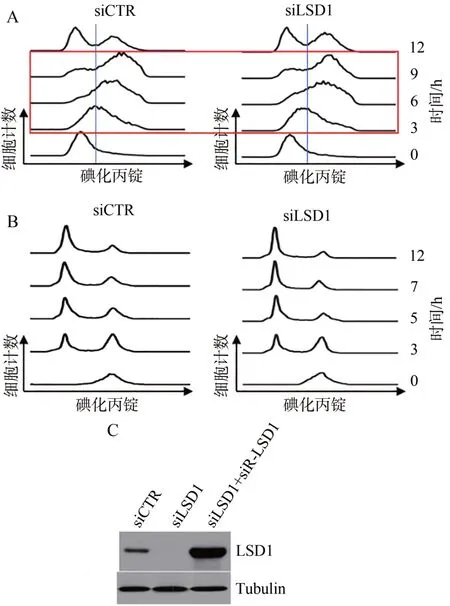
图1 LSD1敲低引起细胞复制期进程延迟
为了检测LSD1 siRNA的特异性,采用点突变试剂盒引入三个siRNA靶点DNA的点突变构建出能够抵抗siRNA的LSD1质粒(siRNA resistant LSD1,siR-LSD1)。在U2OS细胞中分别转染对照siRNA、LSD1 siRNA或LSD1 siRNA加siR-LSD1,48 h后收集、裂解细胞,提取细胞总蛋白进行Western blot分析。结果表明,转染LSD1 siRNA后细胞中的LSD1蛋白水平显著降低,当同时转染siR-LSD1质粒后,过表达的外源LSD1能够抵抗siRNA的降解,表达水平不受影响,证实实验所用的siRNA能特异性地敲低细胞中LSD1蛋白水平(图1C)。
2.2 LSD1、H3K4me2及H3K4me1的表达水平依赖于细胞周期
为了观察细胞周期中LSD1活性的动态改变,采用免疫荧光共聚焦显微镜观察和分析LSD1、H3K4me2、H3K4me1在细胞周期不同节点的水平。结果显示,LSD1的荧光信号强度在复制早期(0 h和3 h)最强,随着细胞周期进展,荧光强度逐渐减弱,与之相应,代表LSD1活性的H3K4me2的荧光信号强度在复制早期(0 h和3 h)最弱,之后逐渐增强(图2A)。同时,观察到H3K4me1荧光强度在复制早期增高,随着复制的进行荧光强度降低(图2B)。Image J定量分析3次独立免疫荧光实验结果(图2C)。结果表明,LSD1蛋白的表达及活性水平与细胞周期的变化密切相关,表达与活性的峰值出现在复制早期;同时,组蛋白H3K4me2在复制早期被去除,复制中后期快速重建。

图2 LSD1活性峰值在复制早期
2.3 LSD1促进复制偶联的染色质∕核小体装配
动态组蛋白修饰对复制偶联的核小体解聚与再组装过程有重要的调节作用[8-9]。为了解LSD1是否对复制偶联的核小体装配有作用,采用MNase消化实验检测细胞中总染色质和新生染色质的核小体装配效率。MNase对裸露的DNA有切割作用,对组蛋白保护的核小体DNA则不能切割,因此该实验可以评估新生核小体的形成情况即核小体的装配效率,亦被称作染色质空间可及性分析。在U2OS细胞中敲低LSD1,加入胸腺嘧啶核苷类似物EdU(5-ethynyl-2′-deoxyuridine)标记新生DNA10 min,收集细胞,用不同条件的MNase处理等量细胞核,收集、纯化被切割的染色质DNA片段,上样至2%含EB的琼脂糖凝胶进行电泳。成像后将琼脂糖凝胶中的DNA转移至尼龙膜上,标记了EdU的DNA片段用Click反应偶联上Biotin,与HRP-Streptavidin孵育,显色曝光。结果表明,与对照相比,LSD1敲低之后,细胞中总染色质被不同条件MNase消化后的染色质片段在琼脂糖凝胶电泳中条带的带型和亮度基本一致(图3A,3B上),同时,Image J对DNA条带灰度扫描定量分析结果显示,实验组与对照组的DNA片段的数量基本一致,表明LSD1敲低对总染色质核小体装配效率影响不大(图3A,3B中);但新生染色质,即被EdU标记的染色质,在不同条件的MNase处理后,LSD1敲低组与对照组相比,DNA片段变小,且代表单核小体的DNA片段与代表多核小体的DNA片段在总DNA中占比增多(图3A,3B下,红框内),说明新生染色质裸露的DNA程度较高,更容易被MNase降解,反映出新生DNA没有及时形成核小体从而被组蛋白保护,核小体装配效率降低。为了进一步验证以上实验结果,将3B实验独立重复7次,Image J定量检测总染色质和新生染色质中代表单核小体的DNA片段。结果表明,与对照相比,LSD1敲低后,总染色质被MNase切割后生成的单核小体DNA的量基本一致,但新生染色质被切割后单核小体DNA增多1.9倍,统计学显示差异具有显著性(图3C、3D,P<0.05),表明LSD1敲低后新生DNA的核小体装配效率降低。
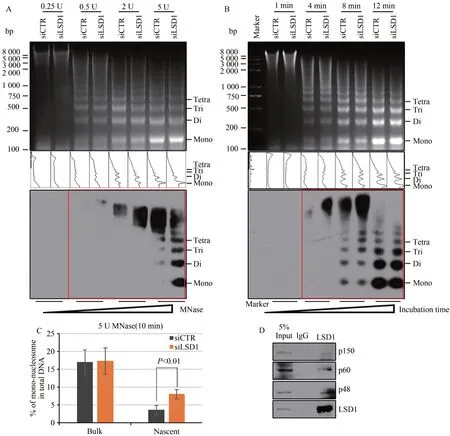
图3 LSD1促进复制偶联的染色质从头装配
LSD1与复制起始复合物的多种蛋白因子有相互作用,为了了解LSD1是否与复制偶联的核小体装配复合物CAF-1有相互作用。收集同步化于复制期的U2OS细胞,免疫共沉淀实验检测LSD1与CAF-1蛋白复合体亚基p150,p60和p48的相互作用。研究结果显示,细胞内LSD1与CAF-1复合物的亚基存在相互作用。
3 讨论
本实验室前期研究[10]已经证实组蛋白甲基化修饰的动态变化对复制起始点活化的时序和效率有调控作用,流式细胞术分析结果表明,H3K4me2∕1去甲基化酶LSD1对细胞复制有正向促进作用,与前期结论一致:LSD1在复制中发挥重要作用。
免疫荧光分析结果表明,LSD1的蛋白水平在复制早期(0 h和3 h)最高,复制中后期到G1期蛋白水平逐渐减弱,与之相应,代表LSD1活性的H3K4me2的水平在复制早期(0 h和3 h)最弱,之后逐渐增强,与H3K4me2在复制早期全基因组水平降低的前期结论一致。有趣的是,我们观察到H3K4me1水平在复制早期增高,之后水平逐步降低。H3K4甲基化的规律是1甲基化转变为2甲基化,2甲基化转变为3甲基化,去甲基化反之。由于LSD1也能够去除H3K4me1,推测H3K4me1的升高的原因,一个可能是LSD1更倾向于去除H3K4me2,另一个可能是H3K4me3在复制早期也被去甲基化酶去除[11],导致H3K4me2大量堆积。LSD1催化大量的H3K4me2去甲基化,引起H3K4me1升高;而随后H3K4me1的降低可能是H3K4me1被甲基化恢复为H3K4me2所引起。研究结果表明LSD1蛋白的表达与活性水平及细胞周期的变化密切相关,表达与活性的峰值出现在复制早期;同时,组蛋白H3K4me2在复制早期被去除,复制中后期快速重建,H3K4me2与H3K4me1修饰水平此消彼长的实验证据,支持了组蛋白修饰在生命活动中处于动态改变的事实。
已有的研究[8]表明,新生组蛋白动态修饰与复制偶联的核小体装配密切相关。作为DNA的载体,核小体本身组装∕去组装的结构动态变化对基因转录、DNA复制等生理过程非常重要,亦是表观遗传稳定传递的分子基础。由于新生组蛋白上的高乙酰化与低甲基化有利于复制核小体的装配[12],推测成熟后的亲代组蛋白上的高甲基化修饰的是否不利于复制偶联的核小体装配[13],本研究关注复制早期亲代组蛋白H3K4甲基化在全基因组水平的去除是否也与复制期染色质的重头装配有关。提出假说:复制起始前H3K4me2在全基因组水平降低除了能够促进复制起始点活化,同时能够促进复制偶联的核小体组装过程。
采用MNase消化实验,研究结果显示,与对照相比,LSD1敲低后,新生染色质的核小体装配效率降低,支持了我们的推测:H3K4me2水平需要被在一定程度上去除,从而有利于复制偶联的核小体高效装配,LSD1是H3K4me2去甲基化的重要因子,也是调节复制的重要因子。免疫共沉淀实验证实染色质装配因子(Chromatin assembly factor, CAF-1)与LSD1有相互作用,支持LSD1在染色质装配中发挥作用。由于组蛋白修饰的表观遗传也能相对准确地传递给子代细胞,由此会提出一个问题:复制早期亲代组蛋白甲基化修饰的去除如何使表观遗传传递下去?有研究者提出过“缓冲液系统”理论来解释复制期或应对内外环境刺激时染色质表观修饰改变,而在复制期结束或内外环境刺激因素消失后染色质表观修饰再恢复的生理过程[14]。“缓冲液区”是指生物体内对于组蛋白修饰等表观遗传信息的改变在一定范围内波动可以合理容忍,就像缓冲液一样,可以在一定范围维持自身的稳定。我们的合理解释是:表观遗传传递亦遵循着相似的机制,H3K4me2在全基因组水平的降低只是至一定程度,降低到该水平既有利于复制偶联的核小体装配,同时像“种子”有利于表观遗传在子代染色质上或迅速或逐渐重建[15]。
LSD1长期以来被认为与多种转录因子相互作用,通过去除与转录激活相关H3K4me2修饰,调控基因转录。本实验室前期研究表明LSD1在常染色质复制起点的激活和调控复制时序中具有重要作用。鉴于LSD1在多种不同类型的癌症中高表达[16-18],LSD1的选择性抑制剂已被开发用于癌症的治疗[19],由于LSD1参与多种生物学进程,因此帮助LSD1水平恢复正常是未来应用该抑制剂的方向[20]。本研究不仅揭示了LSD1之前未被阐明的生物学功能,同时拓宽了对表观遗传生物学功能的认知。
