药用植物青牛胆光合特性研究
2023-10-30刘三波郑思雨龚达林池莲锋欧阳圳王李林郭盛合
刘三波,郑思雨,龚达林,池莲锋,魏 民,欧阳圳,王李林,郭盛合
(1.华润三九(黄石)药业有限公司,湖北黄石 435000;2.华中农业大学,武汉 430070;3.华润三九医药股份有限公司,广东深圳 518000;4.黄石市森林植物检疫站,湖北黄石 435000)
青牛胆[Tinospora sagittata(Oliv.)Gagnep.]为多年生常绿缠绕藤本植物,是中药材金果榄的基原植物,又名九牛胆、地苦胆等。中药材金果榄味苦、性寒,归肺、大肠经,有清热解毒、利咽、止痛等功效,在民间有广泛的应用基础,用于咽喉肿痛、痈疽疔毒、泄泻、痢疾、脘腹热痛等[1-3]。现代医学临床表明,金果榄具有抗炎镇痛、抑菌、抗溃疡、治疗糖尿病、抗肿瘤等作用[4-12]。
中药材金果榄供应主要依靠野生资源,而随着其应用扩大,需求量日渐增加,野生资源不断减少,且药材质量参差不齐,进行人工栽培青牛胆已迫在眉睫。为更好地了解青牛胆的生长环境,为人工栽培提供理论支持,需要对其光合特性等开展研究。本研究旨在探究青牛胆叶位生长进程及其与叶片光合能力的关系,为青牛胆人工栽培的关键环节如间作套作、遮光等措施制定、种植区域的布局与规划等提供理论依据。
1 材料与方法
1.1 试验地概况
试验地位于湖北省恩施州利川市华润三九(黄石)药业有限公司青牛胆种植基地(30°20′N,108°59′E),海拔高度1 200 m,属亚热带大陆性季风气候,年平均气温16.7 ℃,年降水量1 400 mm,年平均日照时数1 409 h,无霜期232 d。试验地土壤pH 6.45,全氮含量4.35 g/kg,速效磷含量34.03 mg/kg,速效钾含量168.97 mg/kg,有机质含量34.28 g/kg。
1.2 材料、仪器与试剂
试验所用植株为防己科青牛胆属植物青牛胆,由华中农业大学王学奎副教授鉴定。SPAD-502 仪(日本柯尼卡美能达公司);UV-4802 型紫外可见分光光度计(美国尤尼柯公司);Li-6800 便携式光合测定仪(美国Li-Cor 公司);95%乙醇(分析纯,国药集团)。
1.3 方法
1.3.1 叶片长度测量 2021 年5 月至6 月,随机选取10 株长势一致的青牛胆植株,分别测量其不同叶位的叶片长度(叶片顶端到基部的长度),每2 d 测量1次。试验中青牛胆的叶位参照广泛使用的“倒叶”标记,即自主茎顶芽之下产生的肉眼可见的幼嫩叶片记为“倒1 叶”,向下的叶片顺序记为“倒2 叶”“倒3叶”…“倒13 叶”,分别以“-1 叶”“-2 叶”“-3 叶”…“-13 叶”表示。
1.3.2 叶片SPAD 值 随机选取10 株长势一致的青牛胆植株,采用SPAD-502 仪分别测定各植株不同叶位叶片的SPAD 值。
1.3.3 叶绿素含量测定 随机选取3 株(3 次重复)长势一致的青牛胆植株,分别在植株不同叶位的叶片中部取样。参照王学奎等[13]、袁方等[14]的方法,以95%乙醇将叶片色素提取后,使用UV-4802 型紫外可见分光光度计分别测定、计算叶绿素a、叶绿素b 含量及其相对比值。
1.3.4 光响应曲线 采用Li-6800 便携式光合测定仪测定叶片的光响应曲线。选择10 株长势一致的青牛胆叶片进行测量,控制叶室温度为25 ℃,相对湿度为70%,设定气体流速为500 μmol/s,使用CO2钢瓶将参比室的CO2浓度稳定在500 μmol/mol,利用Li-6800 LED 红蓝光源,提供不同强度的光合有效辐射,即1 800、1 500、1 200、800、600、500、400、300、200、150、100、75、50、25、0 μmol/(m2·s),测定时采用标准叶室(6 cm2),测定叶片在不同光强下的净光合速率。
1.3.5 CO2响应曲线 采用Li-6800 便携式光合测定仪测定叶片的CO2响应曲线。选择10 株长势一致的青牛胆叶片进行测量,控制叶室温度为25 ℃,相对湿度为70%,设定气体流速为500 μmol/s,将光合有效辐射设置为800 μmol/(m2·s),利用CO2钢瓶提供不同浓度的CO2,即50、100、200、300、400、600、800、1 000、1 200、1 400、1 600、1 800、2 000、2 200 μmol/mol,测定时采用标准叶室(6 cm2),测定叶片在不同CO2浓度下净光合速率。
1.4 数据处理
采用Excel、SPSS 23 等软件进行试验数据分析与处理。
2 结果与分析
2.1 青牛胆不同叶位叶片长度随生长时间的变化
青牛胆不同叶位叶片长度随时间变化情况见图1。如图1 所示,青牛胆“-1 叶”至“-13 叶“叶片生长过程中长度变化呈3 个特点,“-1 叶”至“-7 叶”叶片长度随观测时间延长而持续增加;“-8 叶”至“-11叶”叶片长度随观测时间延长的变化曲线呈“S”形;“-12 叶”“-13 叶”叶片长度随观测时间延长呈近似直线变化状态。青牛胆靠近顶芽的“-1 叶”至“-7叶”是青牛胆的幼嫩叶,这些叶片具有持续生长能力;而“-8 叶”到“-11 叶”是青牛胆植株的中部叶,叶片的伸长速度呈“S”形生长曲线,呈明显降低趋势;“-12 叶”“-13 叶”叶片长度增加不再明显,是已完成伸长生长的下部叶。结合观测结果,可初步判断“-9 叶”或“-10 叶”是青牛胆植株生长过程中叶片刚达到全展状态的叶位(即新生全展叶);青牛胆叶片在25 ℃环境条件下从新叶开始生长到达到完全展开需约17 d。
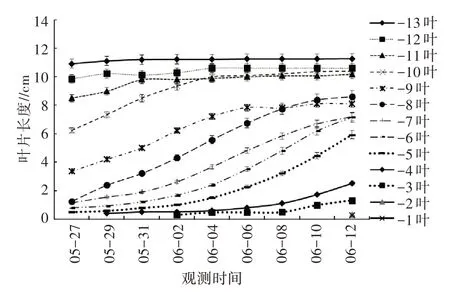
图1 不同叶位叶片长随时间变化曲线
2.2 不同叶位叶片的SPAD 值和叶绿素含量变化
2.2.1 不同叶位叶片的SPAD 值变化 由于青牛胆生长过程中靠近顶芽开始展开的2 个叶片(“-1 叶”和“-2 叶”)过小,从“-3 叶”开始测定青牛胆叶片的SPAD 值。青牛胆不同叶位叶片SPAD 值的测定结果见图2。由图2 可知,“-3 叶”至“-12 叶”的SPAD值呈2 个特征,随着叶位降低,叶片SPAD 值呈先升高后降低的趋势;青牛胆植株中部叶“-9 叶”至“-12叶”叶片的SPAD 值显著高于“-8 叶”及以上叶位叶片(P<0.05),“-12 叶”叶位叶片的SPAD 值呈下降趋势,但与“-9 叶”至“-11 叶”差异不显著。“-8 叶”以上叶位的叶为片正处于生长的叶片,“-9 叶”至“-11叶”为趋于成熟的叶片,而“-12 叶”及之后叶位的叶片为青牛胆已经成熟的下部叶。
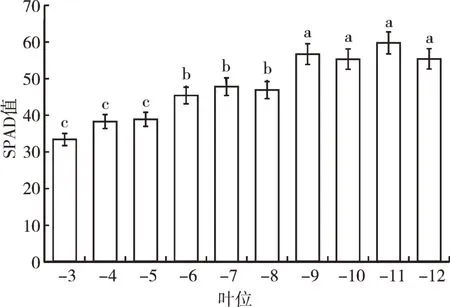
图2 青牛胆不同叶位叶片SPAD 值
2.2.2 不同叶位叶片叶绿素含量变化 由于“-1叶”至“-4 叶”叶片过小,从“-5 叶”开始研究青牛胆叶绿素含量,不同叶位叶片的叶绿素含量(叶绿素a、叶绿素b)变化见图3。由图3 可知,“-5 叶”至“-12 叶”叶绿素a 和叶绿素b 的含量变化趋势相似,均表现为中部叶位叶片的叶绿素含量高,上部叶位的叶绿素含量低,下部叶位的叶绿素呈下降趋势,“-5 叶”至“-10 叶”叶绿素a、叶绿素b 含量随着叶位自上而下的降低而增加,“-11 叶”“-12 叶”的叶绿素a、叶绿素b 含量呈下降趋势,“-10 叶”的叶绿素a、叶绿素b含量最大。这与SPAD值的测定结果基本一致。
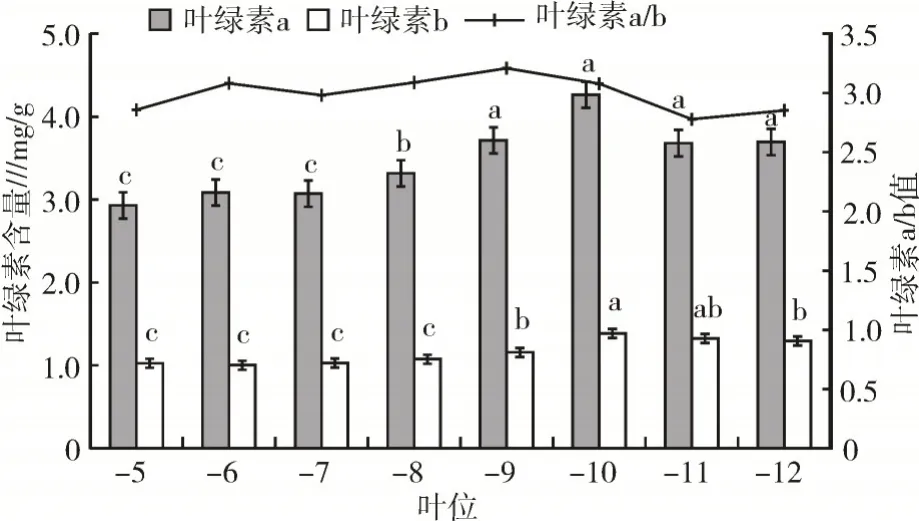
图3 青牛胆不同叶位叶片叶绿素a、叶绿素b 含量及其比值
青牛胆“-5 叶”至“-12 叶”的叶绿素a/b 见图3。由图3 可知,青牛胆不同叶位叶片的叶绿素a/b 在2.78~3.21。“-5 叶”至“-9 叶”的叶绿素a/b 值整体上呈上升趋势,比值在2.86~3.21;“-10 叶”至“-12 叶”叶绿素a/b 呈下降趋势,但差异不明显。
2.3 不同叶位叶片光响应曲线差异
青牛胆不同叶位叶片的光响应曲线见图4。由图4 可知,青牛胆不同叶位叶片在净光合速率为0 时的光照强度即光补偿点差别不大:“-8 叶”光补偿点在30.0 μmol/(m2·s)左右,“-9 叶”至“-12 叶”的光补偿点均在25.0 μmol/(m2·s)左右。青牛胆中、下部叶片的光补偿点略低于“-8 叶”叶位之前的叶片。“-8 叶”的光饱和点在700.0 μmol/(m2·s)左右,“-10叶”的光饱和点在800.0 μmol/(m2·s)左右,“-9 叶”“-11 叶”“-12 叶”光 饱 和 点 在500.0~600.0 μmol/(m2·s)。青牛胆的完全展开叶(“-10 叶”)的光饱和点高于上部和下部叶位的叶片。青牛胆不同叶位叶片在相应的光饱和点情况下,其叶片的净光合速率存在差异,具体表现为“-10 叶”[12.30 μmol CO2/(m2·s)]>“-9 叶”[10.70 μmol CO2/(m2·s)]>“-11叶”[8.95 μmol CO2/(m2·s)]>“-8 叶”[6.88 μmol CO2/(m2·s)]>“-12 叶”[4.40 μmol CO2/(m2·s)],表明中部“-10 叶”叶片的光合作用能力要强于上部幼叶和下部叶片,结合上述不同叶位叶片的SPAD 值和叶绿素含量的测定结果,可以进一步确定“-10叶”是青牛胆叶片光合能力最旺盛的全展叶位。
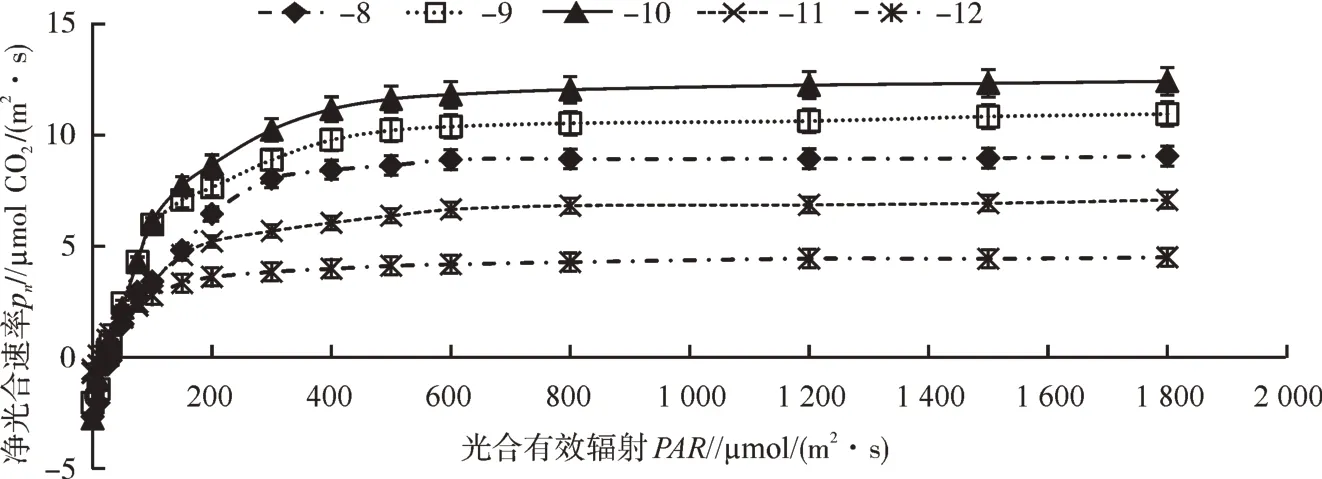
图4 青牛胆不同叶位叶片的光响应曲线
2.4 不同叶位CO2响应曲线差异
青牛胆不同叶位叶片的CO2响应曲线见图5。由图5 可知,青牛胆不同叶位叶片在净光合速率为0时对应的CO2浓度即CO2补偿点存在差异,其中“-9叶”“-10叶”的CO2补偿点在100.0~150.0 μmol/mol,“-11 叶”“-12 叶”的CO2补 偿 点 在150.0~200.0 μmol/mol。CO2饱和点随叶位的不同而存在变化,“-8 叶”“-9 叶”“-11 叶”“-12 叶”的CO2饱 和 点 在1 000.0 μmol/mol 左 右,“-10 叶”的CO2饱 和 点 在1 250.0 μmol/mol 左右。青牛胆不同叶位CO2补偿点和CO2饱和点的差异在整体上呈现中部叶对CO2的利用能力相对强于上部嫩叶和下部老叶;当CO2浓度达到1 250.0 μmol/mol 后,不同叶位叶片的光合作用速率随CO2浓度的变化曲线都趋于平缓。青牛胆不同叶位叶片的净光合速率在CO2浓度达到各自的饱和点时存在一定差异,具体表现为在CO2浓度为1 250 μmol/mol 左右时,净光合速率为“-10 叶”(17.5 μmol/mol)>“-11 叶”(14.4 μmol/mol)>“-12叶”(13.6 μmol/mol)>“-9 叶”(13.6 μmol/mol)>“-8叶”(9.4 μmol/mol),说明即使在高浓度CO2条件下,青牛胆不同叶位叶片利用CO2的能力存在较大差异,“-10 叶”在高浓度条件下利用CO2的能力明显高于其他叶位的叶片。
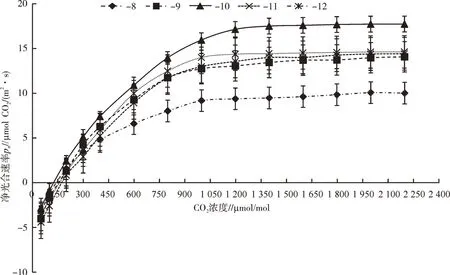
图5 青牛胆不同叶位叶片的CO2响应曲线
3 讨论
3.1 青牛胆生长过程中叶片的伸长生长特性
根据对青牛胆不同叶位叶长随时间变化的观测发现,青牛胆单个叶片的伸长过程的变化曲线呈“S”形,即在叶片刚伸出的一段时间内,其生长速度较为缓慢,一段时间后叶片生长速率加快,当叶片长度接近最大时生长速度又明显减慢,直至叶片达到全展状态,叶片从伸长生长开始到完全展开至成熟需要约17 d。
3.2 青牛胆的光合特性
本研究发现,“-10 叶”为青牛胆新生全展叶的叶位,即功能最旺盛的叶位。青牛胆功能叶叶片的叶绿素a/b 约为3,具有较高的CO2补偿点(约100 μmol/mol),与常见的C3植物华北地区冬小麦的CO2的 补 偿 点(107.1~123.4 μmol/mol)相 比 差 别 不大[15],说明青牛胆为C3植物。青牛胆新生全展叶的光补偿点约为25.0 μmol/(m2·s),高于阴生植物的光补偿点10.0 μmol/(m2·s)[16],而药用植物中比较典型的阴生植物如人参、三七的光补偿点分别为5.0~20.0 μmol/(m2·s)、5.45~10.34 μmol/(m2·s)[17,18],青牛胆的光补偿点相对较高;阴生植物如吉祥草的叶绿素a/b 约2.12[14],青牛胆并非阴生植物;但其光饱和对应的光强为800 μmol/(m2·s)左右,与常见的喜阳作物的光饱和点相比较低,说明青牛胆喜阳但不耐强光,这可能与野生青牛胆长期生长在林下、受光不足的环境有关。
对青牛胆的光合特性初步研究发现,结合青牛胆叶片的CO2响应曲线和光响应曲线的变化趋势,在人工栽培时,可在一定程度增加环境CO2的浓度或适当增大光强,可提高青牛胆的光合生产效率从而增加其生长量。青牛胆下部老叶的光合效能较低,在人工栽培过程中可通过适当摘除下部衰老叶片,提高种植密度,以达到增产的目的。青牛胆喜阳但不耐强光,在进行生产栽培时,可以将其栽种在背阳的坡地、适当遮荫或与高秆作物如玉米等进行间作、套作,更加有利于青牛胆植株的生长。
