代谢相关性脂肪性肝病患者发生明显肝纤维化的相关因素研究
2023-10-30郑烽锋邱荣仙胡震霆何雄志汤明珠
郑烽锋 邱荣仙 胡震霆 何雄志 汤明珠
代谢相关性脂肪性肝病(metabolic-associated fatty liver disease,MAFLD)是一种常见的慢性肝病,其特征是肝脏脂肪堆积超过正常范围而没有明显的酒精滥用。MAFLD 的发病率在全球范围内呈现快速增长的趋势,已成为临床上常见的肝脏疾病之一[1]。MAFLD 的主要特点是脂肪在肝脏中的异常堆积,其起因涉及多个因素,包括遗传、环境和生活方式等。常见的危险因素包括肥胖、2型糖尿病、高血压、高胆固醇血症和代谢综合征等。肥胖是MAFLD 最主要的危险因素,脂肪组织释放的脂肪酸通过门静脉系统进入肝脏,导致脂肪在肝脏内积累。此外,高血压和胰岛素抵抗等代谢异常也与MAFLD 的发展密切相关[2]。MAFLD 的流行病学数据显示,其发病率在不同国家和地区存在显著差异。在发达国家,MAFLD 的患病率约为20%~30%,在一些肥胖人群中甚至高达70%以上。此外,MAFLD 在发展中国家也呈现出快速增长的趋势,主要受生活方式和膳食结构改变的影响。MAFLD 患者中,约有10%~25%的人会进展到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH),进一步发展为肝纤维化、肝硬化甚至肝癌。MAFLD 对个体健康的影响不仅局限于肝脏,还与心血管疾病、糖尿病、慢性肾病和肥胖相关等其他代谢性疾病密切相关[3]。肝纤维化是指肝脏受损后纤维组织增生和沉积,导致肝脏结构和功能的异常改变,了解肝纤维化在MAFLD 中的重要性对于早期诊断、治疗干预和预测预后至关重要[4]。
1 资料与方法
1.1 一般资料
回顾性选择2020 年1 月—2023 年1 月莆田学院附属医院明确诊断为MAFLD 的50 例患者作为研究对象,所有研究对象都通过肝活检确诊,男性22 例,女性28 例,平均年龄(43.55±15.23)岁。本研究获得医院医学伦理委员会批准。
纳入标准:年龄>18 岁;通过肝穿刺病理检查获得明确诊断属于脂肪肝;身体质量指数(body mass index,BMI)>23 kg/m2;具有不低于2 项代谢异常风险,血压>130/85 mmHg,血浆三酰甘油水平>1.7 mmol/L,研究对象的血红蛋白110 ~140 g/L,平均(123.1±2.4) g/L,血小板(100 ~200) × 109/L,平均(148.2±2.8) × 109/L;所选患者签署知情同意书。排除标准:存在饮酒史;具有乙肝病毒、丙肝病毒感染;存在免疫性肝损伤、药物性肝损伤以及肝癌的人群。
1.2 方法
对所选50 例研究对象的一般资料进行记录和分析,总结代谢相关性脂肪性肝病患者出现明显肝纤维化的相关因素。本研究主要关注以下观察指标,包括因变量(明显肝纤维化)和自变量(可能的相关因素)。因变量:明显肝纤维化是本研究的主要因变量,通过肝活检结果进行评估和分类。根据标准纤维化评分系统如METAVIR 分级系统(METAVIR grading system),将患者的肝纤维化程度分为不同的等级,以明确肝纤维化的存在与程度。自变量:可能的相关因素包括但不限于以下因素:性别、高血压、体质量、年龄、血常规、肝功能、血脂水平。
在本研究中,分别使用血液细胞分析仪(济南爱来宝仪器设备有限公司,TEK8520)及生化分析仪(罗氏cobax8000)对代谢相关性脂肪性肝病患者进行了血常规、生化测定。
对所有MAFLD 患者的肝穿组织进行HE 染色、切片,并由2 名病理医师进行肝纤维化分期评分。肝纤维化分期是根据纤维化在肝脏中的分布和程度进行评估的。总共分为F0 ~F4 5 个阶段。F2 ~F4 阶段表示明显的肝纤维化,而F0 ~F1 阶段表示无/轻微的肝纤维化。
1.3 统计学方法
所有的统计数据通过SPSS 22.0 软件分析和处理,对计量资料通过Shapiro-Wilk 正态检验和Levene 方差齐性检验,满足正态分布和方差齐性选择参数检验方法,不满足正态分布选择非参数检验方法,采用(x-±s)表示,组间差异比较采用两独立样本t检验;对计数资料采用n(%)描述,组间差异比较采用χ2检验。危险因素分析采用单因素回归分析用于评估每个自变量与因变量之间的关系。
2 结果
2.1 明显肝纤维化与无/轻微肝纤维化血细胞计数对比
与无/轻微肝纤维化患者相比,明显肝纤维化患者的外周血中血红蛋白水平和血小板计数较低,差异有统计学意义(P< 0.05)。然而,两组白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、嗜酸性粒细胞计数和嗜碱性粒细胞计数比较,差异无统计学意义(P> 0.05),见表1。

表1 明显肝纤维化与无/轻微肝纤维化血细胞计数对比( x- ±s)
2.2 明显肝纤维化与无 / 轻微肝纤维化各项生化指标对比
伴有明显肝纤维化的患者血液中总胆红素(total bilirubin,TBA)和空腹血糖水平更高,差异有统计学意义(P<0.05)。两组转氨酶、胆红素、血脂代谢和糖化血红蛋白比较,差异无统计学意义(P>0.05),见表2。

表2 明显肝纤维化与无 / 轻微肝纤维化患者各项生化指标对比(x- ±s)
2.3 单因素回归分析代谢相关性脂肪性肝病患者出现明显肝纤维化的相关因素
本研究使用单因素回归分析方法,评估了女性、高血压、体质量、年龄、血红蛋白和血小板计数与明显肝纤维化之间的关系。以下是对回归分析结果的描述:女性、高血压、体质量、血红蛋白、血小板计数与明显肝纤维化之间存在显著关联(P< 0.05),见表3、表4。

表3 明显肝纤维化与无/轻微肝纤维化患者一般情况对比
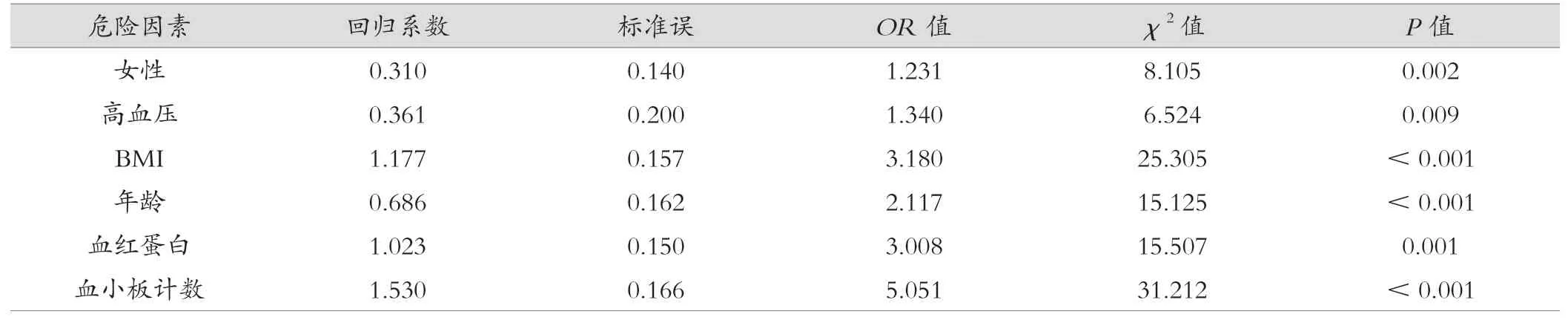
表4 单因素回归分析代谢相关性脂肪性肝病患者出现明显肝纤维化的相关因素
3 讨论
在本研究中,MAFLD 患者进行了单因素回归分析,以探究与明显肝纤维化发展相关的因素。女性患者更容易出现明显肝纤维化的情况,这一结果可能与女性在MAFLD 发展过程中的病理生理特点有关。研究表明,雌激素水平的变化可能在女性MAFLD 患者中发挥一定的保护作用,从而降低肝纤维化的风险[5]。此外,女性在脂肪分布和代谢方面可能存在与男性不同的特点,这也可能导致女性患者更易出现肝纤维化的发展。此文的研究结果为代谢相关性脂肪性肝病后期标准制定提供了借鉴内容。高血压与肝纤维化的发展密切相关,并且高血压是代谢相关性脂肪性肝病患者出现明显肝纤维化的独立危险因素。这一结果进一步强调了高血压在MAFLD 患者中的不良影响。高血压可能通过促进炎症反应、氧化应激和纤维化过程的激活,加速肝纤维化的发展。此外,高血压与其他代谢性疾病(如肥胖、糖尿病)密切相关,这些因素共同作用可能进一步增加了肝纤维化的风险[6]。身体质量指数(body mass index,BMI)与肝纤维化的严重程度增加呈正相关。这一结果与大量的前期研究一致,肥胖是MAFLD 发展和进展的主要危险因素之一[7]。肥胖可导致脂肪在肝脏中过度积累,进而引发炎症反应和纤维化过程的激活。此外,肥胖还与胰岛素抵抗、脂质代谢紊乱等代谢异常密切相关,这些因素也可能促进肝纤维化的发展。年龄与肝纤维化的发展呈显著相关。具体而言,随着年龄的增加,肝纤维化的严重程度也呈正相关。这一结果符合MAFLD 发展的自然历史过程,即随着时间的推移,肝脏受损程度逐渐加重,纤维化程度也会增加[8]。此外,年龄还与许多代谢异常和慢性炎症状态密切相关,这些因素可能在肝纤维化的发展中发挥重要作用。血红蛋白水平的降低与肝纤维化的严重程度增加呈负相关。这一结果可能与贫血对肝脏功能和纤维化过程的影响有关[9]。贫血可导致氧供应不足,进而引发肝脏缺氧和炎症反应的加剧,这些病理生理改变可能加速肝纤维化的进展。血小板计数的减少与肝纤维化的严重程度增加呈负相关。这一结果可能反映了肝脏纤维化过程中的血小板活化和消耗。在肝纤维化进程中,肝脏释放的炎症介质和细胞因子会激活血小板,导致血小板聚集和减少循环血小板的数量,因此,血小板计数的降低可能是肝纤维化发展的一个指示性标志[10]。
高血压是一种常见的慢性疾病,被认为是心血管疾病、肾脏疾病和中风等严重健康问题的主要危险因素之一,与非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的发展和严重程度密切相关,特别是在肝纤维化的进展过程中。研究表明,高血压患者中MAFLD 的患病率明显增加,且高血压与MAFLD 的共同存在使得两者的病理生理过程相互影响、相互加剧[11]。在临床实践中,对于存在高血压的MAFLD 患者,医生应当加强监测和评估肝纤维化的程度,采取积极的治疗措施,以降低患者进展到肝硬化或肝癌等严重并发症的风险。其次,高血压作为独立危险因素的确认也提示了高血压对肝脏健康的重要性[12]。肝脏是一个高血压相关疾病的重要靶器官之一,肝脏疾病也可以反过来影响和加重高血压的发展。因此,对于高血压患者,除了关注心血管并发症外,还应该重视肝脏的健康状况,并采取相应的干预措施。最后,高血压作为独立危险因素的发现为进一步研究高血压与肝纤维化之间的病理生理机制提供了基础[13]。
BMI 是衡量体质量和身高之间关系的常用指标,被广泛应用于评估肥胖程度。肥胖患者通常有较高的脂肪摄入量和脂肪合成速率,导致体内脂肪堆积增加,过多的脂肪在肝脏中积聚,超过了肝脏正常处理和代谢脂肪的能力,导致脂肪堆积在肝细胞内形成脂肪泡,这些脂肪泡激活了炎症反应和氧化应激,进而引发肝脏细胞损伤和纤维化的发展,肥胖患者往往伴随着胰岛素抵抗的发生[14]。胰岛素抵抗会导致血糖升高、胰岛素分泌增加,进一步刺激脂肪的合成和肝脏内脂肪的沉积。同时,胰岛素抵抗还会影响脂肪酸氧化和脂肪酸合成的平衡,导致脂质代谢紊乱。这些代谢异常进一步加剧了肝脏脂肪堆积和纤维化的进展。高BMI 的肥胖状态可以引发低级慢性炎症的产生,这在NAFLD 的发展过程中起到重要作用。脂肪细胞释放脂肪酸和细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和白细胞介素-6(interleukin-6,IL-6),这些细胞因子促进了肝脏炎症的形成。炎症反应激活肝脏星状细胞,产生胶原纤维,导致肝纤维化的发展。此外,炎症反应还可以进一步破坏胰岛素信号通路,加重胰岛素抵抗和脂肪沉积的发生。在NAFLD 发展的过程中,肝脏炎症反应是一个重要的事件。炎症反应激活肝脏细胞和免疫细胞释放炎症介质,如白细胞介素-1β(interleukin-1β,IL-1β)和IL-6。这些炎症介质可以直接或间接地促使血小板活化。激活的血小板会释放出一系列的生物活性物质,如血小板源性生长因子(platelet-derived growth factor,PDGF)和转化生长因子-β(transforming growth factor-β,TGF-β),它们是肝纤维化的关键调节因子。激活的血小板可以与肝脏内的多种细胞类型相互作用,包括肝细胞、肝星状细胞和肝内窦内皮细胞。这种相互作用可以通过多种机制促进纤维化的发生。此外,血小板通过与肝内窦内皮细胞的黏附和激活,促进炎症细胞的浸润和纤维化的形成。血小板不仅在炎症反应和细胞因子释放中发挥作用,还对血管生成过程有调节作用。在肝纤维化的发展中,血管生成是一个重要的事件,肝脏内新生血管的形成促进了纤维组织的形成和肝功能的恶化。血小板可以通过释放血小板源性生长因子和血管内皮生长因子等物质来刺激血管生成的过程,这些新生血管为炎症细胞和纤维化细胞提供营养和氧气,加速了肝纤维化的进展[15]。
综上所述,研究代谢相关性脂肪性肝病患者出现明显肝纤维化的相关因素具有重要的目的和意义,通过识别相关因素,可以加深对MAFLD 发展机制的理解,指导临床实践和预防管理策略,并为未来的研究提供参考和启示。
