老年脑梗死后认知功能障碍患者血清OC、ACA、Klotho蛋白变化及预后相关性
2023-10-30朱志华洪诸权
朱志华 洪诸权
急性脑梗死主要由脑部动脉粥样硬化及血栓致使脑组织血供障碍引起,可导致脑组织缺血、缺氧性坏死,从而导致神经功能损伤[1]。报道显示,脑梗死后认知功能障碍发生率可达30%左右,严重影响患者预后恢复[2]。血清学检测目前已广泛应用于脑梗死评估诊断中,其中抗心磷脂抗体(anti cardiolipin antibody,ACA)是一种可引起血液高凝状态的抗体,与缺血性脑梗死的发生密切相关;骨钙素(osteocalcin,OC)可通过血脑屏障在脑干、下丘脑中积累,与神经递质合成区域神经元特异性结合,发挥认知功能调节作用;而Klotho 蛋白可通过体液途径介导抗氧化、炎症因子表达,从而保护血管内皮功能[3]。但目前临床鲜有关于血清OC、ACA、Klotho 蛋白评估脑梗死预后相关研究,基于此,本研究试分析血清OC、ACA、Klotho 蛋白水平与老年脑梗死后认知功能障碍及预后相关性研究。
1 资料与方法
1.1 一般资料
选取泉州市第一医院2020 年8 月—2022 年8 月就诊的老年脑梗死患者200 例作为研究对象,所有患者入院后经MoCA 评分评估,200 例老年脑梗死患者中,共发生认知功能障碍68 例(认知功能障碍组),未发生132 例(非认知功能障碍组)。认知功能障碍组男性42 例,女性26例,年龄63 ~81 岁,平均(69.84±5.54)岁;身体质量指数21.8 ~26.5 kg/m2,平均(23.62±3.76)kg/m2;发病至入院时间3 ~14 h,平均(6.82±1.35)h;合并高血压35 例,高脂血症16 例,糖尿病8 例。非认知功能障碍组男性86 例,女性46 例,年龄64 ~85 岁,平均(70.36±5.38)岁;身体质量指数21.3 ~26.9 kg/m2,平均(23.81±3.55)kg/m2;发病至入院时间3 ~15 h,平均(6.69±1.43)h;合并高血压66 例,高脂血症31 例,糖尿病14 例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。
1.2 纳入及排除标准
纳入标准:均符合《中国急性缺血性脑卒中诊治指南2010》[4]中缺血性脑梗死相关诊断标准;均为初次确诊;发病后4 ~48 h 内可完成生化指标测定;对本研究均知情同意。
排除标准:入组前已接受脑梗死相关治疗者;合并全身性感染、循环系统疾病者;合并精神异常或治疗、检查依从性较差者。
1.3 方法
认知功能障碍评估:均采用蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)评估认知功能,包括语言、执行能力、抽象思维、计算等11 个检查项目,总分共30 分,其中MoCA ≥26 分评估为正常,<26 分评估为认知功能障碍,若受教育年限≤12 年则加1 分[5]。
血清指标检测方法:均采集入院时外周静脉血5 mL,并分离血清待测。采用酶联免疫吸附法测定ACA、Klotho蛋白水平,仪器选用HED-SY96S 型酶标仪,试剂盒购于武汉生源科技公司;采用放射免疫分析法测定血清OC 水平,试剂盒购于上海生工生物工程公司。所有操作均严格按照仪器及试剂盒相关说明进行。
预后评估:随访6 个月后,采用改良Rankin 量表(modified Rankin scale,mRS)评估预后,共分为6 级,其中1 级:无明显残障,可完成经常从事的活动;2 级:轻度残障,存在部分无法自我完成的活动,但可处理日常生活活动;3 级:中度残障,需给予一些帮助,可自行行走;4 级:重度残障,需他人帮助活动;5 级:严重残障,卧床不起,需他人持续护理、照顾;6 级:病死。总分6 分,其中0 ~2 分评估为预后良好,3 ~6 分评估为预后不良[6]。
1.4 观察指标
(1)比较两组血清OC、ACA、Klotho 蛋白水平及MoCA 评分。(2) 血清OC、ACA、Klotho 蛋白水平与MoCA 评分的关系。(3)比较不同预后患者血清OC、ACA、Klotho 蛋白水平。(4)血清OC、ACA、Klotho 蛋白水平对老年脑梗死预后预测价值。
1.5 统计学方法
采用SPSS23.0 统计学软件分析数据。计量资料用(x-±s)表示,行t检验,Pearson 相关系数模型行相关性分析,Logistic 回归方程分析相关影响因素,结果补roc 图预测价值,获取曲线下面积(area under curves,AUC),默认双侧检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清OC、ACA、Klotho 蛋白水平及MoCA 评分比较
与非认知功能障碍组比较,认知功能障碍组血清OC、Klotho、MoCA 评分较低,血清ACA 水平较高(P<0.05),见表1。

表1 认知功能障碍组与非认知功能障碍组血清OC、ACA、Klotho 水平及MoCA 评分比较(x- ±s)
2.2 相关性分析
经相关性分析显示,血清OC、Klotho 与老年脑梗死患者MoCA 评分呈正相关,血清ACA 与老年脑梗死患者MoCA 评分呈负相关(P<0.05),见表2。

表2 相关性分析
2.3 Logistic 回归方程分析相关影响因素
以老年脑梗死患者是否并发认知功能障碍为因变量(认知功能障碍=1,非认知功能障碍=0),血清OC、ACA、Klotho 水平为自变量(均代入实际值),行偏相关性分析,结果显示血清OC、ACA、Klotho 水平均与老年脑梗死患者认知功能障碍相关,见表3。
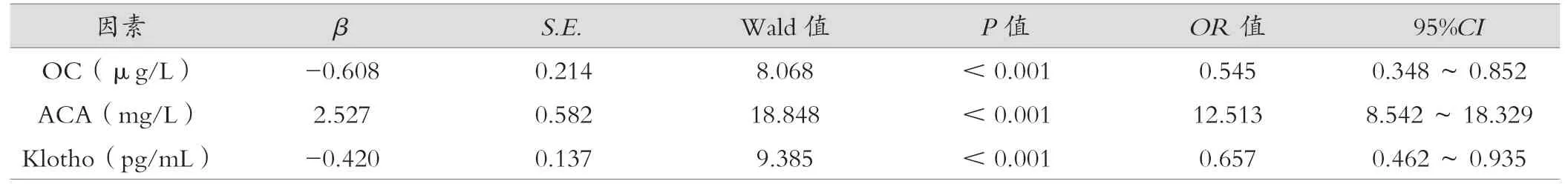
表3 Logistic 回归方程分析相关影响因素
2.4 不同预后患者血清OC、ACA、Klotho 水平比较
随访6 个月后,经mRS 评估显示,200 例老年脑梗死患者中,预后不良36 例,预后良好164 例。与预后良好患者比较,预后不良患者血清OC、Klotho 水平较低,血清ACA 水平较高(P<0.05),见表4。

表4 不同预后患者血清OC、ACA、Klotho 水平比较(x- ±s)
2.5 预测价值评估
经ROC 曲线分析结果显示,血清OC、ACA、Klotho 对老年脑梗死患者预后不良预测AUC 分别为0.832、0.795、0.856,各指标联合预测AUC 为0.927,高于单一指标预测,见表5、图1。
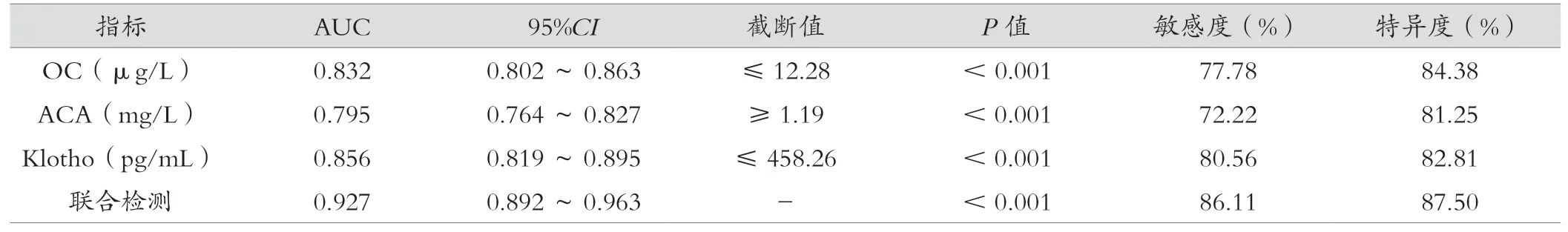
表5 预测价值评估
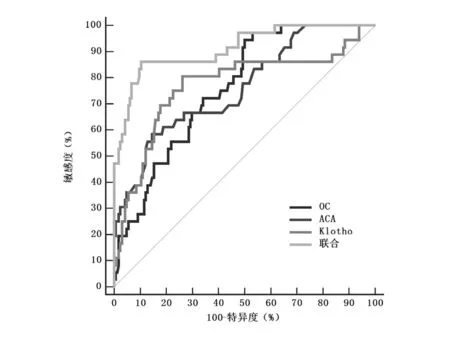
图1 ROC 曲线分析
3 讨论
脑梗死多由脑部供血动脉出现粥样硬化、血栓等引起,可导致脑组织因局部供血不足而发生坏死性病变。报道显示,随着脑血管诊疗技术不断进步,脑梗死致死率明显降低,但仍存在远期并发症;其中认知功能障碍为最常见并发症之一,严重影响患者预后恢复及生活质量[7]。因此,尽早预测评估脑梗死后认知功能障碍及预后至关重要。
相关研究结果表明,卒中后认知功能障碍与炎症反应、血管内皮损伤、氧化应激等均存在紧密联系,可通过血清学标志物进行初步评估诊断[8]。本研究结果发现,认知功能障碍组、非认知功能障碍组血清OC、Klotho、ACA 水平比较,差异有统计学意义,说明血清OC、Klotho、ACA 与脑梗死后认知功能障碍存在紧密联系。报道显示,OC 可穿过血脑屏障作用于脑干、中脑及海马区,影响与记忆、学习有关的神经递质分泌,通过诱导聚集神经元中钙离子,可抑制神经元动作电位,刺激5-羟色胺、儿茶酚胺合成,从而影响相应神经递质合成,且OC 可穿过血脑屏障与脑干、下丘脑中神经元特异性结合,改善认知功能[9]。Klotho为一种跨膜蛋白,广泛表达于肾脏、甲状旁腺及大脑脉络膜丛,具有抗氧化应激、抗炎、抗血小板聚集、保护血管内皮等生物学效应,推测Klotho 参与认知功能障碍发生的机制为Klotho 可通过一氧化氮途径减轻血管内皮损伤,患者体内低水平Klotho 导致血管内皮的保护作用减弱,从而诱发认知功能障碍,且Klotho 具有抗氧化应激效果,通过抑制活性氧产生作用,诱发神经元损伤,导致认知功能下降[10]。ACA 为一种可与磷脂结合的免疫球蛋白,可通过与内皮细胞表面产生交叉反应,激活内皮细胞,增加血小板黏附及降低纤溶活性,高表达容易引起血栓形成,血栓的形成又会阻断脑组织血流,在脑组织缺氧、缺血的影响下,导致神经功能及认知功能受损。国内学者通过分析卒中后认知功能障碍患者发现,ACA 与患者MoCA 评分呈显著负相关(r=-0.752),可用于早期预测认知功能障碍。本研究与其结果基本一致。
此外,本研究随访6 个月后发现,预后不良患者血清OC、Klotho 水平低于预后良好患者,血清ACA 水平高于预后良好患者,提示临床可通过其水平初步评估预后。报道显示,OC 可促进血管钙化,通过环形通路参与血管动脉粥样硬化及内膜增生等多种血管病理机制中,因此与脑梗死预后相关[11]。Klotho 可抑制与细胞凋亡、炎症相关的黏附分子,加剧脑梗死部位炎症反应、缺血再灌注损伤及血栓形成,导致神经细胞受损,影响患者预后恢复[12-13]。有研究显示,不同动脉粥样硬化程度患者血清ACA 水平具有差异,原因可能在于ACA 可参与粥样斑块炎症反应,促进动脉粥样硬化斑块及血栓形成、发展,引起动脉管腔狭窄[14-15]。因此,血清OC、Klotho、ACA 水平与脑梗死预后相关。基于上述研究结果,本研究尝试采用ROC 分析血清OC、Klotho、ACA 对脑梗死预后的评估价值,结果发现各指标联合预测脑梗死不良预后AUC 为0.927,具有较高预测价值。
综上所述,血清OC、Klotho、ACA 与老年脑梗死患者认知功能障碍密切相关,为临床早期预测预后提供参考,以针对性制定干预方案,改善预后。
