日粮纤维水平对梅山猪血液和肠道免疫指标的影响及其机理初步解析
2023-10-29李平会王中宇周五朵牛培培吴承武侯黎明黄瑞华李平华
李平会,蒲 广,王中宇,周五朵,3,牛培培,吴承武,侯黎明,3,黄瑞华,3*,李平华,3*
(1.南京农业大学养猪研究所(农业农村部畜禽(猪)资源评价利用重点实验室(南京)),南京 210095;2.南京农业大学淮安研究院,淮安 223001;3.江苏现代农业(生猪)产业技术体系集成创新中心,南京 210095)
麦麸是小麦加工制粉过程中的主要副产物[1],营养物质丰富,主要由非淀粉多糖、淀粉、蛋白质和木质素组成。2021年我国小麦年产量高达1.37亿吨,麦麸产量达到2 700多万吨[2],资源丰富。因此,麦麸在猪养殖中的合理利用对于降低养殖成本,缓解人畜争粮问题,以及提高我国非常规饲料资源的利用率具有重要意义。膳食纤维在维持猪的消化道的正常生理功能中具有重要的作用[3],能够改变肠道微生物群落结构[4-5],影响饲粮营养物质吸收[6],改善肠道健康[7]和调节宿主的免疫力[8]。Pu等[9]发现,在苏淮育肥猪日粮中添加适宜的纤维提高了后肠微生物的多样性和代谢能力。He等[10]研究表明,在日粮中补充发酵麦麸可显著提高杜×长×大三元杂交生长育肥猪血清免疫球蛋白水平和肠道微生物的多样性,增强机体的免疫能力。同时Luo等[11]也指出,燕麦麸对杜×长×大三元杂交生长猪的肠道健康是有益的,主要改善了结肠的肠道屏障。
梅山猪是我国太湖流域最具代表性的地方猪种,具备耐粗饲和抗逆性强的特性。许多国内外的研究[12-13]表明,与外国商品猪相比,梅山猪对许多疾病有更强的耐受性和抵抗能力。Halbur等[14]发现,与汉普夏猪和杜洛克猪相比,梅山猪更少感染猪繁殖与呼吸综合征病毒。Chen等[15]比较了梅山猪和杜×长×大三元杂交猪小肠、脾和肝等多个组织中与免疫力相关的β-防御素的表达,发现梅山猪的表达更高。Dong等[16]也发现,与杂交新生仔猪相比,梅山猪仔猪拥有更强的肠道屏障功能。前人关于日粮纤维水平对猪免疫调节的研究大多集中在外种猪,而日粮纤维对梅山猪免疫能力的影响及其相关机理的研究较少。
因此,本研究以大白猪为对照,选择梅山猪作为试验动物,旨在分析不同水平麸皮替代基础日粮对梅山猪的血常规和血液生化指标、血清免疫球蛋白和肠道黏膜SIgA浓度的影响,以及日粮麸皮对梅山猪肠道基因表达和微生物群落结构的影响,研究日粮纤维对中西方猪种免疫能力的不同调节和对梅山猪免疫机制的影响,为更科学地利用我国麦麸等非常规饲料资源进行地方猪种的健康饲养提供理论基础。
1 材料与方法
试验选取梅山猪(初始体重(67.08±1.53)kg)和与梅山猪相同生理阶段的大白猪(初始体重(81.04±1.64)kg)各28头,随机各分成4个处理组,每组7个重复,采用自动饲喂系统奥饲本(OSB Livestock Technology Co, 111 Ltd,上海,中国)饲喂试验猪只,每个重复1头猪,预试期7 d,正试期28 d,结束时将试验猪全部屠宰。预试期所有猪只饲喂相同的基础日粮,正试期4个处理组猪分别饲喂基础日粮(Basal)、7%麸皮替代基础日粮(7% WBR)、10.5%麸皮替代基础日粮(10.5% WBR)和14%麸皮替代基础日粮(14% WBR)。目前没有一个日粮配方能同时满足脂肪型梅山猪和瘦肉型大白猪两个不同类型猪种的能量需求,同时考虑到本试验是以大白猪为对照,梅山猪为试验猪,分析日粮纤维水平对梅山猪血液和肠道免疫指标的影响及其机理,因此决定先以满足梅山猪需求为主,选择猪营养需要(GB/T 39235—2020)中脂肪型生长肥育猪相关标准进行基础日粮的配制。各处理组饲粮组成除纤维水平不一致,饲粮中蛋白质、能量、钙、磷、赖氨酸、蛋-胱氨酸均进行了调平,各项指标基本一致。同时,考虑到(GB/T 39235—2020)中脂肪型生长肥育猪相关标准日粮中能量低于大白猪的需求,因此本试验设计中所有试验猪都自由采食,通过采食量来弥补能量不足问题。具体试验日粮原料组成及部分营养成分见表1,饲料原料和预混料中均未添加任何抗生素产品。

表1 日粮组成及营养水平(干物质基础)
1.2 饲养管理
本试验在南京农业大学淮安研究院试验猪场进行,每栏7头猪。试验期间,所有试验猪均自由采食和饮水,并按照猪场常规饲养管理程序对所有试验猪只进行饲养管理与免疫,定时进行猪舍的消毒与清扫,保持猪舍清洁与通风。饲养过程中全部猪都处于健康状态,没有出现疾病和腹泻问题。
1.3 指标测定
1.3.1 血液常规和血液生化指标测定 在正试验期第28天经颈静脉采集全部试验猪的血液样品,采集的抗凝血样置于4℃条件下,直接送到淮安市淮阴医院南陈集分院,使用迈瑞5300血细胞分析仪测定血液常规指标,使用贝克曼480生化分析仪测定血液生化指标;采集的不抗凝血样室温静置30 min,以3 000 r·min-1离心10 min后,吸取上层血清样品并保存在-80℃冰箱中,用于测定血清免疫球蛋白浓度。
1.3.2 血清免疫球蛋白浓度测定 上述制备的血清样品用于测定血清中免疫球蛋白A(IgA)、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)的含量,使用武汉华美猪免疫球蛋白酶联免疫试剂盒进行测定,操作步骤详见试剂盒说明书。
3)融合——融合的方向包括:通过新零售的技术手段从线上引流新会员,吸引到店消费;设立店铺微商城,让会员线上下单后店铺送货上门(主要针对店铺半径为3 km以内的会员);店铺要融合美容、化妆、美发、美甲、身体护理、保健、中医养生等项目于一体,为消费者提供全方面的服务、返店和口碑推荐的机会;
1.3.3 盲肠和结肠黏膜分泌型免疫球蛋白A(SIgA)浓度测定 在正试期第28天屠宰所有试验猪后,迅速取出肠道并剥离盲肠和结肠,无菌剪刀剪开盲肠和结肠中段,生理盐水将内容物洗去,吸水纸吸干表面多余的水分,用无菌载玻片刮取黏膜样品置于2 mL冻存管内,采样结束后,将所有样品放入-80 ℃冰箱待测。使用武汉华美猪分泌型免疫球蛋白酶联免疫试剂盒测定盲肠和结肠黏膜样品中SIgA的含量,操作步骤详见试剂盒说明书。
1.3.4 梅山猪结肠黏膜的转录组测序(RNA-seq) 按照Yeasen的RNA提取试剂盒(MolPure®Cell/Tissue Total RNA Kit)说明书中的步骤提取梅山猪结肠黏膜RNA样品,并送至武汉华大基因进行RNA-seq测序,测序流程包括RNA样品质检、文库建立、Illumina Hiseq 2500测序平台对样品进行双末端测序得到raw reads、利用Fastqc软件进行数据质控及过滤、最终获得clean reads。
1.3.5 梅山猪结肠内容物的宏基因组测序 梅山猪屠宰后,迅速剥离结肠及采样部位的肠系膜,用无菌剪刀在肠壁上剪个小孔,将内容物挤到2 mL的无菌冻存管中并放入-80 ℃冰箱保存。按照Omega Bio-Tek的DNA提取试剂盒(E.Z.N.A.®Stool DNA Kit)说明书中的步骤提取梅山猪结肠内容物的DNA样品,并送至上海美吉生物进行宏基因组测序,测序流程包括DNA质检、超声波破碎仪Covaris M220将DNA片段化、使用NEXTFLEX Rapid DNA-Seq Kit构建PE文库、使用软件Seqprep(https:∥github.com/jstjohn/SeqPrep)、Sickle(https:∥github.com/najoshi/sickle)和BWA(http:∥bio-bwa.sourceforge.net)进行数据质控、使用软件MEGAHIT(https:∥github.com/voutcn/megahit)进行拼接组装、使用MetaGene(http:∥metagene.cb.k.u-tokyo.ac.jp/)进行基因预测、使用软件CD-HIT(http:∥www.bioinformatics.org/cd-hit/)构建非冗余基因集、使用软件SOAPaligner(http:∥soap.genomics.org.cn/)进行基因丰度计算。
1.4 数据分析
通过Excel 2019软件初步整理试验数据,利用SPSS 26.0软件中的单因素方差分析(ANOVA)分析不同日粮麸皮替代水平对各指标的线性和二次方的影响;利用SPSS 26.0软件中的一般线性模型分析品种和日粮的交互作用对各指标的影响;利用R包DESeq2通过FPKM方法对基因表达量进行标准化,并分析差异表达基因(p-adjust value<0.05; |log2 (fold change)|>1);使用在线数据库KOBAS(http:∥kobas.cbi.pku.edu.cn)对差异基因进行GO和KEGG功能富集;利用上海美吉生物云平台(https:∥cloud.majorbio.com)分析宏基因组测序数据和进行相关性分析。统计分析结果以“平均值±标准误(Mean±SEM)”表示。若P<0.05表示差异显著,若P<0.01表示差异极显著。
2 结 果
2.1 不同日粮麸皮替代水平对梅山猪和大白猪血液常规和血液生化的影响
由表2和3可知,随日粮麸皮替代水平的升高,梅山猪的嗜酸性粒细胞数、嗜酸性粒细胞百分比和嗜碱性粒细胞数呈线性降低(P<0.05),血清球蛋白呈二次方变化(P<0.05);猪品种和日粮的交互作用对嗜酸性粒细胞数、嗜酸性粒细胞百分比、平均红细胞血红蛋白含量、红细胞分布宽度标准差及血清球蛋白产生显著的影响(P<0.05);值得注意的是,进一步比较两品种猪的血清球蛋白浓度发现(图1),梅山猪和大白猪的Basal组、7%和10.5% WBR组的血清球蛋白浓度差异不显著(P>0.05),但14% WBR组梅山猪的血清球蛋白浓度显著高于大白猪(P<0.05)。
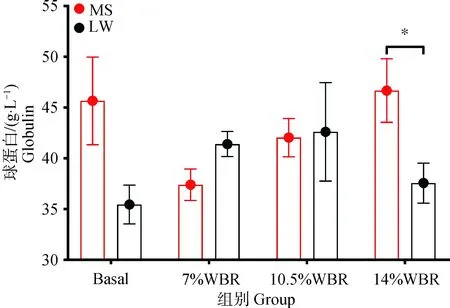
MS.梅山猪; LW.大白猪.*表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同MS. Meishan pigs; LW. Large white pigs. * means significant difference (P<0.05),** means extremely significant difference (P<0.01), the same as below图1 不同日粮麸皮替代水平对梅山猪和大白猪血清球蛋白水平的影响Fig.1 Effects of different dietary wheat bran replacement levels on serum globulin level in Meishan pigs and Large White pigs

表3 不同日粮麸皮替代水平对梅山猪和大白猪血生化指标的影响
2.2 不同日粮麸皮替代水平对梅山猪和大白猪血清免疫球蛋白的影响
由表4可知,随日粮麸皮替代水平的升高,梅山猪的血清IgA呈二次方变化,血清IgM和IgG呈线性升高(P<0.01);大白猪血清IgM呈线性和二次方变化(P<0.01);猪品种和日粮的交互作用对血清IgA和IgG产生显著的影响(P<0.05)。由图2可知,14% WBR组梅山猪的血清IgG的浓度显著高于大白猪(P<0.01)。
2.3 不同日粮麸皮替代水平对梅山猪和大白猪大肠黏膜SIgA的影响
由表5可知,随日粮麸皮替代水平的升高,梅山猪的结肠黏膜SIgA浓度极显著升高(P<0.01),且14% WBR组梅山猪的结肠黏膜SIgA浓度极显著高于Basal组和7% WBR组(P<0.01),大白猪的结肠黏膜SIgA浓度呈线性变化(P<0.05);梅山猪和大白猪的盲肠黏膜SIgA浓度不受日粮麸皮替代水平的影响。

表5 不同日粮麸皮替代水平对梅山猪和大白猪结肠和盲肠黏膜SIgA浓度的影响
2.4 Basal组和14% WBR组梅山猪的结肠黏膜RNA-seq分析
2.4.1 Basal组和14% WBR组梅山猪的结肠黏膜RNA-seq质量分析 提取Basal组和14% WBR组梅山猪的结肠黏膜RNA进行RNA-seq测序,测序完成后将原始数据进行数据过滤,每个样品得到超过6 G的clean date。测序结果见表6,Q20数据全部在96%以上,表明测序深度能满足后续分析。

表6 Basal组和14% WBR组梅山猪结肠黏膜转录组测序质量汇总
2.4.2 Basal组和14% WBR组梅山猪的结肠黏膜RNA-seq差异基因分析和PCA聚类 利用R软件包DESeq2进行差异分析,Basal组和14% WBR组梅山猪的结肠黏膜共鉴别到26 208个基因,其中38个基因在两组间差异表达,共包括7个下调基因和31个上调基因见图3A。根据各样品所有基因的FPKM值进行PCA主成分分析,Basal组和14% WBR组的组内样品较好的聚在一起,组间样品出现明显的分离见图3B,表明分组具有意义。
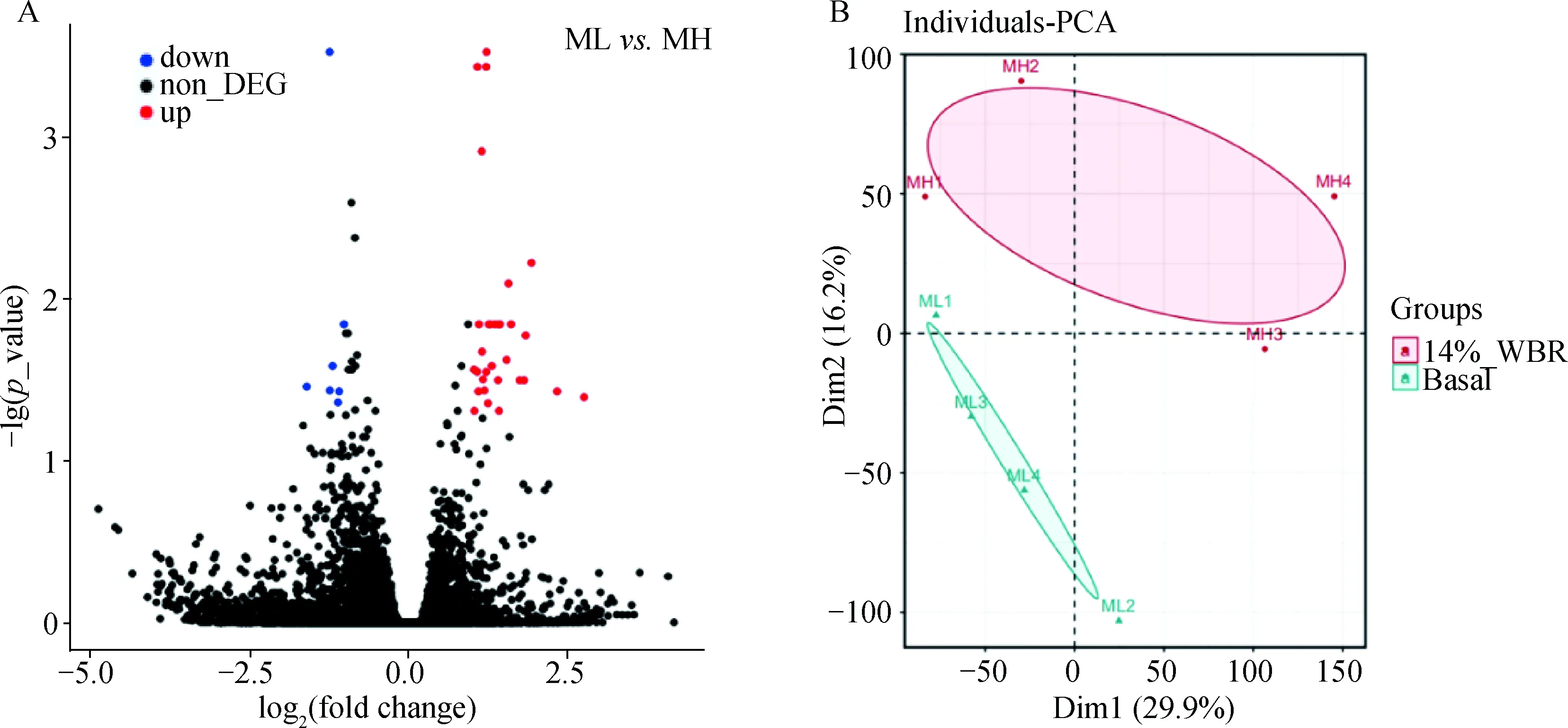
图3 Basal组和14% WBR组梅山猪结肠黏膜差异表达基因火山图(A)和PCA聚类分析(B)Fig.3 Basal group and 14% WBR group Meishan pigs colonic mucosal differentially expressed genes volcano map (A) and PCA cluster analysis (B)
2.4.3 Basal组和14% WBR组梅山猪的结肠黏膜RNA-seq差异基因功能富集 使用在线数据库KOBAS对38个差异表达基因进行GO和KEGG富集分析,GO富集分析选取细胞组分(Cellular component,CC)、分子功能(Molecular function,MF)和生物过程(Biological process,BP)三个功能层面显著富集的前15个功能条目做气泡图展示,见图4。在GO富集分析中,CC层面显著富集到的功能条目是刷状缘膜(brush border membrane)、细胞外泌体(extracellular exosome)、膜筏(membrane raft)、含胶原蛋白的细胞外基质(collagen-containing extracellular matrix)、受体复合体(receptor complex)及顶端质膜(apical plasma membrane)等;MF层面显著富集到的功能条目是蛋白质同二聚化活性(protein homodimerization activity)、层黏连蛋白结合(laminin binding)、过氧化物酶活性(peroxidase activity)及血红素结合(heme binding)等;BP层面显著富集到的功能条目是氧化还原过程(oxidation-reduction process)、细胞群增殖的调节(regulation of cell population proliferation)、免疫反应(immune response)、将螯合的钙离子释放到细胞质中(release of sequestered calcium ion into cytosol)及趋化因子介导的信号通路(chemokine-mediated signaling pathway)等。
在KEGG富集分析中,17条代谢通路被显著富集见图5,其中细胞因子与细胞因子受体相互作用信号通路(Cytokine-cytokine receptor interaction)、病毒蛋白与细胞因子和细胞因子受体的相互作用信号通路(Viral protein interaction with cytokine and cytokine receptor)、趋化因子信号通路(Chemokine signaling pathway)、原发性免疫缺陷信号通路(Primary immunodeficiency)及IgA产生的肠道免疫网络信号通路(Intestinal immune network for IgA production)是与免疫调节相关的代谢通路。结合结肠黏膜SIgA浓度变化和KEGG富集的信号通路,最终筛选出调控SIgA产生的2个候选差异基因CD4分子(CD4)和CC趋化因子受体9(CCR9),CCR9参与IgA产生的肠道免疫网络信号通路。与Basal组相比,14% WBR组显著提高了梅山猪结肠黏膜CD4和CCR9基因的表达,见图6。

图6 Basal组和14% WBR组梅山猪结肠黏膜CD4和CCR9基因表达量Fig.6 Expression of CD4 and CCR9 genes in the colonic mucosa of Meishan pigs in the Basal group and 14% WBR group
2.5 Basal组和14% WBR组梅山猪的结肠内容物宏基因组分析
2.5.1 Basal组和14% WBR组梅山猪的结肠微生物组成结构 使用群落柱形图能够直观地展示Basal组和14% WBR组梅山猪的结肠微生物群落组成。Basal组和14% WBR组梅山猪的结肠微生物结构见图7A,在门水平上,厚壁菌门(Firmicutes,相对丰度>43%)和拟杆菌门(Bacteroidetes,相对丰度>37%)是相对丰度最高的两个菌门,相对丰度之和大于80%,表明梅山猪结肠中的大部分微生物属于厚壁菌门和拟杆菌门;在属水平见图7B,优势菌属为Prevotella、unclassified_o_Clostridiales、Clostridium、Treponema、Bacteroides、unclassified_f_Lachnospiraceae、unclassified_p_Firmicutes、unclassified_o_Bacteroidales和Lactobacillus。
2.5.2 利用LEFSe分析和相关性热图筛选显著影响梅山猪免疫调节的微生物 为了找到显著影响梅山猪免疫调节的微生物,对Basal组和14% WBR组梅山猪的结肠微生物进行LEFSe分析。结果见图8,在14% WBR组显著富集5个种水平微生物(Sutterellasp.、Clostridiumsp.CAG:138、Clostridiumsp.CAG:762、Nitrospirasp.和Desulfurellalesbacterium),1个属水平微生物(unclassified_o_Desulfurellales),2个科水平微生物(Azonexaceae和unclassified_o_Desulfurellales)及1个纲水平微生物(Rhodocyclales)。为了探究肠道微生物与宿主结肠黏膜基因的互作,对体液免疫和结肠黏膜SIgA的影响,将5个种水平微生物与调控SIgA产生的2个候选结肠黏膜差异表达基因(CD4和CCR9)、血清免疫球蛋白和结肠黏膜SIgA做相关性分析,结果见图9,种水平微生物和调控SIgA产生的2个候选宿主结肠黏膜基因不存在直接互作关系(P>0.05),但Sutterellasp.、Clostridiumsp.CAG:138、Clostridiumsp.CAG:762和Nitrospirasp.与血清IgG呈显著正相关,Clostridiumsp.CAG:138和Nitrospirasp.与结肠黏膜SIgA呈显著正相关,该结果表明日粮纤维引起的肠道微生物变化不直接调控影响SIgA产生的宿主肠道基因的改变,可能通过微生物代谢产物影响机体免疫。
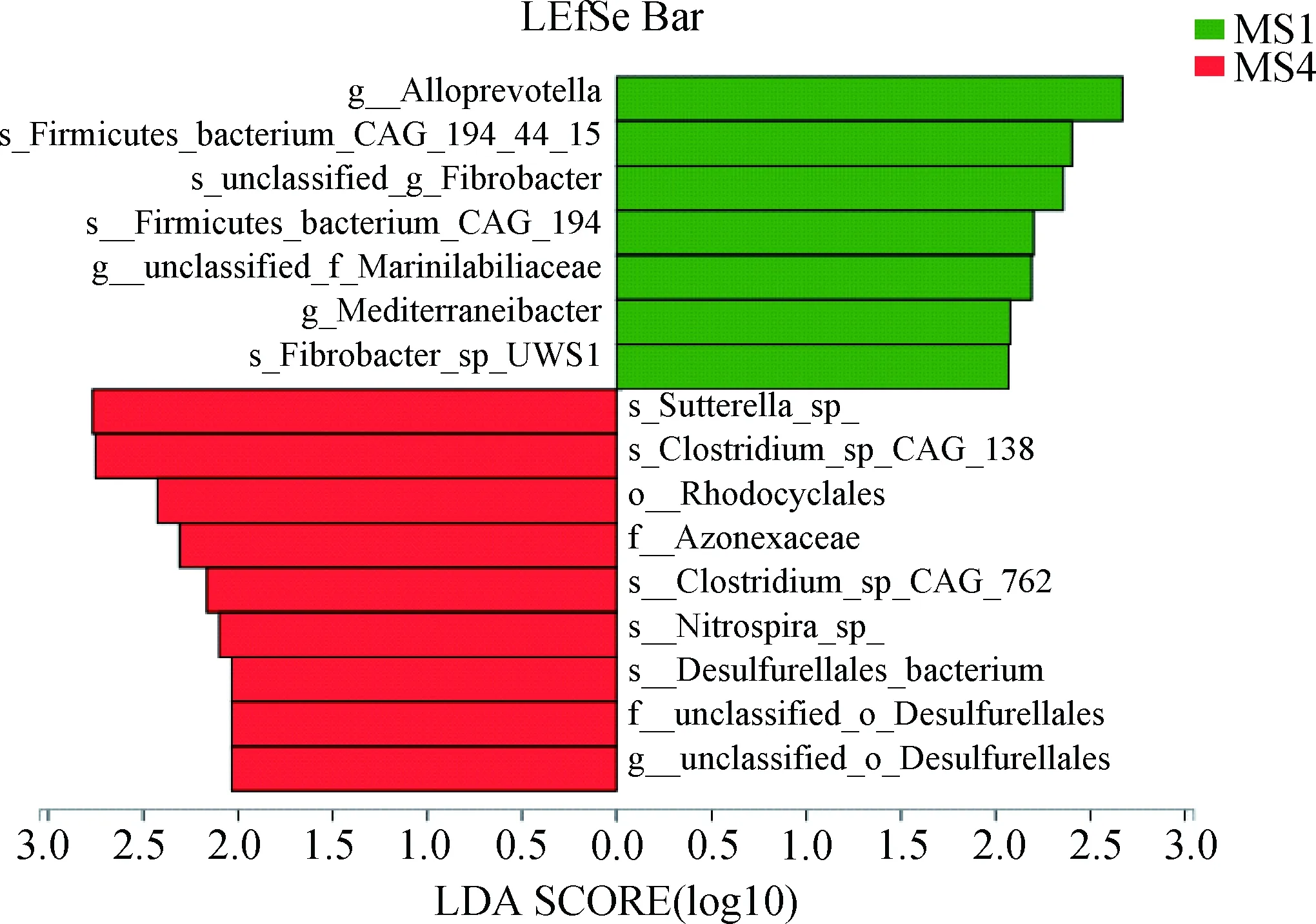
图8 LEfSe分析Basal组和14% WBR组梅山猪结肠显著富集的微生物Fig.8 LEfSe analysis of significantly enriched microorganisms in the colon of Meishan Pigs in the Basal group and 14% WBR group
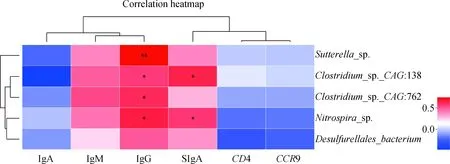
图9 14% WBR组显著富集的种水平微生物与宿主结肠黏膜基因、血清免疫球蛋白及SIgA的相关性分析Fig.9 Analysis of correlation between significantly enriched microorganisms in the 14% WBR group at the species level and host colonic mucosal gene, serum immunoglobulin, and SIgA
2.5.3 KEGG注释揭示梅山猪Basal组和14% WBR组之间与免疫调节相关代谢通路的差异 为研究Basal组和14% WBR组梅山猪的结肠微生物变化所产生的不同功能,将宏基因组数据与KEGG数据库进行注释,图10发现14% WBR组IgA产生的肠道免疫网络功能通路(intestinal immune network for IgA production)的相对丰度显著高于Basal组(P<0.05)。该结果表明14%麸皮替代基础日粮饲喂梅山猪引起改变的结肠微生物,具有增强结肠产生IgA的功能。

图10 Wilcoxon秩和检验分析Basal组和14% WBR组KEGG代谢通路的差异Fig.10 Difference of KEGG metabolic pathway between Basal group and 14% WBR group analyzed by Wilcoxon rank sum test
3 讨 论
在开展中、西方猪对比试验中,目前没有一个日粮配方能同时满足脂肪型梅山猪和瘦肉型大白猪两个不同类型猪种的能量需求。考虑到本研究是以梅山猪为试验猪,分析日粮纤维水平对梅山猪血液和肠道免疫指标的影响及其机理,大白猪作为对照组,因此试验设计以满足梅山猪能量需求为主,按猪营养需要(GB/T 39235—2020)中脂肪型生长肥育猪相关标准进行基础日粮的配制。同时,考虑到(GB/T 39235—2020)中脂肪型生长肥育猪相关标准日粮中能量低于大白猪的需求,试验中安排猪自由采食,通过采食量来弥补能量不足问题。Hakansson等[17]和Ramaekers等[18]的研究中发现,自由采食的饲喂方式能让动物通过采食量补充能量摄入。最后,本试验期间大白猪的生长性能正常,基础日粮下,大白猪的日增重是826.44 g·d-1,采食量是3.05 kg·d-1(数据来自本团队另外一篇投稿文章,尚未发表),与文献报道的数据接近[19-21],综合反映了通过自由采食可以弥补大白猪能值摄入不足的问题,也间接证明了本试验设计的合理性。
血常规和血生化指标在很大程度上反映动物机体的健康状况[22]。本试验中,梅山猪和大白猪的血常规和血生化的所有指标都在正常范围内,同时,在饲养过程中所有猪只均无腹泻和明显异常,表明全部试验猪总体处于健康状态。嗜酸性粒细胞和嗜碱性粒细胞是在骨髓中发育成熟,都属于白细胞的组成部分,它们在血液中的数量变化可以反映机体的炎症状态[23]。研究发现,机体嗜酸性粒细胞数的升高与过敏和传染病等疾病相关,且与疾病的严重程度呈正相关[24]。也有研究表明,嗜酸性粒细胞和嗜碱性粒细胞主要在发生炎症的器官和组织内被招募,同时被激活释放大量的炎症介质[25]。本研究发现,随日粮中麸皮替代比例的增加降低了梅山猪血液中嗜酸性粒细胞数、嗜酸性粒细胞百分比和嗜碱性粒细胞数,该结果表明日粮中添加麸皮降低了梅山猪机体的炎症水平。
血清球蛋白是机体除血清白蛋白外所有蛋白质的总称,血清球蛋白水平升高的主要原因是血清免疫球蛋白水平的升高[26]。本研究比较了梅山猪和大白猪的血清球蛋白浓度,发现Basal组、7%和10.5% WBR组没有显著差异,但14% WBR组梅山猪的血清球蛋白显著高于大白猪。为研究14%的麸皮替代基础日粮是否增加梅山猪的血清免疫球蛋白水平,本研究测定了梅山猪血清中免疫球蛋白的浓度。血清免疫球蛋白是体液免疫的主要组成部分,是反映机体免疫功能的重要指标,包括IgG、IgA、IgM、IgD和IgE[27]。IgG是血清抗体的主要组成部分,是机体抗感染的“主力军”,参与各项免疫防御机制;IgA的含量仅次于IgG,主要发挥局部免疫作用;IgM是机体最早合成和分泌的抗体,也是机体初次应答最早出现的抗体[28-29]。He等[10]研究表明,在日粮中补充发酵麦麸可显著提高生长育肥猪血清IgM和IgG的水平。Shang等[30]也报道基础日粮中添加麦麸显著增加了猪血清中IgG、IgA和IgM的浓度。本研究发现随日粮麸皮替代水平的升高,梅山猪的血清IgM和IgG以及大白猪的血清IgM浓度显著增加,与前人的研究结果类似。本研究进一步比较了梅山猪和大白猪品种间的血清IgG浓度,发现14% WBR组梅山猪显著高于大白猪,该结果表明麦麸替代部分基础日粮改善了梅山猪和大白猪的体液免疫,且日粮麸皮对梅山猪免疫力的增强优于大白猪。
单胃动物的大肠是消化纤维的主要场所[31],因此后肠的健康对动物的生长性能和整体健康至关重要[32]。肠道黏膜由肠上皮、肠相关淋巴组织和覆盖在上皮的黏液组成,在维持肠道屏障保护中起重要作用[33]。IgA是黏膜免疫系统中含量最多的抗体,是组成SIgA的二聚体IgA的单体,绝大多数SIgA由肠道产生,并在原位产生效应[34]。SIgA类抗体构成了抗原特异性免疫防御的第一道防线,能维持肠道共生微生物之间的平衡,防止黏膜表面的病原体进入机体及促进肠道内稳态[34-35]。在本试验中,14%的麸皮显著增加了梅山猪结肠黏膜的SIgA浓度,大白猪的没有显著变化,表明14%的麸皮日粮增强了梅山猪结肠的黏膜免疫力。Dong等[16]报道与外种猪相比,梅山猪拥有更强的肠道屏障功能,这可能是梅山猪能在短时间内提高肠道免疫系统适应日粮中纤维增加的原因。为了探究日粮纤维对梅山猪结肠黏膜免疫的影响,本研究利用转录组和宏基因组测序技术从宿主结肠黏膜基因和肠道微生物两个层面进行机制解析。通过转录组测序在梅山猪Basal组和14% WBR组鉴别到38个结肠黏膜差异表达基因,对这38个差异表达基因进行GO和KEGG功能富集。在GO的三个功能层面富集中,细胞组分(CC)和生物过程(BP)富集的功能条目最多,主要与细胞信号转导(细胞外泌体(extracellular exosome))、细胞增殖(细胞群增殖的调节(regulation of cell population proliferation))和免疫系统(免疫反应(immune response))等相关,表明麸皮主要通过调控梅山猪肠上皮细胞的增殖影响肠道免疫。在KEGG富集中,显著富集到5条与免疫调节相关的代谢通路:细胞因子与细胞因子受体相互作用信号通路、病毒蛋白与细胞因子和细胞因子受体的相互作用信号通路、趋化因子信号通路、原发性免疫缺陷信号通路及IgA产生的肠道免疫网络信号通路,该结果进一步证明麸皮对梅山猪结肠黏膜免疫系统的调节作用。其中,IgA产生的肠道免疫网络信号通路是参与调控SIgA产生的通路。CCR9是肠道黏膜趋化因子受体,对于肠道黏膜免疫的发展和维持有重要作用[36],并且参与刺激“IgA产生的肠道免疫网络信号”通路中IgA+B细胞的肠道归巢,IgA+B细胞最终在肠道固有层分化形成能产生IgA的浆细胞[37]。CD4分子是主要表达于T细胞、巨噬细胞和树突状细胞表面的一种单链跨膜糖蛋白[38],在免疫应答中具有增强T淋巴细胞与靶细胞结合、促进T细胞激活启动免疫应答和作为T淋巴细胞表面的标记性糖蛋白辅助产生记忆细胞的功能[39-40]。本研究中,14%的麸皮显著上调了梅山猪结肠黏膜与免疫调节相关的基因CD4和CCR9的表达,该结果暗示14%的麸皮改善了梅山猪结肠的黏膜免疫,并且通过上调参与“IgA产生的肠道免疫网络信号通路”中的CCR9基因,产生更高水平的SIgA,增强了结肠黏膜免疫屏障,促进肠道健康。
宿主免疫系统和肠道微生物之间的相互作用非常重要,宿主免疫系统可以调节肠道微生物的结构和组成[41],同时肠道微生物也能影响黏膜免疫系统的发育和功能[42]。本研究中发现梅山猪结肠微生物相对丰度最高的两个门水平微生物是Firmicutes和Bacteroidetes,与Xu等[43]在梅山后备母猪和Jiang等[44]在梅山断奶仔猪中的研究一致。Firmicutes和Bacteroidetes代表了健康胃肠道中的两个主要门[45-46],在肠道微生物发酵和维持微生态平衡中起着重要作用。在属水平,梅山猪结肠的优势菌属为Prevotella、unclassified_o_Clostridiales、Clostridium和Treponema等,与前人的研究基本一致[43]。Basal组和14% WBR组梅山猪的结肠微生物进行LEFSe分析,Sutterellasp.、Clostridiumsp.CAG:138、Clostridiumsp.CAG:762、Nitrospirasp.和Desulfurellalesbacterium5个种水平微生物在14% WBR组显著富集。其中Sutterellasp.是革兰阴性菌,具有调节黏膜代谢和肠道上皮完整性的功能,并且能起到免疫调节的作用[47]。Clostridium是革兰阳性厌氧菌,具有多种代谢功能,包括将淀粉、蛋白质和嘌呤转化为乙酸、丁酸和乳酸等对机体健康有益的有机酸[48]。研究发现,肠腔中的Clostridium能通过诱导结肠黏膜的调节性T Cell维持免疫稳态,属于Clostridium的簇IV和XIVa也与维持黏膜稳态和预防炎症性肠病相关[49]。Clostridiumsp.CAG:138和Clostridiumsp.CAG:762都属于Clostridium,但这两个菌株的功能还没有明确的报道。Nitrospirasp.属于Nitrospira,后者通常作为硝化细菌,发挥的主要作用是参与氮循环及将亚硝酸盐氧化成硝酸盐,主要在污水处理[50]和生态系统[51]中研究较多,与免疫功能相关的研究鲜有报道。种水平差异微生物和筛选出的调控SIgA产生的2个候选宿主结肠黏膜差异表达基因(CD4和CCR9)的互作分析发现肠道微生物和调控SIgA产生的宿主结肠黏膜基因之间不存在直接互作关系,但Sutterellasp.、Clostridiumsp.CAG:138、Clostridiumsp.CAG:762和Nitrospirasp.与血清IgG呈显著正相关,Clostridiumsp.CAG:138和Nitrospirasp.与结肠黏膜SIgA呈显著正相关。同时KEGG功能注释结果发现14% WBR组IgA产生的肠道免疫网络功能通路的相对丰度显著高于Basal组。该结果表明,14%的麸皮优化了梅山猪的结肠菌群结构,增强微生物产生IgA的功能,促进结肠健康。
4 结 论
4.1日粮中添加麸皮可以降低梅山猪机体的炎症水平和增强体液免疫,并且添加14%的麸皮对梅山猪的促进效果优于大白猪。
4.2日粮中添加14%的麸皮上调了调控SIgA产生的2个候选结肠黏膜基因CD4和CCR9的表达,增强梅山猪IgA产生的肠道免疫网络功能通路,提高肠腔SIgA的水平,有助于改善肠道屏障功能,促进机体健康。
4.3日粮中添加14%的麸皮优化了梅山猪的肠道菌群结构,Sutterellasp.、Clostridiumsp.CAG:138、Clostridiumsp.CAG:762和Nitrospirasp.可能是增强梅山猪免疫功能的重要菌株。
