非洲猪瘟病毒基因Ⅰ型的双重实时荧光定量PCR检测方法建立
2023-10-29邱英武宋泽布林丽苗曹雪珍周庆丰张桂红李群辉郑泽中
常 昊,邱英武,彭 杰,高 琦,宋泽布,陈 洋,5,李 薇,林丽苗,曹雪珍,周庆丰,张桂红,李群辉*,郑泽中*
(1.华南农业大学兽医学院非洲猪瘟防控技术研究中心,广州 510642;2.温氏食品集团股份有限公司 广东省畜禽健康养殖与环境控制企业重点实验室,云浮 527400;3.国家非洲猪瘟区域实验室(广州),广州 510642;4.广东省动物源性人兽共患病预防与控制重点实验室,广州 510642;5.岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525000)
非洲猪瘟(African swine fever ,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染家猪与野猪引起的高度传染性出血性疾病,致死率高达100%。1921年,ASF首次在肯尼亚被报道[1],并于2018年传入我国,随后蔓延至全国范围内且持续至今[2]。
ASFV基因组为线性、双链DNA,全长约170~193 kb,编码 150~171个开放阅读框(ORFs)[3]。编码ASFV衣壳蛋白P72的B646 L基因较为保守,常被用做ASFV检测中的靶基因[4]。EP402R基因编码ASFV的CD2v蛋白是ASFV的重要抗原之一,同时CD2v蛋白的细胞质区被认为是一种新的遗传标记[5]。
目前中国以基因型Ⅱ ASFV(GenotypeⅡ ASFV)流行为主,随着低毒力的基因Ⅰ型ASFV(GenotypeⅠ ASFV)在国内被报道[6],使得ASF的监测、预防和控制更具挑战性。为有效针对ASFV进行诊断以及GenotypeⅠ、GenotypeⅡ 的鉴定,本研究使用中国动物疾病预防控制中心(CADC)推荐的B646L引物与探针,并针对GenotypeⅠ EP402R基因保守特异性区域设计引物与探针,建立了一种在诊断ASF的同时可进行GenotypeⅠ ASFV鉴别的快速检测方法。
1 材料与方法
1.1 材料
1.1.1 病毒、质粒与临床样品 Genotype Ⅰ ASFV、Genotype Ⅱ ASFV、猪繁殖与呼吸综合征病毒(PRRSV)、猪流感病毒(SIV)、猪圆环病毒Ⅱ型(PCV-2)、猪伪狂犬病病毒(PRV)、pUC57-B646 L质粒由本实验室保存,连接有GenotypeⅠ ASFV EP402R基因保守特异性区域的质粒pMD18-T-ASFV-EP402R由擎科生物技术有限公司完成合成与测序。526份临床样品(口拭子263份,肛拭子95份,抗凝血146份,扁桃体22份)来自华南地区生猪养殖场。
1.1.2 主要试剂与仪器 MagaBio plus 病毒DNA/RNA纯化试剂盒Ⅳ、博日NPA-32P核酸提取纯化仪(杭州博日科技股份有限公司);PrimeScriptTM RT reagent Kit with gDNA Erase试剂盒(上海金畔生物科技有限公司);real-time PCR 2×AceQ Universal U kit+Probe Master Mix V2 PCR 检测试剂盒(南京诺唯赞生物科技股份有限公司);ExCycle-48 real-time PCR仪。
1.2 方法
1.2.1 病毒核酸的提取 对Genotype Ⅰ ASFV、Genotype Ⅱ ASFV、PRRSV、PCV、PRV及临床样品进行病毒核酸提取。
1.2.2 引物的设计与合成 B646L引物与探针使用CADC推荐使用的B646L引物与探针序列进行合成。
使用Primer5.0软件针对在NCBI中筛选的40条 GenotypeⅠ ASFV EP402R基因保守特异性区域设计引物与探针,所有引物和探针均由Thermo公司(Thermo Fisher Scientific, Waltham, MA, USA)合成。引物与探针相关信息见表1。

表1 引物与探针

表2 临床样品检测结果
1.2.3 双重实时荧光定量PCR反应体系的建立 以1.06×105copies·μL-1的EP402R阳性质粒与1.07×105copies·μL-1的B646L阳性质粒1∶1等体积混匀作为模板,体系及反应条件参考real-time PCR 2×AceQ Universal U kit+Probe Master Mix V2 PCR试剂盒说明书,通过改变加入反应体系中两对引物与探针的体积,使两对引物终浓度分别为0.2、0.4、0.8 μmol·L-1三个梯度;两对探针终浓度分别为50、100、150 nmol·L-1三个梯度进行试验,筛选出引物与探针最优浓度。
1.2.4 ASFV EP402R基因检测通道标准曲线建立及灵敏性检测 10倍梯度稀释pMD18-T-ASFV-EP402R质粒标准品(1.06×101~10copies·μL-1),使用“1.2.3”优化反应体系进行试验,ddH2O为阴性对照,设计3次重复。依据扩增曲线检验该方法的灵敏度并根据测得的Ct值以及EP402R基因的拷贝数绘制标准曲线。
1.2.5 双重荧光定量检测方法的特异性检测 以pMD18-T-ASFV-EP402R为阳性对照,GenotypeⅠ ASFV、GenotypeⅡ ASFV、GenotypeⅠ+GenotypeⅡ ASFV、PRRSV、PCV、PRV核酸为模板,ddH2O为阴性对照,使用“1.2.3”反应体系进行特异性检测。
1.2.6 临床样品的检测 使用本研究建立的双重实时荧光检测方法与世界动物卫生组织(OIE)推荐使用的方法对在华南地区526份送检样品进行检测。
2 结 果
2.1 双重实时荧光定量PCR反应体系的建立
根据对反应体系优化试验的结果可知,EP402R基因与B646L基因的引物最适终浓度均为0.2 μmol·L-1,EP402R基因与B646L基因的探针最适终浓度均为100 nmol·L-1,故确定双重实时荧光定量体系如下:
总体系20 μL:2×AceQ Universal U kit+Probe Master Mix V2 PCR 10 μL,EP402R-R、EP402R-F各0.4 μL,EP402R-Probe 0.2 μL,EB646L-R、B646L-F各0.4 μL,B646L-Probe 0.2 μL,模板2 μL,加ddH2O补足至20 μL。

图1 B646L实时荧光定量PCR不同引物、探针浓度扩增结果Fig.1 Real-time PCR amplification results of B646L with different primers and probe concentrations
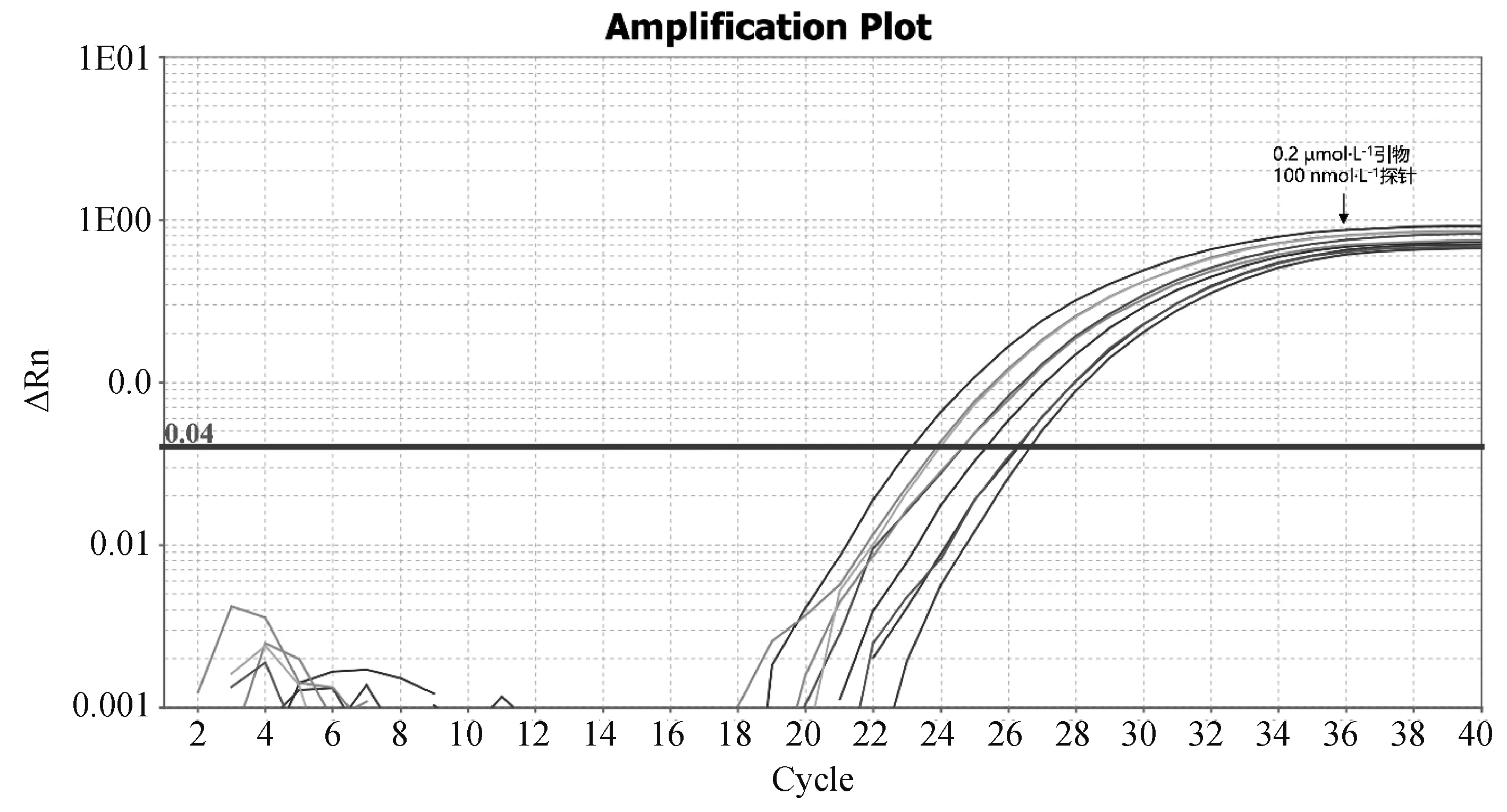
图2 EP402R实时荧光定量PCR不同引物、探针浓度扩增结果Fig.2 Real-time PCR amplification results of EP402R with different primers and probe concentrations
2.2 针对ASFV EP402R基因检测方法的灵敏性检测
根据扩增曲线可知,该方法的检测底限为1.06×101copies·μL-1,表明灵敏度较好。
根据“1.2.4”测得的Ct值以及EP402R基因的拷贝数进行标准曲线的绘制。结果显示,在1.06×101~1.06×1010copies·μL-1范围内,相关系数为0.988 8(介于0.95~1.05之间),表明存在良好的线性关系。
2.3 双重荧光定量检测方法的特异性试验
该检测方法的特异性结果显示,FAM通道的GenotypeⅠ、GenotypeⅡ、GenotypeⅠ+GenotypeⅡ ASFV的混合样品和VIC通道中的GenotypeⅠ、GenotypeⅠ+GenotypeⅡ ASFV的混合样品均可显示出扩增曲线。结果表明,该方法具有良好的特异性,且不与其他常见猪源病毒核酸发生交叉反应。
2.4 临床样品检测试验
使用本方法对526份送检临床样品进行检测,检出4份ASFV阳性样品,其中1份为GenotypeⅠ。
3 讨 论
当前的ASFV检测技术主要分为两大类:针对病毒DNA的核酸检测技术;针对病毒抗原、抗体反应的免疫学技术。由于针对抗体的检测方法具有一定的滞后性[7],因此能够在ASFV感染早期快速检测病毒核酸的qPCR检测的方法成为了主流。
随着GenotypeⅠ ASFV在我国流行,Gao等[8]基于CADC推荐使用的ASFV B646L的引物与探针以及针对E183L设计的引物与探针建立了鉴别GenotypeⅠ与 GenotypeⅡ ASFV的检测方法,并验证了CADC推荐使用的ASFV B646L基因引物与探针具有良好的特异性、重复性以及检测底限为1.07×102copies·μL-1的较强灵敏度。本研究针对GenotypeⅠ ASFV EP402R基因保守特异性区域设计的引物与探针同样具有良好的特异性以及重复性,检测底限为1.06×101copies·μL-1,对GenotypeⅠ ASFV检测更为灵敏。此外,通过本研究建立的检测方法对526份送检临床样品进行检测,检出4份ASFV阳性,结果与世界动物卫生组织(OIE)推荐使用的方法结果一致,并且其中1份为 GenotypeⅠ ASFV。结果表明本研究建立的双重荧光实时定量PCR检测方法具有高灵敏性和高特异性,可有效用于ASFV的临床诊断以及GenotypeⅠ ASFV的监测。
4 结 论
本研究通过针对使用中国动物疾病预防控制中心(CADC)推荐使用的B646L引物与探针,结合针对GenotypeⅠ ASFV EP402R基因保守特异性区域设计引物与探针,建立了一种在诊断ASF的同时可对ASFV进行GenotypeⅠ ASFV鉴别的快速检测方法。通过试验确定了EP402R基因与E646L基因的引物最适终浓度均为0.2 μmol·L-1,EP402R基因与E646L基因的探针最适终浓度均为100 nmol·L-1,并且经试验证明了EP402R引物具有检测底限为1.06×101copies·μL-1的灵敏性以及良好的特异性,可有效地用于GenotypeⅠ ASFV的检测与监测。
