苦参碱联合不同抗生素抗炎作用比较研究
2023-10-29孙盼盼曹志刚凌小雅孙耀贵李宏全
孙盼盼,曹志刚,凌小雅,孙 娜,孙耀贵,李宏全
(山西农业大学动物医学学院 中兽医药现代化山西省重点实验室,太谷 030801)
细菌与病毒的混合感染在猪呼吸道疾病综合征(porcine respiratory disease complex,PRDC)中普遍存在,与单一病原体感染相比,这可能对猪群的健康构成更大的威胁,也给疾病的治疗带来挑战[1-2]。猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是一种重要的呼吸道疾病病原体,猪感染PRRSV后以出现免疫抑制为特点,常与其他猪病混合感染或者继发感染。已有的研究报道,PRRSV和脂多糖(lipopolysaccharide,LPS)共感染仔猪能够诱导仔猪肺部强烈的炎症反应,诱导IL-1和TNF-α等炎症因子的高表达[3]。PRRSV与LPS协同作用显著增加猪肺泡巨噬细胞(porcine alveolar macrophage,PAMs)中IL-1β和TNF-α的分泌[4]。副猪嗜血杆菌感染可增强高致病性PRRSV感染介导的炎症反应,IL-1β、IL-18、IL-6和TNF-α的分泌显著升高[5]。中兽医药现代化山西省重点实验室前期在PAMs上通过转染PRRSV 5′UTR RNA或单独使用LPS刺激,发现PRRSV 5′UTR RNA和LPS共刺激能够诱导PAMs产生强烈的炎症反应,IL-1β、IL-6、IL-8和TNF-α的表达显著升高;以PRRSV 5′UTR RNA和LPS共刺激PAMs为炎症模型,证明苦参碱可通过抑制MyD88/NF-κB信号通路以及NLRP3炎症小体的激活来抑制IL-1β的产生,从而发挥抗炎作用[6]。
抗生素具有抗菌、保健和促生长等作用[7-9],但是随着兽药残留、细菌耐药性和畜禽产品质量不合格等问题的出现,减抗、替抗迫在眉睫。目前,国内外替代饲用化学品的相关研究主要集中在中兽药、植物源性提取物、微生态制剂和酶制剂等[10-11]。本试验选择5种临床上常用的兽用抗生素:阿莫西林、金霉素、盐酸多西环素、氟苯尼考和替米考星[12],以PRRSV 5′UTR RNA和LPS共刺激的PAMs为炎症模型,IL-1β为检测指标,从中筛选出与苦参碱具有相似抗炎作用的抗生素,然后通过与苦参碱的联合使用,确定与苦参碱具有交互作用的抗生素,以期为苦参碱作为抗生素替代物的研发提供依据。
1 材料与方法
1.1 药物
本试验所用药物相关信息见表1。
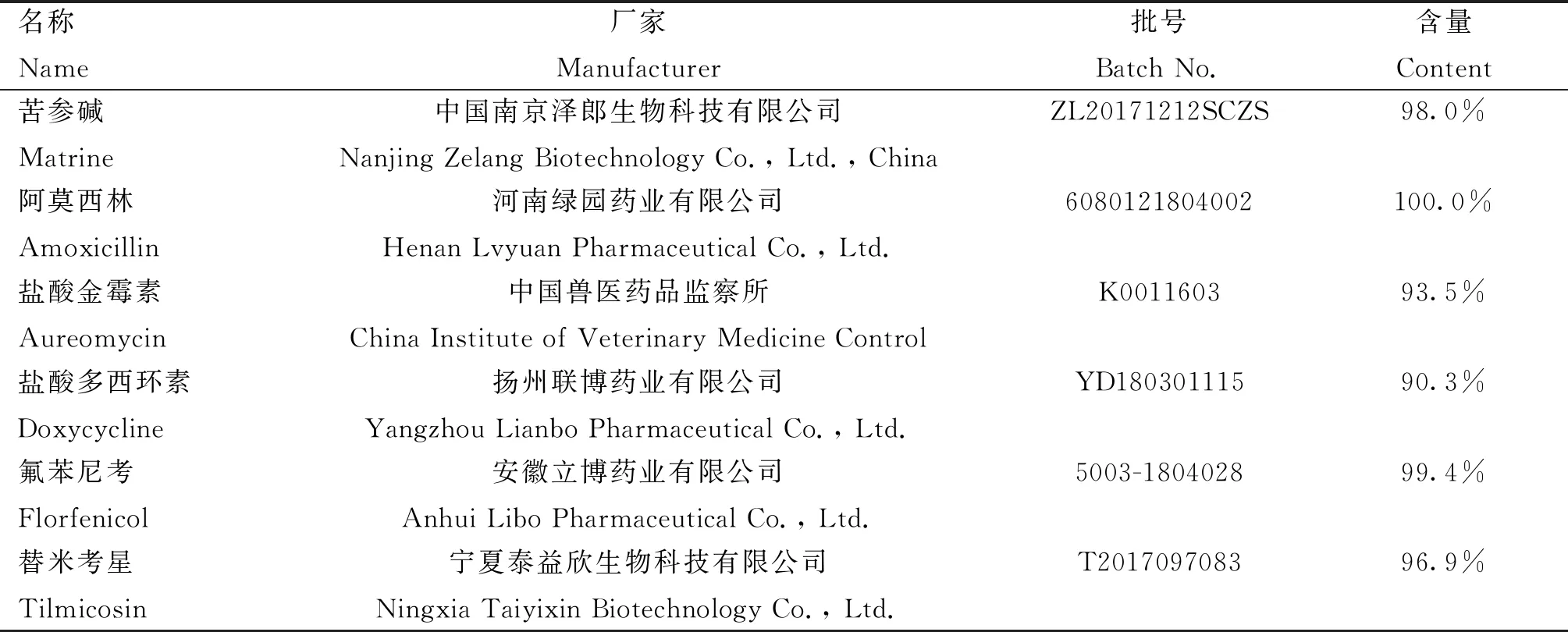
表1 本试验涉及药物相关信息
1.2 主要试剂与仪器设备
主要试剂:RPMI 1640培养基购自美国Gibco,胎牛血清(FBS)购自以色列BI(Biological Industries),转染试剂购自德国QIAGEN,TRIzol和反转录试剂盒购自中国TaKaRa,2×SYBR Green Low ROX qPCR Master Mix、蛋白酶抑制剂和磷酸酶抑制剂购自中国Bimake,RIPA裂解液(强)和增强型蛋白浓度测定试剂盒购自中国碧云天,DH-5α感受态细胞和普通琼脂糖凝胶DNA回收试剂盒购自中国TIAIVGEN,线性化纯化试剂盒购自美国Omega,MEGAclearTMKit Purification for Large Scale Transcription Reactions购自美国ThermoFisher Scientific,RiboMAXTMLarge Scale RNA Production Systems-SP6 and T7试剂盒购自美国Promega。
主要仪器设备:倒置显微镜(Olympus,日本)、CO2培养箱(Heal force,中国)、核酸蛋白浓度测定仪(NanoDrop,美国)、ABI 7500定量PCR仪(ABI,美国)、离心机(Sigma,德国)、电泳仪和凝胶成像系统(Bio rad,美国)、恒温振荡培养器(上海智城,中国)。
1.3 细胞毒性试验
1.3.1 不同抗生素在PAMs上的细胞毒性 原代PAMs由中兽医药现代化山西省重点实验室提取冻存[6]。复苏原代PAMs接种至96孔细胞培养板中培养24 h后,分别用DMSO溶解阿莫西林、金霉素、盐酸多西环素、氟苯尼考和替米考星,用细胞维持液(2% FBS)连续2倍倍比稀释成10个浓度梯度,加入接种PAMs的96孔细胞培养板上,100 μL·孔-1,每个浓度梯度重复4孔,同时设细胞对照(只加100 μL细胞维持液),置于37 ℃、5% CO2培养箱培养,待培养72 h后,弃上清,每孔加入20 μL 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT),继续培养4 h后,弃MTT,每孔加入150 μL DMSO,37 ℃孵育30 min,待结晶完全溶解后,490 nm处检测OD值。以细胞病变程度和所测得OD490 nm值为依据,用下列公式计算细胞的存活率,确定不同抗生素在PAMs上的最大安全浓度(maximum no-cytotoxic concentration,MNTC)。

1.3.2 苦参碱联合阿莫西林/金霉素在PAMs上的细胞毒性 以苦参碱、阿莫西林和金霉素在PAMs上最大安全浓度为起始浓度,分别连续2倍倍比稀释3个浓度梯度,按表2进行苦参碱与阿莫西林/金霉素的联合使用,加入至已接种PAMs的96孔细胞培养板中,100 μL·孔-1,每组4个重复,同时设细胞对照组,72 h后,MTT法检测联合用药后药物对PAMs的细胞毒性。

表2 苦参碱联合阿莫西林/金霉素在PAMs上细胞毒性试验设计
1.4 PRRSV 5′UTR RNA的制备
PRRSV 5′UTR RNA由中兽医药现代化山西省重点实验室制备保存[6]。制备过程如下:PRRSV感染Marc-145细胞24 h后,收集细胞样品,提取细胞总RNA,以合成的cDNA为模板,普通PCR扩增PRRSV 5′UTR(引物序列见表3)。PCR反应结束后,3%琼脂糖凝胶电泳检测目的基因条带并进行胶回收,送北京华大基因公司测序验证,比对正确后,将胶回收产物、载体pcDNA3.1(+) DNA分别进行双酶切,然后连接、转化,导入DH-5α感受态细胞。提取菌液质粒DNA并进行单酶切,酶切产物线性化纯化,参照RiboMAXTMLarge Scale RNA Production Systems-SP6 and T7(Promega)试剂盒进行体外RNA转录,参照MEGAclearTMKit Purification for Large Scale Transcription Reactions(ThermoFisher)说明书将RNA进行转录后纯化。核酸浓度测定仪测定纯化后RNA的浓度,分装,-80 ℃保存备用。
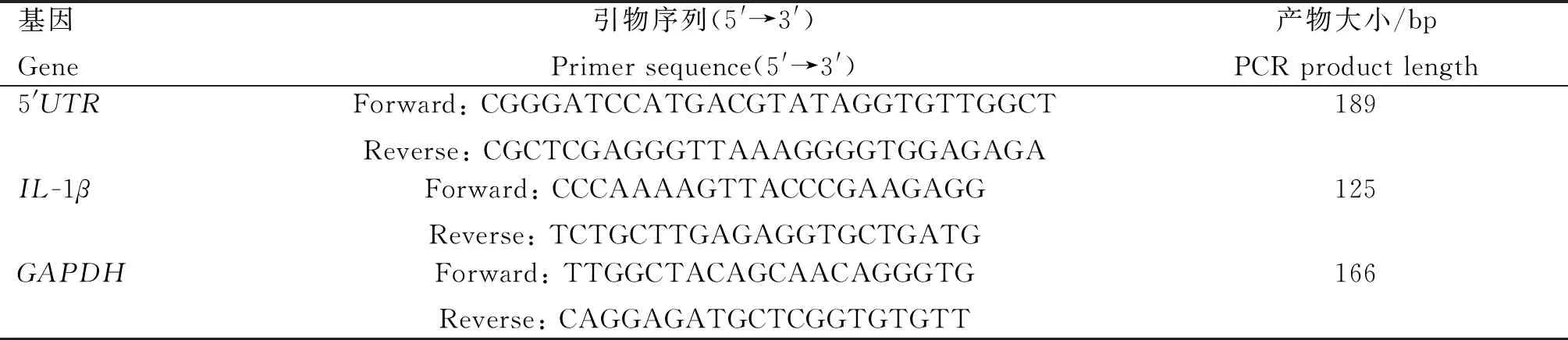
表3 引物信息
1.5 不同抗生素对PAMs炎症模型IL-1β mRNA表达的影响
PAMs以1×106个·mL-1接种到6孔细胞培养板中,培养2 h后弃掉未贴壁的细胞,加入新的10%培养基继续培养12 h后进行后续试验。转染4 μg PRRSV 5′UTR RNA的同时加入1 μg·mL-1LPS,共同刺激细胞6 h后,分别加入2 mL最大安全浓度的阿莫西林、金霉素、盐酸多西环素、氟苯尼考或替米考星,继续作用6 h,收集细胞,参照TaKaRa TRIzol总RNA提取试剂说明书提取细胞总RNA,qPCR检测IL-1βmRNA的表达。引物序列见表3。
1.6 苦参碱联合阿莫西林/金霉素对PAMs炎症模型IL-1β表达的影响
试验分组见表4,PAMs以1×106个·mL-1接种到6孔细胞培养板中,培养2 h后弃掉未贴壁的细胞,加入新的10%培养基继续培养12 h进行后续试验。4 μg 5′UTR RNA和1 μg·mL-1LPS共同刺激细胞6 h后,分别加入2 mL不同浓度联合的苦参碱和阿莫西林/金霉素,继续作用6 h,收集细胞,提取细胞总RNA和蛋白,qPCR检测IL-1βmRNA的表达,Western blot检测IL-1β蛋白的表达。
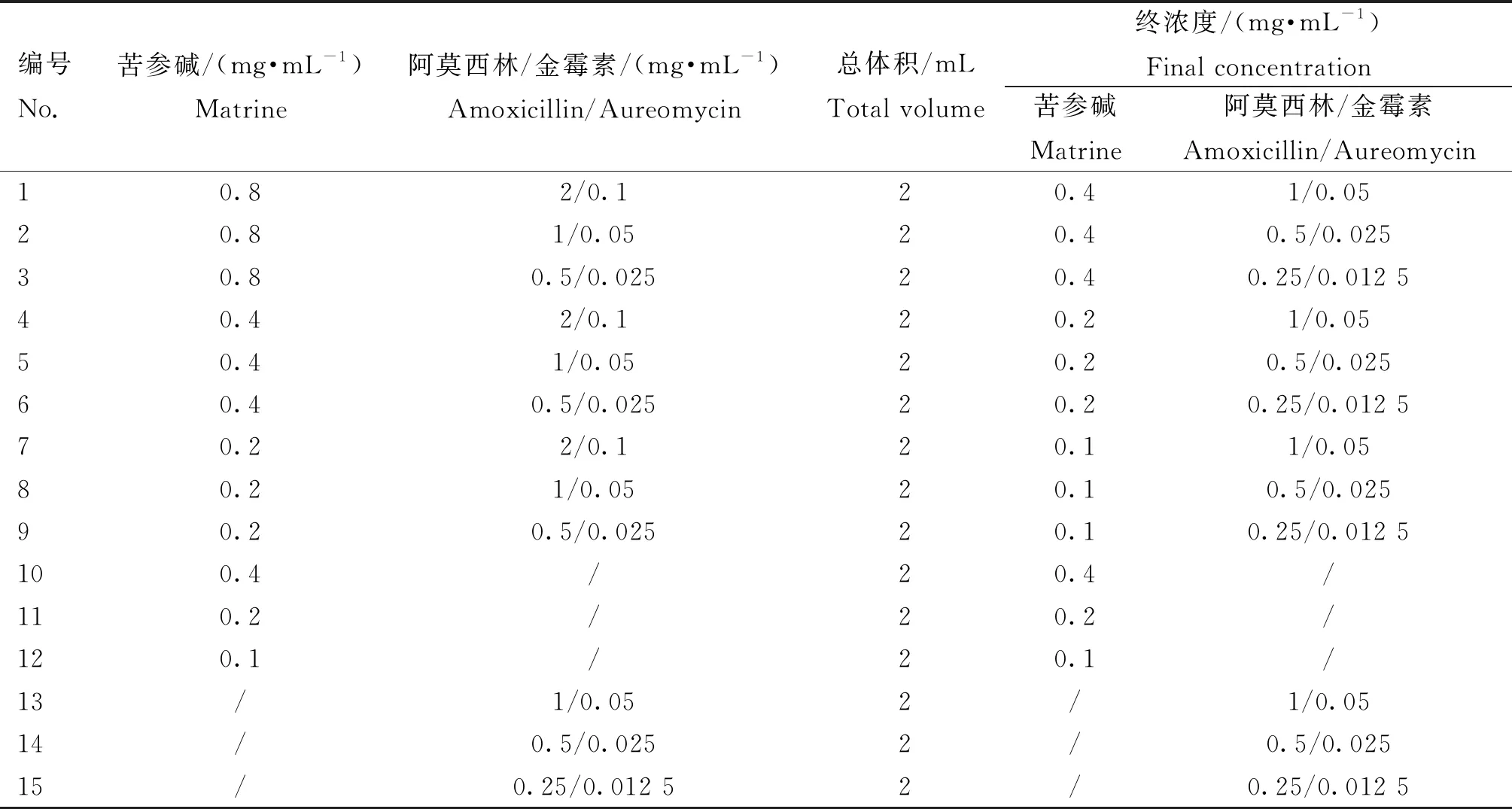
表4 苦参碱联合阿莫西林/金霉素试验表
1.7 Western blot检测IL-1β蛋白的表达
参照碧云天Western blot及IP细胞裂解液说明书进行裂解液的配制,提取细胞总蛋白。按照碧云天BCA蛋白浓度测定试剂盒说明书检测各样品的蛋白浓度。SDS-PAGE凝胶电泳分离目的蛋白,将目的蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,分别加入用TBST稀释后的IL-1β(1∶1 000稀释)和GAPDH(1∶5 000稀释)抗体,室温孵育2 h,TBST洗膜3次后,用1∶20 000比例稀释特异性二抗,37 ℃孵育1 h,洗膜3次,滴加适量ECL化学发光液,用X-ray胶片在暗室曝光,胶片晾干后扫描保存,扫描的图像用Image J软件进行灰度值分析。
1.8 数据分析
药物交互作用采用Excel进行可重复双因素方差分析,其他数据采用GraphPad Prism 5(GraphPad Software, Inc. California, USA)软件进行单因素方差分析(one-way ANOVA)(Bonferroni: Compare all pairs of columns或Dunnett: Compare all columns vs. control columns),所有数据均以“Mean ± SEM”表示。
2 结 果
2.1 不同抗生素在PAMs上的细胞毒性
将不同浓度梯度的阿莫西林、金霉素、盐酸多西环素、氟苯尼考和替米考星接种到PAMs上培养72 h,通过观察细胞病变和MTT法测定药物在所设浓度梯度内的最大安全浓度(MNTC)。结果见表5,阿莫西林的MNTC为1 mg·mL-1,金霉素的MNTC为0.05 mg·mL-1、盐酸多西环素的MNTC为0.004 375 mg·mL-1、氟苯尼考的MNTC为0.425 mg·mL-1、替米考星的MNTC为0.106 25 mg·mL-1。

表5 不同抗生素的最大溶解度和在PAMs上的最大安全浓度
2.2 不同抗生素对PAMs炎症模型IL-1β mRNA表达的影响
根据5种抗生素在PAMs上的细胞毒性结果,在最大安全浓度下检测不同抗生素对PRRSV 5′UTR RNA和LPS共刺激诱导的IL-1βmRNA表达的影响。结果如图1A所示,与PRRSV 5′UTR RNA和LPS共刺激组相比,阿莫西林、金霉素、盐酸多西环素、氟苯尼考均能显著抑制IL-1βmRNA的表达(P<0.05),替米考星对IL-1βmRNA的表达没有显著影响(P>0.05)。与苦参碱用药组相比,阿莫西林和金霉素与苦参碱具有相似的抑制效果(P>0.05),因此,选择阿莫西林和金霉素进行后续联合用药试验。
不同浓度的阿莫西林或金霉素作用于PRRSV 5′UTR RNA和LPS共刺激的PAMs 6 h后,qPCR检测结果显示,与PRRSV 5′UTR RNA和LPS共刺激组相比,1 mg·mL-1、0.5 mg·mL-1的阿莫西林显著降低IL-1βmRNA的表达(P<0.05),0.25 mg·mL-1的阿莫西林对IL-1βmRNA的表达没有显著影响(P>0.05,图1B);0.05 mg·mL-1、0.025 mg·mL-1的金霉素显著降低IL-1βmRNA的表达(P<0.05),0.012 5 mg·mL-1的金霉素对IL-1βmRNA的表达没有显著影响(P>0.05,图1C)。
2.3 苦参碱联合阿莫西林/金霉素在PAMs上的细胞毒性结果
选择最大浓度苦参碱与不同浓度的阿莫西林/金霉素联合以及最大浓度的阿莫西林/金霉素与不同浓度的苦参碱联合,PAMs用药72 h后,不同浓度的苦参碱和阿莫西林联合后,细胞存活率均大于80%(图2A);不同浓度的苦参碱和金霉素联合使用72 h后,仅0.4 mg·mL-1苦参碱+0.012 5 mg·mL-1金霉素组的细胞存活率大于80%,其余各组的细胞存活率均低于80%(图2B)。显微镜观察结果显示,苦参碱和金霉素联合使用6和12 h时,PAMs未出现细胞病变情况,细胞呈圆形,折光性好,联合使用24 h后开始出现细胞病变,细胞皱缩、裂解等。
《西行漫记》正是在这一时代背景下完成的,它是一部文笔优美的纪实性很强的报道性作品。1936年6月至10月期间,作者埃德加·斯诺在以延安为中心的陕甘宁边区进行实地采访,真实记录了我国西北革命根据地的所见所闻。

A. 苦参碱与阿莫西林联合在PAMs上的细胞毒性;B. 苦参碱与金霉素联合在PAMs上的细胞毒性A. Cytotoxicity of Matrine and Amoxicillin combined on PAMs. B. Cytotoxicity of Matrine and Aureomycin combined on PAMs图2 苦参碱与阿莫西林/金霉素联合在PAMs上的细胞毒性结果Fig.2 Cytotoxicity of Matrine combined Amoxicillin/Aureomycin on PAMs
2.4 苦参碱联合阿莫西林对PAMs炎症模型IL-1β mRNA表达的影响
与PRRSV 5′UTR RNA和LPS共刺激组相比,0.1 mg·mL-1苦参碱+0.25 mg·mL-1阿莫西林联合处理对IL-1βmRNA的表达没有显著影响(P>0.05),其余各加药组均能显著降低IL-1βmRNA的表达(P<0.05)。与1 mg·mL-1单独的阿莫西林加药组相比,苦参碱和阿莫西林联合用药组中0.4 mg·mL-1+1 mg·mL-1,0.2 mg·mL-1+0.25 mg·mL-1联合显著降低IL-1βmRNA的表达(P<0.05),0.4 mg·mL-1+0.5 mg·mL-1,0.4 mg·mL-1+0.25 mg·mL-1,0.2 mg·mL-1+1 mg·mL-1,0.2 mg·mL-1+0.5 mg·mL-1,0.1 mg·mL-1+1 mg·mL-1,0.1 mg·mL-1+0.5 mg·mL-1联合对IL-1βmRNA的表达没有显著影响(P>0.05),但是0.1 mg·mL-1+0.25 mg·mL-1联合显著升高IL-1βmRNA的表达(P<0.05,图3)。
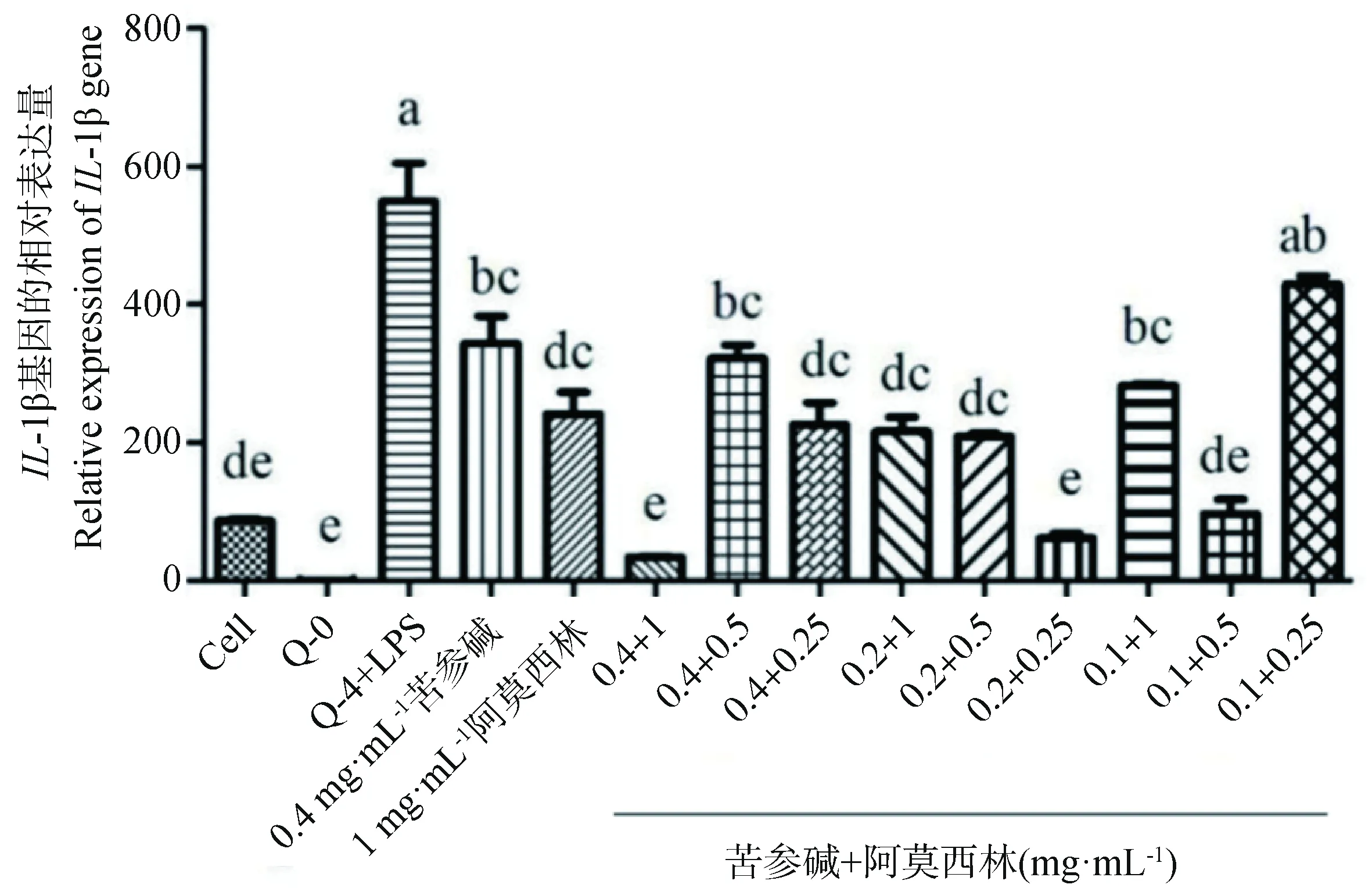
图3 苦参碱联合阿莫西林对PAMs炎症模型IL-1β mRNA表达的影响Fig.3 Effects of Matrine and Amoxicillin combined on the mRNA expression of IL-1β in PAMs inflammatory model
2.5 苦参碱联合金霉素对PAMs炎症模型IL-1β mRNA表达的影响
与PRRSV 5′UTR RNA和LPS共刺激组相比,苦参碱联合金霉素组0.4 mg·mL-1+0.025 mg·mL-1,0.2 mg·mL-1+0.012 5 mg·mL-1,0.1 mg·mL-1+0.025 mg·mL-1,0.1 mg·mL-1+0.012 5 mg·mL-1对PAMs炎症模型IL-1βmRNA的表达没有显著影响(P>0.05),其余各联合用药组均能显著降低IL-1βmRNA的表达(P<0.05)。与0.05 mg·mL-1单独的金霉素加药组相比,苦参碱和金霉素联合用药组0.2 mg·mL-1+0.012 5 mg·mL-1显著升高IL-1βmRNA的表达(P<0.05),其余各联合用药组均无显著差异(P>0.05,图4)。
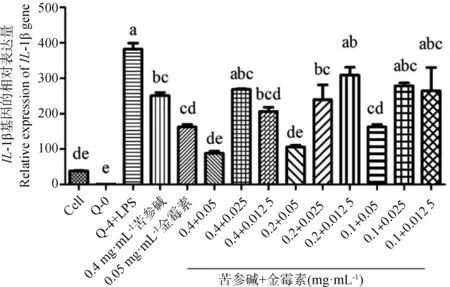
图4 苦参碱联合金霉素对PAMs炎症模型IL-1β mRNA表达的影响Fig.4 Effects of Matrine and Aureomycin combined on the mRNA expression of IL-1β in PAMs inflammatory model
2.6 苦参碱与阿莫西林/金霉素联合交互作用分析
分别将苦参碱与阿莫西林或金霉素联合使用后对PAMs炎症模型中IL-1βmRNA表达的结果进行可重复双因素方差分析,结果显示苦参碱与阿莫西林之间存在交互作用(P=2.89×10-8,表6),苦参碱与金霉素之间不存在交互作用(P=0.121 013,表7)。
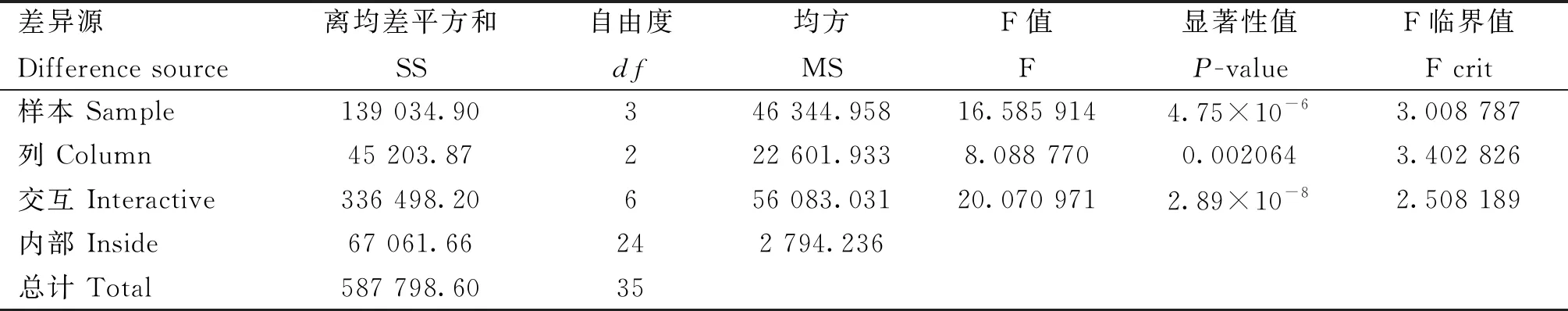
表6 苦参碱联合阿莫西林对IL-1β mRNA表达影响的方差分析结果

表7 苦参碱联合金霉素对IL-1β mRNA表达影响的方差分析结果
2.7 苦参碱联合阿莫西林对PAMs炎症模型IL-1β蛋白表达的影响
Western blot检测结果显示(图5),与PRRSV 5′UTR RNA和LPS共刺激组相比,0.1 mg·mL-1苦参碱+0.25 mg·mL-1阿莫西林联合处理对IL-1β蛋白的表达没有显著影响(P>0.05),其余加药处理组均能显著降低IL-1β蛋白的表达(P<0.05)。与1 mg·mL-1单独的阿莫西林加药组相比,苦参碱和阿莫西林联合用药组中0.4 mg·mL-1+1 mg·mL-1、0.2 mg·mL-1+1 mg·mL-1、0.4 mg·mL-1+0.5 mg·mL-1联合显著降低IL-1β蛋白的表达(P< 0.05),0.1 mg·mL-1+1 mg·mL-1、0.2 mg·mL-1+0.5 mg·mL-1、0.1 mg·mL-1+0.5 mg·mL-1、0.4 mg·mL-1+0.25 mg·mL-1、0.2 mg·mL-1+0.25 mg·mL-1联合对IL-1β蛋白的表达没有显著影响(P>0.05),表明在降低阿莫西林用量的时候加入苦参碱,能够达到相同或更显著的抗炎效果,苦参碱能够替代部分阿莫西林的药效,降低阿莫西林的使用量。

图5 苦参碱联合阿莫西林对PAMs炎症模型IL-1β蛋白表达的影响Fig.5 Effects of Matrine and Amoxicillin combined on the protein expression of IL-1β in PAMs inflammatory model
3 讨 论
面对饲用化学品添加对动物源性食品质量和公共卫生安全造成的严重威胁,许多国家在养殖生产中禁止或限制添加抗生素等化学品。2019年以来,我国农业农村部相继发布多个公告限制或禁止抗生素的使用,2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料,2021年10月,农业农村部发布《全国兽用抗菌药使用减量化行动方案(2021—2025年)》。2021年11月,农业农村部办公厅关于推介发布2021年农业主推技术的通知中,遴选了114项农业主推技术,畜禽抗生素减量替代技术位列其中。近几年,中兽药及其提取物在防治动物疾病、提高机体免疫功能、缓解炎症反应等的临床应用中显示了良好的效果。本课题组长期从事中药提取物抗病毒、抗炎作用及机制的研究,证明苦参碱具有抗PRRSV和猪圆环病毒2型(porcine circovirus type 2,PCV2)作用[13],对PRRSV/PCV2共感染昆明小鼠诱导的间质性肺炎有显著的治疗作用[14],还可以抑制PRRSV和LPS共刺激诱导的炎症反应[5]。
氟苯尼考、强力霉素(盐酸多西环素)和替米考星在临床上常用于防治家禽呼吸道疾病,强力霉素能够抑制PRRSV的复制,2015年的统计报道显示阿莫西林和氟苯尼考作为广谱抗菌药,使用量居全国前两位[12]。本试验通过选择临床上常用的五种抗生素阿莫西林、金霉素、盐酸多西环素、氟苯尼考和替米考星,以IL-1βmRNA为检测指标,筛选与苦参碱具有相似抑制效果的抗生素,结果显示阿莫西林和金霉素对IL-1βmRNA抑制效果与苦参碱相似。通过与苦参碱的联合使用,qPCR结果显示苦参碱与金霉素联合使用后没有交互作用,苦参碱和阿莫西林之间存在交互作用。苦参碱与阿莫西林联合使用后苦参碱能够替代部分阿莫西林的用量达到相同或更显著的效果,一定程度上降低了阿莫西林的用量。本研究为苦参碱的临床试验提供数据支撑,为苦参碱作为抗生素的替代物,降低抗生素使用提供依据,为合理解决抗生素耐药性等问题提供有效策略。
4 结 论
在抗PRRSV 5′UTR RNA和LPS共刺激诱导的IL-1β表达中,苦参碱能替代部分阿莫西林的药效,减少阿莫西林的使用量,为苦参碱作为阿莫西林的替代物以及临床应用提供数据支撑。
