猪GRK2蛋白抗口蹄疫病毒作用分析
2023-10-29陈文哲张向乐顾峰幸赵振翔李康丽薛钊宁郑海学张小丽朱紫祥
陈文哲,张向乐,顾峰幸,赵振翔,李康丽,薛钊宁,郑海学,张小丽*,朱紫祥*
(1.甘肃农业大学动物医学院,兰州 730070;2.中国农业科学院兰州兽医研究所,兰州大学动物医学与生物安全学院,家畜疫病病原生物学国家重点实验室,兰州 730046)
口蹄疫(foot-and-mouth disease, FMD)是由口蹄疫病毒(foot-and-mouth disease virus, FMDV)感染偶蹄类动物引起的一种急性、热性、高度接触性传染病,易感动物包括猪、牛、羊等家畜以及70多种野生动物,严重时能引起动物死亡[1,2]。患病动物常在口腔、蹄部、乳房等部位出现大小不一的水泡[3,4]。FMD传染性强,传播途径广,特别是在集约化养殖中极易发生,对畜牧业养殖造成巨大的危害,被世界动物卫生组织(WOAH)列为需报告传染病,在我国被列为一类动物传染病。中国作为养殖业发展大国,防控口蹄疫不仅对畜牧业发展有重大作用,同时对全球口蹄疫防控具有重要意义[5]。FMDV属于微RNA病毒科(Picornaviridae)、 口蹄疫病毒属(Aphthovirus),被分为7个血清型,分别为O、A、C、SAT1、SAT2、SAT3和Asia1型,各型间没有有效的交叉保护性,甚至同一血清型的不同毒株之间也没有完全保护反应。世界范围内的高发病率和广泛的多样性使FMD的预防和控制面临巨大挑战[5-7]。因此,鉴定出重要的宿主限制因子并解析其抑制FMDV复制的机制,对口蹄疫防控和净化具有重要意义。
CRISPR-CAS9技术目前广泛应用于细胞的基因编辑和基因调解、基因敲除动物模型的构建等领域。实验室前期通过CRISPR-CAS9系统筛选出一批对FMDV具有调节作用的宿主蛋白,通过对表型进行初步验证,发现宿主G蛋白偶联受体激酶2(G protein-coupled receptor kinase 2, GRK2)对FMDV复制具有显著的调节作用。G蛋白偶联受体激酶(G protein-coupled receptor kinase, GRKs)家族由7个结构上有同源序列的丝氨酸/酪氨酸蛋白激酶成员组成,包括1个丝氨酸-苏氨酸同源的中心催化区、1个底物识别和含有G蛋白信号调节蛋白样结构的氨基末端区以及1个作用于胞膜的羧基末端区[8]。根据序列和功能的相似性可以分为3个亚家族。该亚家族成员广泛存在于各种组织,作用底物广,并且具有重复的底物特异性。GRK2是在1980年研究β2肾上腺素受体(β2AR)同源减敏机制时发现的[9],它分布广泛,能使已被激动剂激活的β2AR磷酸化。最近发现,激动剂刺激哺乳动物细胞后,能够诱导G蛋白偶联受体(G-protein coupled receptors, GPCR)、GRK2和Gβγ在细胞膜上形成稳定的复合体,该复合体形成是GRK2细胞膜转位和发挥功能的必要条件[10]。此外,GRK2能特异地使活化的GPCR发生磷酸化,进而引起GPCR脱敏,阻止受体本身再次偶联G蛋白,从而有效地降低细胞膜上功能受体的水平,使受体介导的信号转导效应消失或降低[11-12]。
GRK2在病毒复制过程中也发挥着重要的调控作用。Le Sommer等[13]研究发现GRK2能够调控登革热病毒、丙型肝炎病毒以及黄热病病毒(yellow fever virus, YFV)的复制,是黄病毒科的一个广谱宿主因子。GRK2是黄热病病毒复制所必须的,能够独立调控生命周期的多个阶段,包括病毒进入、RNA的合成及基因组扩增。GRK2在流感病毒(influenza virus, IAV)脱壳过程中也发挥着重要作用。Yngüez等[14]在研究针对流感病毒的新药物靶点时发现GRK2是IAV感染初始阶段的关键激酶。但是,GRK2在FMDV感染的过程中发挥着与YFV和IAV截然不同的效应,且GRK2对FMDV复制的影响尚未有报道。因此,本研究通过构建猪GRK2真核表达质粒,进一步通过过表达、siRNA干扰方法以及和病毒蛋白的相互作用,探究GRK2在FMDV感染过程中发挥的作用。本研究为阐明宿主蛋白GRK2抵抗病毒复制的机制奠定了基础,为控制FMD的流行提供了新的思路。
1 材料与方法
1.1 毒株、细胞、菌体和载体
口蹄疫O型毒株由中国农业科学院兰州兽医研究所国家口蹄疫参考实验室保存。PK-15、HEK-293 T和BHK-21细胞由中国农业科学院兰州兽医研究所口蹄疫与新发病流行病学实验室提供。真核表达载体pcDNATM3.1/myc-His(-)由中国农业科学院兰州兽医研究所提供。
1.2 主要试剂
限制性核酸内切酶XbaⅠ、Hind Ⅲ、T4 DNA连接酶、蛋白Marker购自 TaKaRa公司;0.25%-EDTA胰酶溶液、DMEM培养基、胎牛血清(FBS)均购自Gibco公司;jetPRIME转染试剂购自Polyplus Transfection公司;硝酸纤维素膜、RNA抽提试剂Trizol均购自Invitrogen公司;DNA Gel Extraction Kit、QIAGEN Plasmid Plus均购自德国QIAGEN公司;qRT SuperMix反转录试剂、SYBR Mix 购自诺唯赞公司;PBS溶液和一抗稀释液购自碧云天公司;ECL显色剂购自Thermo Scientific公司;氨苄霉素购自北京索莱宝科技有限公司;DH5α感受态购自健顺生物公司。
鼠抗Myc单克隆抗体 (M4439)、鼠抗Flag单克隆抗体、鼠抗β-actin单克隆抗体(A5441)均购自Sigma公司、山羊抗小鼠IgG的辣根过氧化物酶偶联二抗和山羊抗兔IgG的辣根过氧化物酶偶联二抗均购自购自武汉博士得生物工程有限公司;鼠抗GRK2单克隆抗体购自Santa Cruz 生物技术有限公司。
1.3 RNA提取及基因克隆
Trizol裂解提取细胞总RNA:PBS洗涤PK-15细胞2次,加入1 mL Trizol室温裂解6 min;加入200 μL氯仿震荡混匀,室温静置3 min,4 ℃ 12 000 r·min-1离心15 min;吸取上清并加入等体积异丙醇,-20 ℃放置30 min,4 ℃ 12 000 r·min-1离心15 min;弃上清,75%乙醇洗涤沉淀,4 ℃ 12 000 r·min-1离心5 min,弃上清,室温晾干,加入20 μL无RNase水溶解RNA,测定RNA浓度。
反转录反应(20 μL):4 μL 提取的RNA,4 μL 5×HiScript Ⅱ qRT SuperMix Ⅱ,无RNase水20 μL。反应程序:50 ℃ 15 min,85 ℃ 10 s,4 ℃保存。
PCR扩增反应(25 μL):Primer Star 12.5 μL,cDNA 3 μL,上、下游引物各0.5 μL,加水补足至25 μL。反应程序:98 ℃ 3 min;98 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min,4 ℃保存。1%琼脂糖凝胶电泳鉴定PCR产物。退火温度及延伸时间根据引物片段和扩增长度确定。扩增引物见表1。

表1 本试验中应用到的定量引物序列及siRNA序列
1.4 质粒构建
将上述(1.3)PCR扩增产物进行电泳、纯化回收并送样测序。测序验证正确后,用XbaⅠ、Hind Ⅲ双酶切PCR产物。酶切体系:10×M Buffer 5 μL;XbaⅠ 2 μL;Hind Ⅲ 2 μL;目的片段(胶回收GRK2)2 μg,补水至50 μL。反应程序:置于37 ℃金属浴中酶切10 min。将上述酶切后的目的片段与载体pcDNATM3.1/myc-His(-)进行T4连接。连接体系:T4 DNA Ligase 1 μL,10×T4 DNA Ligase Buffer 1 μL,载体1 μL,目的片段7 μL。反应程序:16 ℃金属浴中连接3 h。利用DH5α大肠杆菌转化,提取质粒送样测序。经测序分析证实,成功构建猪GRK2基因的真核表达质粒,将其命名为p-GRK2-myc。
1.5 实时荧光定量PCR(qPCR)
收取细胞样品,提取RNA后反转录。qPCR体系:2×ChamQ Universal SYBR qPCR Master Mix 5 μL,上下游引物各1 μL,cDNA 1 μL,补水至10 μL。反应程序:95 ℃预变性3 min;95 ℃变性3 s,60 ℃ 30 s,40个循环;熔解曲线:60 ℃ 1 min,95 ℃ 15 s。每个试验组重复3次,用2-ΔΔCt测定相对表达量,并将甘油醛-3-磷酸脱氢酶基因(GAPDH)作为内参从而标准化每个样品中的转录物的量。扩增引物见表1。
1.6 蛋白质免疫印迹(Western blot)
蛋白质样品的制备:PBS洗涤细胞2次,加入120~140 μL细胞裂解液,冰上裂解5 min后反复吹打细胞样品,转移至1.5 mL离心管,金属浴100 ℃ 15 min,12 000 r·min-1离心5 min 备用。
电泳:按照聚丙烯酰胺凝胶电泳所示方法配制浓缩胶和分离胶。将上述样品加入蛋白胶泳道,电压80 V 30 min,120 V 1 h。转印:将上述蛋白胶与NC膜组装并放入转印装置,冰上恒流200 mA 2 h。封闭:5%脱脂奶粉室温摇床封闭2 h。一抗孵育:1×TBST清洗NC膜上残余奶粉,加入稀释过的一抗(Myc 1∶3 000;HA 1∶5 000;GRK2 1∶1 000;β-actin 1∶1 500),4 ℃摇床过夜。二抗孵育:1×TBST洗NC膜3次,每次10 min;加入1×TBST稀释的二抗(山羊抗小鼠IgG的辣根过氧化物酶偶联二抗和山羊抗兔IgG的辣根过氧化物酶偶联二抗均1∶5 000稀释),室温摇床孵育2 h。显影:1×TBST洗NC膜3次,每次10 min;取ECL化学发光显色液浸泡NC膜15~30 s,通过凝胶成像仪曝光和采集图像。
1.7 间接免疫荧光(indirect fluorescence assay,IFA)
用包被液包被好的共聚焦专用培养皿培养细胞,待细胞长至80%时,进行转染,24 h后进行细胞固定。吸去培养基,用PBS轻轻洗3次,每次1 mL,室温静置5 min,用预冷的多聚甲醛固定20~30 min。吸去固定液,用PBS轻洗3次,每次1 mL,室温静置5 min。室温下用0.2%~0.3%PBS配制的曲拉通处理10 min,用PBS轻洗3次,每次1 mL,室温静置5 min。加入1 mL 5%BSA室温封闭1 h,PBS轻洗3次后进行一抗过夜孵育(1∶100稀释)。PBS轻洗3次,每次5 min后,避光加入稀释后的荧光二抗(1∶500稀释),室温1 h。PBS轻洗3次,每次5 min后,进行细胞核染色。配制DAPI细胞核染色液,避光染色,室温作用10 min,PBS清洗3次,激光共聚焦显微镜下观察拍照。
1.8 病毒感染及病毒滴度测定
病毒感染:在12孔板中培养PK-15细胞,待细胞长至80%~90%时,转染p-GRK2-myc质粒600 ng。转染24 h后,吸去细胞培养基,PBS轻洗1次,接种用细胞维持液(1%FBS培养液)稀释的1 MOI病毒,感染12 h后,收集上清,用于测定上清中的病毒滴度。
病毒滴度的测定(TCID50):用96孔板培养BHK-21细胞,用细胞维持液对病毒上清进行倍比稀释(10-1~10-11),每个稀释度接种一列细胞,感染72 h后显微镜下观察,记录每个稀释度产生CPE的细胞孔的数目,根据Reed-Muench法计算TCID50,重复3次测定,取平均值为最终病毒滴度。
1.9 siRNA干扰试验
GRK2的猪源siRNA由北京擎科生物科技有限公司设计并合成,siRNA序列见表1。
在12孔板中培养PK-15细胞,待细胞长至70%~90%时,转染空白对照组(Negative control,NC)和针对GRK2的siRNA,转染48 h后,利用qPCR方法检测GRK2的干扰效率。在证实合成的siRNA可以下调GRK2的表达后,在PK-15细胞中转染NC siRNA和GRK2 siRNA,48 h后,以1 MOI FMDV感染细胞,设置Mock组,12 h后,收集细胞,提取总RNA,利用实时荧光定量PCR进行检测,比较分析GRK2和FMDV mRNA的差异。
2 结 果
2.1 猪GRK2 基因的扩增和真核表达质粒的构建
利用针对GRK2的引物对GRK2基因进行扩增,1%琼脂糖凝胶电泳如图1A所示,出现约2 096 bp的片段,与预期大小相符合。测序结果表明该片段正确,为猪GRK2基因完整的CDS序列。对回收的GRK2目的片段和pcDNATM3.1/myc-His(-)真核表达载体进行双酶切(图1B),回收后连接并转化,进而提取质粒。对提取出的质粒进行XbaⅠ、HindⅢ双酶切鉴定,均证实质粒构建成功(图1C)。测序结果进一步表明成功构建猪GRK2基因的真核表达质粒p-GRK2-myc。

A. GRK2片段RT-PCR扩增结果;B. GRK2真核表达质粒p-GRK2-myc的构建;C. GRK2双酶切鉴定;M. DNA相对分子质量标准;1. GRK2片段RT-PCR扩增产物;2. GRK2双酶切产物;3. 空载体双酶切产物;4. GRK2经Xba I和Hind III双酶切后的产物;5. 阴性对照(ddH2O)A. Amplification of GRK2 CDS fragments by RT-PCR; B. Construction of GRK2 eukaryotic expression plasmid (p-GRK2-myc); C. Double enzyme digestion of eukaryotic expression plasmid p-GRK2-myc; M. DNA marker; 1. RT-PCR product of GRK2 fragments;2. Double enzyme cleavage product of GRK2; 3. Double enzyme cleavage product of empty vector; 4. The production of GRK2 by Xba I and Hind III; 5. Negative control (ddH2O)图1 GRK2真核表达质粒p-GRK2-myc的构建与鉴定Fig.1 Construction and identification of GRK2 eukaryotic expression plasmid (p-GRK2-myc)
2.2 猪GRK2真核质粒的表达验证及其细胞定位分析
PK-15细胞分别转染pcDNATM3.1/myc-His(-)空载体和p-GRK2-myc表达质粒,24 h后收取细胞样品。Western blot结果显示在相对分子质量约为84 ku大小处出现特异性条带(图2A),与预期结果相符。说明p-GRK2-myc质粒能在PK-15细胞中瞬时表达。间接免疫荧光试验显示,p-GRK2-myc定位在细胞质中(图2B)。
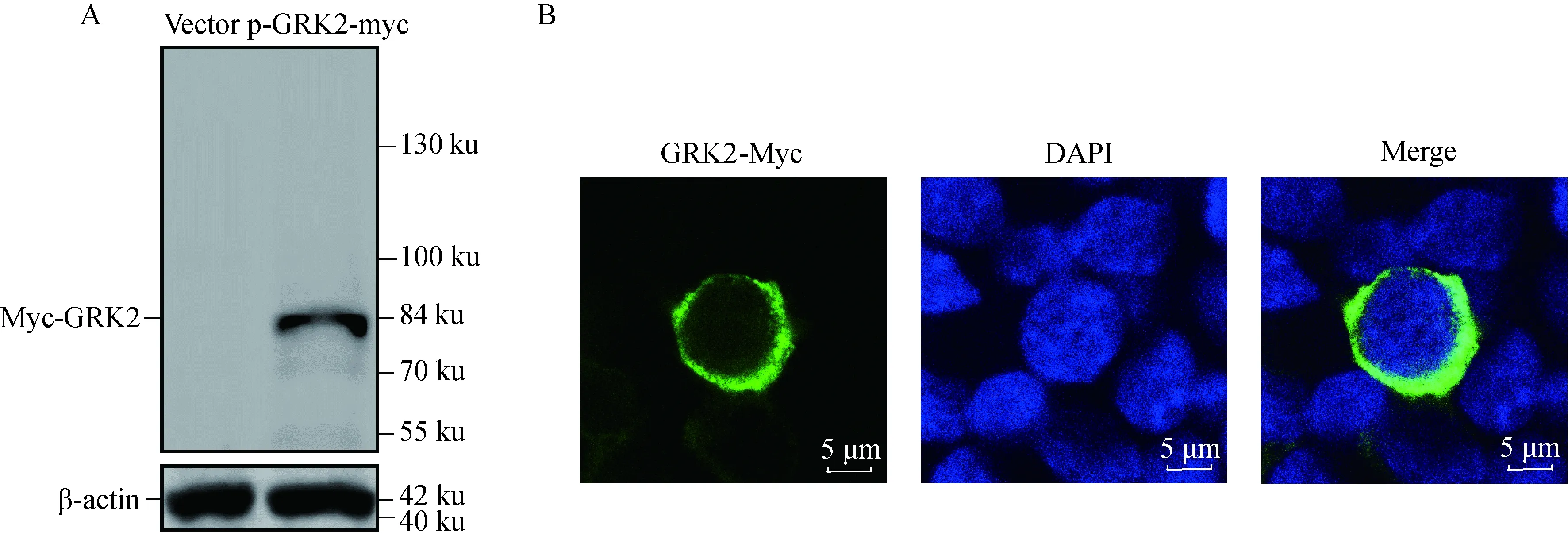
A. 蛋白质印迹法验证p-GRK2-myc质粒的表达;B. 间接免疫荧光试验验证GRK2质粒的表达及其细胞定位A. Confirmation of the expression of p-GRK2-myc plasmid by Western blot; B. Identification of the expression and subcellular localization of the GRK2 Plasmid by indirect fluorescence assay图2 p-GRK2-myc质粒的表达及其细胞定位Fig.2 The confirmation of expression of p-GRK2-myc plasmid and the cellular localization analysis of GRK2
2.3 FMDV感染调控GRK2的表达
MOI的FMDV感染单层PK-15细胞,在感染后0、4、8和12 h收集细胞样品,结果显示,随着FMDV感染的进程,GRK2的转录水平和蛋白表达水平呈现先上升后下降的趋势。这表明FMDV感染可以调控GRK2的表达(图3A、B)。
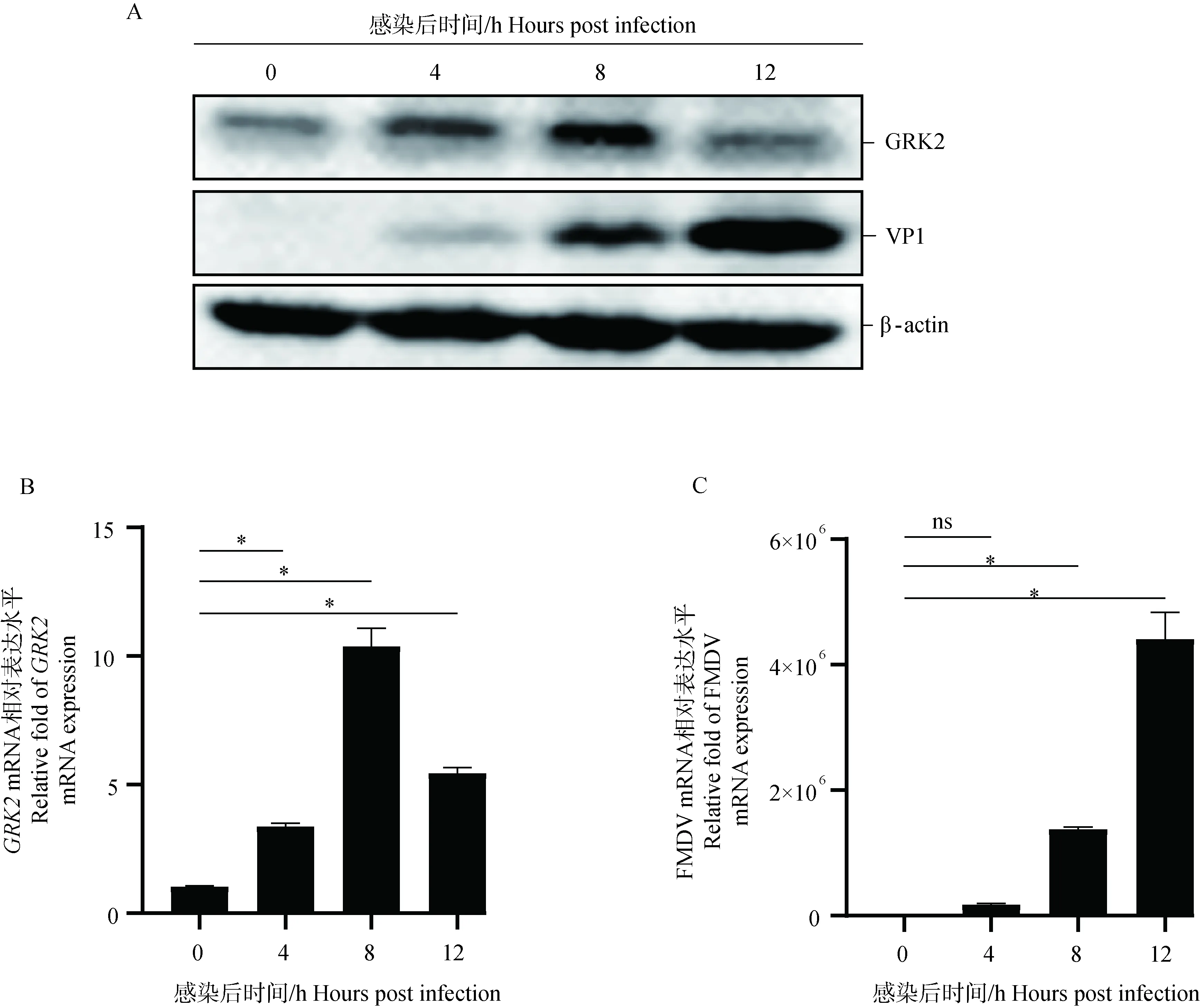
A. GRK2蛋白水平的变化;B. GRK2 mRNA转录水平变化;C. 口蹄疫病毒mRNA转录水平变化;ns. 差异不显著(P>0.05); *. 差异显著(P<0.05)A. The change of GRK2 protein expression levels in FMDV-infected cells; B. GRK2 mRNA expression levels in FMDV-infected cells were detected by qPCR; C. FMDV mRNA expression levels in FMDV-infected cells were detected by qPCR. ns. No significant difference (P>0.05);*. Significant difference (P<0.05)图3 口蹄疫病毒感染调控内源性GRK2的表达Fig.3 FMDV infection regulates the expression of endogenous GRK2
2.4 过表达GRK2抑制FMDV复制
为进一步研究GRK2在FMDV感染过程中的作用,PK-15细胞转染不同剂量的p-GRK2-myc表达质粒(0、150、300和600 ng),24 h后用0.1 MOI FMDV感染不同时间点(0、4、8、10和12 h)收样检测GRK2过表达细胞中FMDV mRNA水平、蛋白水平及病毒滴度的变化。结果表明,随着GRK2表达量的增加,FMDV的mRNA水平和蛋白水平都显著降低(图4A、B)。同时,随着感染时间的推移,GRK2对FMDV复制的抑制作用发生在感染早期且抑制效果很显著(图4C)。结果显示,GRK2能够抑制FMDV的复制,并呈现剂量依赖关系(图4D)。
2.5 干扰GRK2促进FMDV复制
PK-15细胞转染NC和针对GRK2的siRNA,48 h后,利用qPCR方法检测GRK2的干扰效率。结果表明,合成的针对猪GRK2的siRNA能够下调PK-15细胞中GRK2的转录水平,干扰效率可以达到60%~70%(图5A)。之后在PK-15细胞中转染等量的NC siRNA和GRK2 siRNA,48 h后,分别感染0.1 MOI的FMDV 12 h,收集细胞进行Western blot和qPCR检测。结果显示,下调GRK2的表达能够上调FMDV的转录和蛋白水平(图5B、 C),同时GRK2的mRNA水平显著改变(图5D),这表明下调GRK2的表达可以促进FMDV的复制。
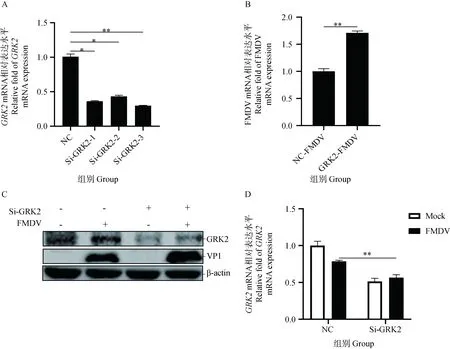
A. GRK2 siRNA干扰效率检测;B. 下调表达GRK2后FMDV mRNA转录水平的影响检测;C. 下调表达GRK2后FMDV蛋白水平的影响检测;D. 转染Si-GRK2后干扰效果检测;*. P<0.05;**. P<0.01A. Detection of silence ratio of GRK2 siRNA; B. Detection of FMDV mRNA transcription level after down-regulated expression of GRK2; C. Detection of FMDV protein levels after down-regulated expression of GRK2; D. Detection of interference effect after transfection with Si-GRK2. *. P<0.05;**. P<0.01图5 下调GRK2促进FMDV复制Fig.5 Downregulation of GRK2 expression promotes FMDV replication
2.6 口蹄疫3Cpro抑制GRK2的表达
GRK2在FMDV感染后期表达量降低,为探究该蛋白是否被FMDV蛋白酶3Cpro和Lpro切割或裂解,PK-15细胞分别共转染pcDNATM3.1/Flag(-)空载体和p-GRK2-myc质粒、pcDNATM3.1/Flag(-)空载体和3Cpro质粒(0、600、1 200 ng)以及p-GRK2-myc质粒和病毒蛋白Lpro和3Cpro(0、500、1 000、1 500 ng),24 h后收取细胞样品。Western blot检测显示,3Cpro显著降低GRK2的表达(图6A~C),而病毒蛋白Lpro对GKR2的表达无影响(图6D)。说明宿主蛋白GRK2调控口蹄疫病毒复制的过程中,3Cpro通过负反馈调节GRK2的表达,进而维持病毒自身的复制。

A. 过表达3Cpro能抑制GRK2的表达;B. 过表达3Cpro能抑制内源GRK2的表达;C. 过表达3Cpro后GRK2 mRNA水平的变化;D. 过表达Lpro不能抑制GRK2的表达;*. P<0.05;**. P<0.01A. Overexpression of 3Cpro inhibited the expression of GRK2; B. Overexpression of 3Cpro inhibited the expression of endogenous GRK2; C. Changes of GRK2 mRNA levels after overexpression of 3Cpro; D. Overexpression of Lpro could not inhibit the expression of GRK2. *. P<0.05;**. P<0.01图6 口蹄疫3Cpro抑制GRK2的表达Fig.6 Foot-and-mouth disease 3Cpro inhibits the expression of GRK2
2.7 过表达3Cpro能促进FMDV的复制
PK-15细胞分别转染pcDNATM3.1/Flag(-)空载体和Cpro质粒(0、600、1 200 ng),24 h后用0.1 MOI FMDV感染后收样检测细胞中FMDV转录和蛋白水平的变化(图7A、B)。
2.8 GRK2与3Cpro互作且共定位
293 T细胞分别共转染pcDNATM3.1/myc-His(-)空载体、p-GRK2-myc质粒和3Cpro质粒,24 h后收取细胞样品。Western blot检测显示,3Cpro与GRK2互作(图8A),间接免疫荧光试验显示,GRK2和3Cpro共同定位在细胞质中(图8B)。

A. GRK2与3Cpro相互作用;B. GRK2与3Cpro共定位A. GRK2 interacted with exogenous 3Cpro; B. GRK2 is co-located with 3Cpro图8 GRK2与3Cpro互作且存在共定位Fig.8 GRK2 interacts with the 3Cpro and is co-localized with 3Cpro
3 讨 论
猪、牛、羊是FMDV感染的主要宿主之一,我国又是养殖业大国,一旦发生疫情,严重危害我国畜牧业的发展。天然免疫是动物机体抵抗病原感染的第一道防线,通过模式识别受体(pattern recognition receptors, PPRs)识别入侵机体的病原体,迅速地激活固有免疫细胞,通过一系列级联反应释放免疫因子阻止其入侵[15,16]。研究发现FMDV是典型的免疫抑制性病毒,感染宿主后可以引发显著的免疫抑制,可通过参与多种细胞进程破坏宿主蛋白的功能,如裂解宿主蛋白、干扰宿主蛋白的表达、去除宿主蛋白的泛素化以及抑制宿主蛋白的磷酸化,进而调控天然免疫信号通路,突破天然免疫防线,建立原发性感染病灶,并开始病毒的迅速复制。其中,FMDV的结构和非结构蛋白发挥着重要作用[17-18]。而为了抵抗感染,宿主细胞也通过调控各种通路,启动一系列抗病毒反应,限制FMDV复制。
GRK2和FMDV之间的关系目前尚不清楚,本研究通过扩增猪的GRK2基因,对GRK2与FMDV之间的关系进行了探究。结果发现,FMDV感染PK-15细胞后,可以显著调控内源GRK2的表达,这表明二者之间存在必然的联系。进一步通过过表达试验和干扰试验发现,GRK2的上调表达可以抑制FMDV的复制,下调表达可以促进FMDV的复制,这证明GRK2在FMDV感染后发挥着重要的抗病毒作用。FMDV感染后GRK2后期表达量下降,表明部分病毒蛋白调控了GRK2的表达。FMDV的3Cpro和Lpro在抑制宿主蛋白表达过程中发挥重要作用[19-20],作者研究发现,FMDV 3Cpro蛋白能够抑制GRK2的表达,而Lpro并不影响GRK2的表达。Lpro在病毒感染早期快速表达,调控宿主蛋白表达,而3Cpro蛋白表达晚于Lpro,这也解释了为何GRK2早期表达并未收到抑制,而在感染的中后期发生了下降。3Cpro蛋白下调GRK2的表达削弱了GRK2的抗病毒作用,促进了病毒自身的复制。
制药行业中50%以上的药物靶点针对GPCR,是世界公认范围内的主要治疗靶点之一,因而突出其重要作用。此外,GPCR激动剂通过调节包括趋化性、细胞存活和炎症介质产生在内的许多巨噬细胞功能来调节炎症反应[21,22]。因此,GPCR在调节巨噬细胞生物学和先天免疫中起着至关重要的作用。与GPCR一样,Toll样受体(Toll-like receptors,TLRs)是一类参与先天性和适应性免疫调节的受体,在巨噬细胞生物学和先天免疫的调节中起着至关重要的作用。有研究发现,TLR2和TLR4的激活显著降低了巨噬细胞中arrestin-2蛋白水平,同时TLR2、3、4和7的表达显著增加GRK2蛋白水平的表达[23]。单核细胞是先天免疫系统的关键效应细胞,通过迁移到炎症部位、分化为巨噬细胞和树突状细胞、引发免疫反应和杀死致病微生物来保护宿主。单核细胞趋化蛋白1(monocyte chemoattractant protein1, MCP-1),也称为CCL2,在单核细胞活化和迁移中起着重要作用。MCP-1的趋化功能通过与GPCR家族成员CCR2受体的结合介导。G蛋白偶联受体激酶诱导GPCR磷酸化,这导致GPCR脱敏。有研究证明LPS增强MCP-1诱导的单核细胞迁移,通过p38 MAPK信号传导,诱导GRK2在丝氨酸670处磷酸化,进而抑制GRK2向膜的易位,从而阻止GRK2启动的CCR2对MCP-1的内化和脱敏。因此,这导致单核细胞迁移增强。这些发现表明TLR4通过调节GRK2异位增强单核细胞的趋化性[24]。
FMDV 3Cpro蛋白是FMDV基因组编码中具有酶学活性的病毒产物之一,是病毒多蛋白的主要裂解酶,且能裂解宿主细胞的蛋白[19]。研究表明,蛋白质帽子结构中有一个成分是eIF4G,起RNA 解旋酶的作用,在病毒感染的后期,FMDV 3Cpro也可以裂解eIF4G,从而破坏帽子结构并使宿主细胞RNA无法解旋,抑制宿主抗病毒蛋白的合成,但相比于Lpro的裂解过程稍晚[25],而且只能对eIF4G只能部分切割,并不能完全阻断细胞的翻译[26-27]。当机体被FMDV所感染后,3Cpro蛋白酶可参与切割宿主细胞核中的组蛋白3(histone 3, H3),已有研究证明3Cpro蛋白酶在宿主组蛋白H3裂解中起主要作用。当3Cpro蛋白酶破坏了H3的完整性后,染色质的复制或转化为染色体的过程将受到影响,残缺的H3无法满足DNA在转录起始之前所要求相对应的基因组在空间结构上变化的要求,从而使宿主细胞遗传物质的复制和转录受阻[28]。除此之外,3Cpro蛋白还可裂解天然免疫调控关键分子NEMO、降低LGP2的表达[29]以及阻断STAT1/STAT2的入核[30]等方式来拮抗天然免疫信号。因此,在GRK2拮抗FMDV复制的过程中,3Cpro能够负反馈调节宿主细胞蛋白的转录和翻译,导致抗病毒基因GRK2的低水平表达,从而逃避宿主细胞的抗病毒防御反应。3Cpro可能通过水解GRK2发挥拮抗作用,抑制宿主抗病毒反应,促进自身复制。
综上所述,GRK2能够显著抑制FMDV的复制,虽然其抑制FMDV复制的机制尚不清楚,但本研究初步证实了GRK2抑制FMDV复制的作用,并揭示了病毒如何拮抗其发挥的抗病毒作用,为深入开展宿主蛋白GRK2调控FMDV复制的机制研究奠定了理论基础,为FMDV的防控提供了新的视角。
4 结 论
成功构建了猪的GRK2真核表达质粒,并通过Western blot验证了其表达和IFA证实猪的GRK2蛋白定位于细胞的胞质中。感染试验发现FMDV可以调控内源性GRK2的表达,呈现先上调后下调的趋势。过表达试验证实GKR2的上调表达可以明显的抑制FMDV的复制,siRNA干扰试验表明下调表达GRK2可以促进FMDV的复制。通过探究GRK2与FMDV的病毒蛋白之间的关系发现,3Cpro也可抑制GRK2的表达,促进病毒自身的复制。这说明GRK2在动物机体抗FMDV感染过程中发挥着抗病毒功能,但病毒可以通过一定方式抑制拮抗其发挥的抗病毒作用,从而保障病毒自身的复制。本研究为进一步揭示宿主蛋白GRK2的抗病毒作用研究提供了理论基础。
