系统性红斑狼疮继发噬血细胞综合征1例*
2023-10-28赵金伟曹一鹏
杨 瑞 赵金伟 曹一鹏 李 玲
1 天津市人民医院 300121; 2 天津医科大学肿瘤医院
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种累及多系统和脏器的自身免疫性疾病,在疾病发展过程中,免疫复合物的沉积及自身抗体的激活也可能介导噬血现象。噬血细胞综合征(Hemophagocytic lymphohistiocytosis,HLH)是一种不受控制的免疫激活综合征,不及时治疗会危及生命。在早期,HLH与SLE某些临床特征相似,但HLH的病程进展迅速,死亡率较高。本文旨在提高临床医生对SLE相关HLH的认识和警惕,以促进该病的早期诊断和治疗。
1 病例资料
患者女,39岁,因“间断发热、皮疹、关节痛8年,再发7d”于2021年3月2日入院。患者8年前曾出现发热、皮疹、关节痛等症状,诊断为“系统性红斑狼疮、狼疮性肾炎”,经口服醋酸泼尼松、环磷酰胺、甲氨蝶呤等治疗后病情缓解,随后逐渐减少药物剂量,近1年来口服泼尼松2.5mg qd及羟氯喹0.2g bid治疗。在入院前3个月,再次出现双手指间关节肿痛,加用甲氨蝶呤4片qw治疗,由于脱发明显,改用来氟米特10mg qd治疗。在入院前1周,患者无明显诱因出现发热,体温达39.0℃,伴有畏寒和关节肿痛,无新发皮疹和口腔溃疡,无咳嗽、咳痰,无尿急、尿痛,无腹胀、腹泻,症状持续不缓解。既往无高血压、糖尿病等慢性病史,无特殊用药及毒物接触史,家族中无遗传病史。
入院体格检查:T 37.4℃ ,R 21次/min,P 104次/min,BP 110/75mmHg(1mmHg=0.133kPa)。神志清楚,颈部皮肤可见片状淤斑,余全身皮肤黏膜未见皮疹。双侧颈部可触及2个绿豆大小肿大的淋巴结,质软,按压无疼痛。咽红,扁桃体无肿大。双手第2、3近端指间关节肿胀、压痛,活动受限。心肺查体阴性,肝脾未及。双下肢无水肿。四肢肌力正常,病理征阴性。
辅助检查:血常规:白细胞计数(WBC)6.48×109/L,中性粒细胞百分比(NEUT%) 89.3%,血红蛋白(Hb)117g/L,血小板计数(PLT)212×109/L;凝血功能示:纤维蛋白原(FIB)4.73g/L,D-二聚体1.29μg/ml;生化示:白蛋白(ALB)36.9g/L,谷丙转氨酶(ALT)27U/L,谷草转氨酶(AST)39U/L,γ-谷氨酰转肽酶(GGT)106U/L,碱性磷酸酶(ALP)95U/L,甘油三酯 (TG)2.12mmol/L;免疫球蛋白G(IgG)18.8g/L,免疫球蛋白E(IgE)143.71g/L,补体C3 0.56g/L,补体C4 0.07g/L,抗核抗体(ANA)阳性,颗粒型1∶1 000,抗核糖核蛋白/史密斯抗体(nRNP/Sm)阳性,抗干燥综合征A抗体(SS-A)阳性,抗增殖细胞核抗原抗体(PCNA)阳性,抗双链DNA抗体(dsDNA)阳性,抗核糖体P蛋白抗体(ARPA)阳性,抗中性粒细胞胞浆抗体谱阴性;血沉(ESR)50mm,C-反应蛋白(CRP)9.3mg/L,铁蛋白(SF)775.13μg/L,白细胞介素-6(IL-6)116.78pg/ml;24h尿蛋白定量0.14g;T淋巴细胞亚群:CD3+T细胞/淋巴细胞 89%,CD3+CD4+T细胞/淋巴细胞 64%,B细胞/淋巴细胞 2%;尿便常规、类风湿因子、抗CCP抗体、APF、AKA未见异常;G试验、EB病毒DNA、巨细胞病毒DNA、γ-干扰素释放试验(TB-SPOT)、肝炎病毒、人类免疫缺陷病毒+梅毒阴性;四套双侧血培养(1周内):阴性。影像学检查提示:胸部CT未见明显异常;腹部彩超示:胆囊壁增厚,右肾实性占位(考虑错构瘤)。入院后继续接受泼尼松2.5mg qd、来氟米特10mg qd治疗,考虑患者急性起病,以发热为突出表现,故经验性使用哌拉西林钠他唑巴坦4.5g q8h抗感染治疗。患者仍持续发热,最高体温达39.2℃,在住院第3天开始予以甲泼尼龙40mg bid静脉滴注治疗,并加用洛索洛芬钠片60mg tid口服退热,症状略有改善。
根据该患者的病史和治疗过程:患者为中年女性,慢性病程,本次再发发热、关节肿痛及皮肤淤斑入院。根据化验结果,血液检查炎症指标升高,多个自身抗体包括抗核抗体、抗dsDNA抗体和SSA抗体等自身免疫抗体阳性,补体下降,SLEDAI-2K为7分。SLE是一种自身免疫性疾病,常表现为多系统损害,包括但不限于发热、皮疹、关节痛、肾炎等。因此,该患者的诊断为SLE复发,狼疮性肾炎。由于患者长期服用激素和免疫抑制剂,虽感染筛查结果为阴性,仍不能完全除外感染性发热。
住院第8天患者仍有间断发热,精神稍差,复查发现血细胞三系计数下降,铁蛋白和转氨酶升高,FIB降低,NK细胞活性降低,可溶性白介素2受体(sIL-2R/sCD25)升高,骨髓涂片显示:粒系统比例增高,红系统、巨核系统两系比例正常,片中可见吞噬细胞,反应性噬血细胞综合征待除外。以上符合HLH-2004诊断标准[1]。患者的治疗方案改为地塞米松7.5mg q8h静脉注射和环孢素A(CsA)75mg bid,加用复方新诺明2片bid口服预防卡氏肺孢子虫肺炎等并发症,患者体温降至正常,激素逐渐减量。第16天,患者的血细胞计数升高,铁蛋白下降,ALT和AST恢复至正常水平,地塞米松减量为5mg q12h。第20天,患者带药出院,使用泼尼松30mg qd和20mg qn,规律随诊复查减量激素,一般情况好,未再发热。在出院后3周复查化验指标明显好转。3个月后随访未复发。患者治疗过程中的部分化验结果见表1。
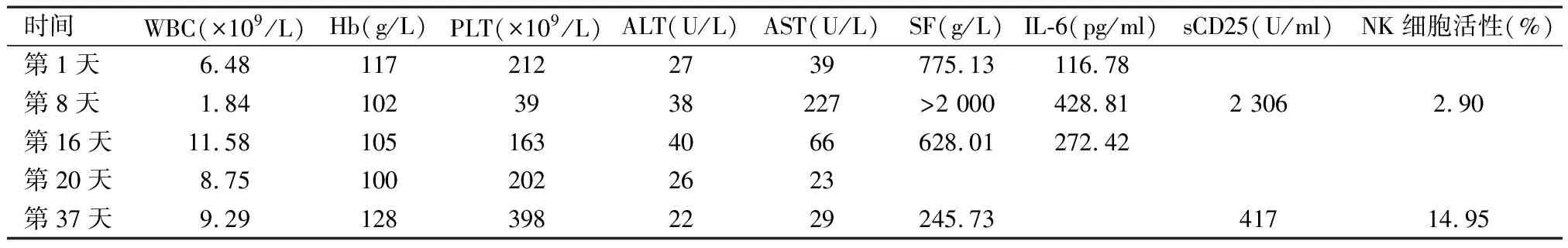
表1 化验结果
2 讨论
1991年组织细胞学会正式提出HLH的概念,随着对此病的不断认识,近年来确诊率逐年递增。HLH与特定遗传因素有关,根据病因不同分为原发性(遗传性)和继发性(反应性)。原发性HLH多数有阳性家族史,是一种常染色体隐性遗传病,筛查可发现Unc13D、STX11、SH2D1A和BIRC4等基因缺陷[2],导致蛋白表达缺失和NK细胞的细胞毒性,最常影响2岁以下儿童,且发病年龄越小,病死率越高。继发性HLH与全身性感染、恶性肿瘤、自身免疫性疾病和某些药物治疗等有关,近1/3的成人病例有一个潜在原因。Schram等[3]统计了68例HLH患者,平均随访时间为(32±2)个月,其中恶性肿瘤最常见(49%),感染相关HLH占33%,自身免疫性疾病占28%,特发性HLH占22%。专家认为感染相关HLH是继发性因素中最常见的形式,其中疱疹病毒科的EB病毒感染是最主要的诱因[4]。巨噬细胞活化综合征(MAS)是特指风湿性疾病引起的HLH,SLE和成年型斯蒂尔病(Adult onset Still’s disease,AOSD)是常见病因。
SLE并发MAS的发病率为0.9%~4.6%[5]。其病理机制可能包括:(1)免疫复合物沉积于骨髓造血细胞,与SLE的疾病活动有关,称为急性狼疮噬血细胞综合征;(2)自身抗体介导机制;(3)NK细胞活性降低,淋巴细胞的活化致炎症因子(如TNF-α、IL-6、IL-8)过度分泌。其中,细胞因子过度分泌可能与MAS的主要临床和实验室特征的发展有关,并有助于组织损伤和进行性全身器官衰竭的发生。
MAS的首发症状是非特异性的,易被误诊、漏诊,通常为急性或亚急性(1~4周),其主要临床特征包括持续高热(>38.5℃)和淋巴造血器官肿大、至少两系的血细胞减少和骨髓中发现噬血现象等。部分患者可能有非特异性皮肤受累,表现为高度多形性,包括红斑疹、全身性红皮病、水肿、淤点或紫癜等。这些临床特征是由于活化的T细胞(Th1细胞)和巨噬细胞功能受损产生过量细胞因子,从而导致连锁反应[6]。因此,当皮肤出现病变,尤其是皮下的泛胰腺样结节时,应与潜在的T细胞淋巴瘤相鉴别。本例患者既往明确诊断为SLE、狼疮性肾炎,长期服用激素和免疫抑制剂。在疾病进展过程中,出现发热、关节肿痛、皮肤淤斑,结合病史和查体,给予抗菌药物治疗的同时完善一系列检查,排除了肿瘤引起的发热,考虑SLE诊断明确,为活动期。给予相关治疗后,仍有间断发热,复查发现血细胞减少,血清铁蛋白和转氨酶升高,FIB下降,故临床上应高度警惕MAS的可能性。由于MAS缺乏特异性的实验室检查及病理特点,目前临床中大多沿用2004年国际组织细胞学会修订的HLH诊断标准以确诊,根据标准继续完善sIL-2R/sCD25升高,NK细胞活性降低,骨髓涂片可见吞噬细胞,且患者家族中无HLH家族史,成人MAS诊断最终得以明确。在疾病早期,MAS患者的外周血中不仅有TNF-α和IL-6升高,而且sIL-2R/sCD25、可溶性CD8(sCD8)以及尿中新蝶呤的水平均有增加。Jordan等[7]认为sCD25是最有用的炎症标志物之一,因为它与疾病当前活动的相关性比铁蛋白或其他指标更一致。铁蛋白也是诊断MAS的重要依据之一,当SF>10 000μg/L时,对诊断MAS是高度敏感和特异性的。但许多医院不具备sCD25的检测条件,在诊断时不应因为这一单一特征而延误。姚海红等[8]的研究也发现,MAS患者血清铁蛋白中位值为4 033μg/L,明显高于HLH-2004国际诊断指南(>500μg/L),当血清铁蛋白>662.5μg/L可能用于预测SLE患者MAS的发生。血细胞减少也是MAS的重要实验室标记物,成人病例中约80%的患者有血小板减少和贫血,69%有白细胞减少,Coombs试验阳性的情况比较少见[6]。而SLE活动期即使未合并MAS也常出现血细胞下降,对于疑似MAS的患者,积极进行其他相关筛查有助于早期识别。应该注意的是,过度炎症、凝血功能障碍和血小板减少使MAS患者自发性出血的风险非常高。在疾病早期,骨髓穿刺发现噬血细胞的概率较低,对于高度怀疑MAS的患者,需要时应反复穿刺以获得更准确的结果。
与其他潜在原因引起的HLH相比,MAS的预后较好。MAS的治疗多采用类固醇激素或联合CsA治疗。CsA是一种强效的免疫抑制剂,对T淋巴细胞的活化与增殖有明显的抑制作用,对于家族性组织细胞增生症和激素抵抗的MAS尤其是危重患者有显著疗效,早期使用可降低患者病死率。如患者对治疗反应较差,则推荐使用HLH-2004方案。部分患者需要激素冲击治疗,以及使用英夫利西单抗、达珠单抗和阿伦单抗等新型药物作为HLH的补救性治疗,需严格监测病情发展,应考虑到继发感染的问题[7]。对于危及生命的急性出血患者,可能需要输注血小板、新鲜冷冻血浆和活化因子。本例患者采用糖皮质激素联合环孢素A治疗,治疗结果表明对原发病和MAS的控制都有利。需要警惕,部分活动性SLE患者会继发MAS,对于血细胞、铁蛋白等相关指标持续异常的患者,尤其常规激素治疗后效果欠佳者,有必要将MAS纳入鉴别诊断,并及时治疗,以改善患者预后。
