非小细胞肺癌患者血清miR-374b-5p、VEGF-C 的表达及与预后的关系
2023-10-28李敏婕刘淑红陈洪云余海青
李敏婕 刘淑红 陈洪云 余海青
1.山东省临沂市肿瘤医院内三科,山东临沂 276000;2.山东省临沂市肿瘤医院内五科,山东临沂 276000
肺癌是世界范围内第二常见和死亡率最高的恶性肿瘤,2020 年全球新发和死亡病例达220.7、179.6万例,我国肺癌新发和死亡病例达81.6、71.5 万例,居全球首位[1]。临床超过80%为非小细胞肺癌(non-small cell lung cancer,NSCLC),晚期NSCLC 患者5 年生存率不足5%[2-3]。研究显示,微RNA(microRNA,miRNA)参与NSCLC 发生和进展[4-5]。有研究报道,miR-374b-5p在黑色素瘤和乳腺癌等恶性肿瘤的进展有关[6-7]。研究表明,血管生成与肿瘤发生发展密切相关[8]。血管内皮生长因子C(vascular endothelial growth factor-C,VEGF-C)是VEGF 家族的新成员,在血管生成中发挥重要作用[9]。研究报道,VEGF-C 参与膀胱癌、卵巢癌等恶性肿瘤细胞的侵袭和转移过程[10-11]。基于此,本研究探讨血清miR-374b-5p、VEGF-C 表达与NSCLC 患者病理参数和预后的关系。

图1 miR-374b-5p 与VEGF-C 结合位点图
1 资料与方法
1.1 一般资料
选取2018 年2 月至2019 年9 月山东省临沂市肿瘤医院(以下简称“我院”)收治的105 例接受手术切除的NSCLC 患者为NSCLC 组,其中男60 例,女45例;年龄41~82 岁,平均(59.27±8.32)岁。纳入标准:①经病理证实为NSCLC;②初诊且未接受过抗肿瘤治疗;③TNM 分期Ⅰ~Ⅲ期;④接受根治手术;⑤年龄≥18 岁。排除标准:①合并其他部位恶性肿瘤;②合并血液、免疫系统损害;③院内死亡或不能接受随访。另选取我院同期54 名体检健康者为对照组,其中男31 例,女23 例;年龄24~77 岁,平均(58.15±7.17)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究受试者或家属知情并签署知情同意书,并经我院伦理委员会批准(2018 伦字011)。
1.2 研究方法
采集NSCLC 组入院次日和对照组体检时静脉血3 ml,离心后取上层血清,取部分血清通过Trizol 法提取血清总RNA,微量分光光度计验证纯度、浓度合格后使用TaKaRa 反转录试剂盒(上海翌圣生物科技股份有限公司,编号:11111ES)合成cDNA。参考SYBRPremix Ex TaqTM试剂盒(广州威佳科技有限公司,编号:RR902Q)说明书进行扩增,miR-374b-5p:正向引物5’-TCAAGGAGAAGAGACTATATTTGC-3’,反向引物5’-ACTCCAAACTCCTTCCCCACAT-3’;内参U6:正向引物5’-CAACAGCCTCAAGATCATCAGC-3’,反向引物5’-TTCTAGACGGCAGGTCAGGTC-3’;引物设计和合成由上海新贝生物科技有限公司完成。95℃90 s,95℃30 s、63℃30 s、72℃15 s,循环40 次反应结束后,2-ΔΔCT法计算血清miR-374b-5p 相对表达量。剩余部分血清采用酶联免疫吸附试验法(上海瓦兰生物科技有限公司,编号:E01585)检测VEGF-C水平。
1.3 分组方法
患者出院后通过门诊或电话随访3 年(截至2022 年9 月)。根据NSCLC 患者血清miR-374b-5p、VEGF-C 表达平均值分为miR-374b-5p 高、低表达组和VEGF-C 高、低表达组,统计不同组别患者生存情况。
1.4 统计学方法
采用SPSS 28.0 统计学软件进行数据分析。计量资料用均数±标准差()表示,比较采用t 检验;计数资料用例数或百分率表示,比较采用χ2检验;血清miR-374b-5p 与VEGF-C 的相关性采用Pearson 相关系数;miR-374b-5p 与VEGF-C 结合位点预测采TargetScan 数据库https://www.targetscan.org/;K-M 法绘制不同miR-374b-5p、VEGF-C 表达NSCLC 患者生存曲线;NSCLC 死亡的影响因素采用Cox 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清miR-374b-5p、VEGF-C 表达比较
NSCLC 组血清miR-374b-5p 表达低于对照组,VEGF-C 表达高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组血清miR-374b-5p、VEGF-C 表达比较()

表1 两组血清miR-374b-5p、VEGF-C 表达比较()
注miR-374b-5p:微RNA-374b-5p;VEGF-C:血管内皮生长因子C;NSCLC:非小细胞肺癌。
2.2 miR-374b-5p 与VEGF-C 结合位点
miR-3746-5p 与VEGF-C 结合下点预测采TargetScan 数据库https://www.targetscan.org/miR-374b-5p与VEGF-C 的3’-非翻译区381-388 和585-591 处存在结合位点。见图1。
2.3 NSCLC 患者血清miR-374b-5p 与VEGF-C 表达的相关性
NSCLC 患者血清miR-374b-5p 与VEGF-C 表达呈负相关(r=-0.735,P<0.001)。
2.4 NSCLC 患者血清miR-374b-5p、VEGF-C 表达与病理参数的关系
不同分化程度、TNM 分期、淋巴结转移NSCLC 患者血清miR-374b-5p、VEGF-C 表达比较,差异有统计学意义(P<0.05)。见表2。
表2 NSCLC 患者血清miR-374b-5p、VEGF-C 表达与病理参数的关系()

表2 NSCLC 患者血清miR-374b-5p、VEGF-C 表达与病理参数的关系()
注NSCLC:非小细胞肺癌;miR-374b-5p:微RNA-374b-5p;VEGF-C:血管内皮生长因子C。
2.5 NSCLC 患者血清miR-374b-5p、VEGF-C 表达与生存时间的关系
105 例NSCLC 患者随访3~36 个月,失访5 例,死亡44 例,中位生存时间为29.4 个月。miR-374b-5p高表达组(≥1.09,55 例)中位生存时间为31.9 个月,低表达组(<1.09,50 例)中位生存时间为26.5 个月;VEGF-C 高表达组(≥651.21pg/ml,52 例)中位生存时间为32.1 个月,VEGF-C 低表达组(<651.21 pg/ml,53 例)中位生存时间为26.6 个月。不同miR-374b-5p、VEGF-C 表达NSCLC 患者生存曲线比较,差异有统计学意义(χ2=7.402、8.108,P=0.007、0.004)。见图2。

图2 不同血清miR-374b-5p、VEGF-C 表达NSCLC 患者K-M 生存曲线
2.6 NSCLC 死亡的单因素和多因素Cox 回归分析
以性别(男=1;女=0)、年龄(≥60 岁=1;<60 岁=0)、吸烟(是=1;否=0)、病理类型(腺癌=1;鳞癌=0)、肿瘤大小(≥5 cm=1;<5 cm=0)、分化程度(低分化=1;中高分化=0)、TNM 分期(Ⅲ期=1;Ⅰ~Ⅱ期=0)、淋巴结转移(有=1;无=0)、miR-346-5p(连续变量)、VEGF-C(连续变量)为自变量,随访时间为时间变量,生存状态(死亡=1;存活=0)为因变量进行Cox 回归分析。结果显示,TNM 分期Ⅲ期、有淋巴结转移、VEGF-C 升高为NSCLC 死亡的独立危险因素(HR=3.195、4.212、1.102,P<0.05),miR-374b-5p 升高为独立保护因素(HR=0.988,P<0.05)。见表3。
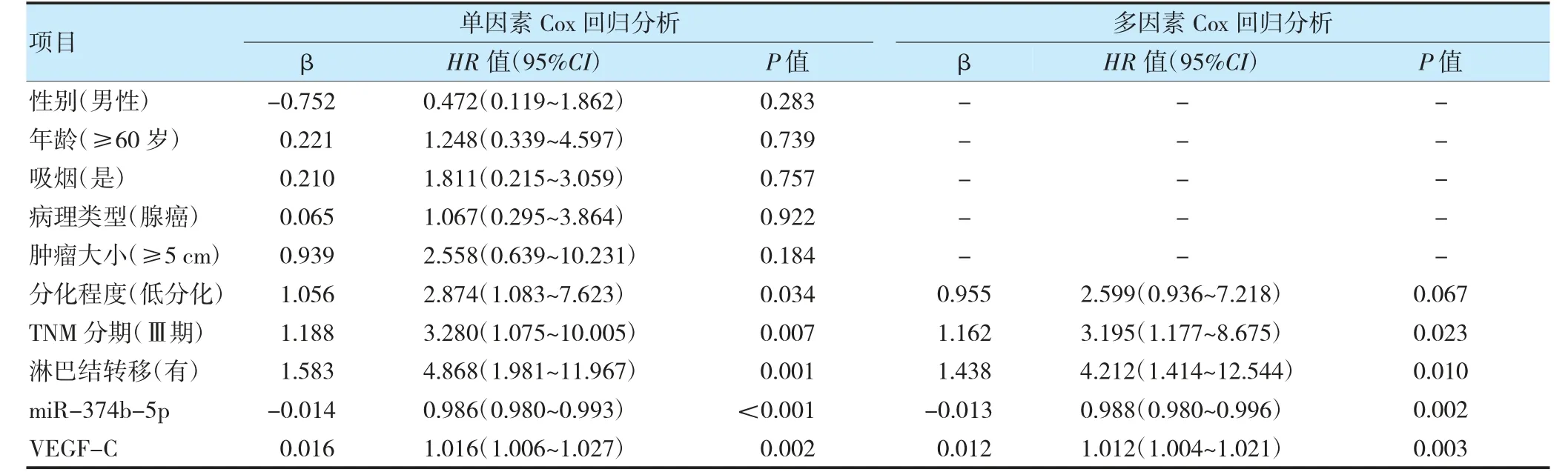
表3 NSCLC 死亡的单因素和多因素Cox 回归分析结果
3 讨论
NSCLC 是起源于支气管至终末肺泡所有上皮细胞恶性肿瘤的统称,截至目前手术切除仍然是早中期NSCLC 最有效的治疗方法[12]。尽管近年来肿瘤分子生物学的进展推动实现了靶向和免疫疗法,但仅部分NSCLC 患者获得临床效益,且随着治疗时间的延长获得性耐药越来越多,预后也越来越差[13-14]。NSCLC的发生发展是多因素参与的复杂过程,表观遗传学在NSCLC 中扮演重要角色[15]。miRNA 是表观遗传学的新的研究热点,能通过与mRNA 的3’-非翻译区互补或配对引发mRNA 降解或转录后沉默,进而调控NSCLC 发生发展[16-17]。miR-374b-5p 定位于人X 染色体长臂13.2 处,能通过调节T 细胞分化参与免疫炎症反应过程。近年研究发现,miR-374b-5p 参与肿瘤过程,如miR-374b-5p 能靶向高迁移率族蛋白B1/Wnt3a/β-连环蛋白通路抑制卵巢癌细胞增殖、侵袭、迁移和上皮-间质转化和抑制凋亡[18];同时能靶向基质金属蛋白酶14,抑制神经胶质瘤细胞增殖、迁移、侵袭[19]。miR-374b-5p 在多种恶性肿瘤中发挥抑制作用。本研究结果显示,NSCLC 患者血清miR-374b-5p低表达,并与分化程度、TNM 分期、淋巴结转移有关。提示miR-374b-5p 在NSCLC 患者血清中低表达可能与其启动子被甲基化导致表达沉默有关。而随着miR-374b-5p 表达下调,可上调富含丝氨酸/精氨酸剪接因子7,能识别前体RNA 剪切元件招募组装剪接体,促进NSCLC 细胞增殖、迁移、侵袭和抑制凋亡[20-21]。
肿瘤细胞持续分裂和增殖会消耗大量的氧气和营养物质,高耗氧和营养物质缺乏不利于肿瘤细胞生长,为此肿瘤需要通过形成新的血管以获取更多的氧气和营养物质[22]。肿瘤新生血管的生长和成熟是血管生成促进因子和抑制因子复杂的协调过程,VEGF-C是血管生成因子VEGF 家族新发现的一个成员,能通过结合VEGF 受体2、VEGF 受体3 刺激血管内皮细胞迁移和增生,促进新生血管生成[23]。研究报道,VEGF-C 能通过促进肿瘤新生血管生成促进结直肠癌、肺腺癌等恶性肿瘤的进展[24-25]。本研究结果显示,NSCLC 患者血清VEGF-C 高表达,并与分化程度、TNM分期、淋巴结转移有关。提示VEGF-C 在NSCLC 患者血清中高表达可能与其启动子被癌基因激活有关,而随着VEGF-C 表达上调促进肿瘤新生血管生成,进而促进NSCLC 恶性进展[26]。本研究通过TargetScan 数据库预测发现,miR-374b-5p 与VEGF-C 存在结合位点;相关性分析发现血清miR-374b-5p 与VEGF-C表达呈负相关。提示二者可能共同参与NSCLC 发生发展。赵丽霞等[27]研究报道,上调miR-374b-5p 能靶向下调VEGF-C 表达,抑制NSCLC 细胞增殖、上皮-间质转化、迁移和侵袭。本研究结果显示,血清miR-374b-5p 高表达和VEGF-C 低表达的NSCLC 患者中位生存时间长,且二者均为NSCLC 患者死亡的独立影响因子。提示血清miR-374b-5p、VEGF-C 表达与NSCLC 患者预后有关,有望成为NSCLC 患者预后的潜在指标。
综上所述,NSCLC 患者血清miR-3 74b-5p 和VEGF-C 与病理参数和预后相关,二者可能共同参与NSCLC 进展。但本研究还需进一步扩大样本研究证实,并进一步研究miR-374b-5p、VEGF-C 参与NSCLC的机制。
