气液相等离子体诱变选育安普霉素高产菌株的研究
2023-10-27向继武谭小芳
丁 强,向继武,周 明,程 波,谭小芳 ,闫 雪,沈 洁
1. 宜昌三峡制药有限公司,湖北 宜昌 443000;
2. 武汉工程大学环境生态与生物工程学院,湖北 武汉 430205;
3. 宜昌人福药业有限责任公司,湖北 宜昌 443000 ;
4. 中国科学院合肥物质科学研究院,安徽 合肥 230000
安普霉素是美国Eli Lilly 公司首次发现的,由黑暗链霉菌合成的一种氨基环醇类抗生素中尼拉霉素复合物的一个组分[1],又名阿普拉霉素,其分子式为C21H41N5O11,由3 部分组成,分别为4-氨基-4-脱氧-α-吡喃型葡萄糖,辛二糖胺,2-脱氧链霉胺,其结构如图1 所示。安普霉素具有广谱抗菌性,在兽药范围和畜禽类养殖经济领域被普遍使用于畜禽类的肠道感染治疗,特别是对幼禽因为大肠杆菌、沙氏门菌等导致的腹泻,肠道炎症的治疗和预防上,效果非常显著[2];在畜禽养殖上,适量的安普霉素用于饲料添加剂,可以使畜禽体重获得明显增加,达到提前出栏的效果[3],研究还表明,安普霉素作为饲料添加剂的成分能有效提高水产养殖中鱼、虾增的重率和蛋白质效率[4],市场前景巨大。
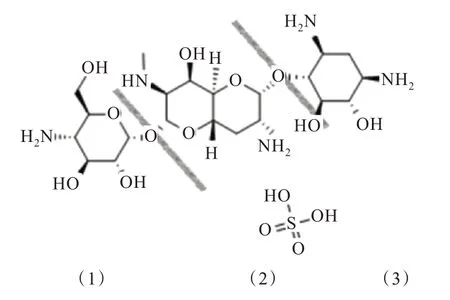
图1 安普霉素分子结构式Fig.1 Molecular structure of apramycin
为了获得适应大规模工业发酵的安普霉素优良生产菌株,目前对安普霉素生产菌株的研究主要集中以下3 个方面:其一是采用传统诱变方法如紫外、化学法等提高其产品效价[5];其次对安普霉素的发酵条件进行优化以获得更高的生产效率[6-10];另外对安普霉素合成途径进行了解析[11],为安普霉素产品的开发和菌种选育提供了参考,例如李相丰等[12]推断出了安普霉素可能的合成途径,即葡萄糖起始合成巴龙霉胺后经环合生成安普霉胺,进一步与4-氨基-4-脱氧葡萄糖连接,最终生成了安普霉素,王普宏[13]通过阻断tacA 基因获得安普霉素单组份突变株。目前,不论是传统诱变方法还是基因工程改造技术都在提高安普霉素效价方面取得了相当的成效并广泛用于产业化生产。可见,通过诱变育种将安普霉素工业生产菌株的产品效价提高是行之有效的[14]。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)技术因其温和安全、突变率高等特点,在菌种诱变上得到了广泛的应用[15]。而中国科学院合肥物质科学研究院通过结合近年来发展起来的大气压低温等离子体诱变育种技术,集电子、离子、激发态中性分子、自由基、电场、紫外辐射等诸多生物诱变因素,提出气液相等离子体,以空气作为放电气体,通过电极间形成的等离子体通道注入到水溶液中的改进常压室温等离子体诱变系统[16]。由于采用空气(主要成分为N2、O2)激发产生等离子,并且等离子体直接与水溶液接触,可以产生丰富的高浓度活性氧(如OH、氧原子、O2-、H2O2等)和活性氮基团(如激发态氮分子、NO 等),高含量活性氧、活性氮及磁场双重作用下,将大大提高菌株突变率和突变库容量,结合通量筛选技术,磁场协同气液等离子体技术有望成为高效诱变育种的新方法[17]。改进后的气液相等离子体诱变技术具有操作方便,经济成本低;对菌株遗传物质损伤多样性,可以提高获得突变菌株的概率;诱变安全,对人体无害,对环境无污染等诸多优点。因此本试验将中国科学院等离子体物理研究所的气液等离子体技术应用于安普霉素生产菌株的诱变育种,建立并优化诱变工艺,期望为获得稳定高产的安普霉素工业菌株提供参考。
1 实验部分
1.1 菌 种
诱变出发菌株:黑暗链霉菌(Streptomyces tenebrarius)A-0,为本公司保藏菌种。
生物效价检测用菌种:枯草芽孢杆菌(bacillus subtitles)。
1.2 培养基
平板选择培养基各组分质量分数(%):葡萄糖1.0 ,蛋白胨0.5 ,牛肉膏0.1,酵母膏0.1 ,NaCl 0.2 ,MgSO4.7H2O 0.025,琼脂粉1.5,溶于pH 7.2的蒸馏水。
斜面培养基各组分质量分数(%):可溶性淀粉2.0,NaCl 0.05,KNO30.1 ,K2HPO4.3H2O 0.05,MgSO4.7H2O 0.05 ,FeSO4.7H2O 0.001,琼脂2.0,溶于pH 7.4~7.6 的自来水。
种子瓶培养基各组分质量分数(%):葡萄糖3.0,玉米淀粉2.0 ,黄豆粉2.5 ,酵母粉0.1,碳酸钙0.2,,硫酸镁0.1,玉米浆1.5,硫酸铵0.1。
发酵瓶培养基各组分质量分数(%):葡萄糖4.0,玉米淀粉2.0,黄豆饼粉4.0,酵母粉0.5,蛋白胨1.0,玉米浆0.5,硫酸铵0.5,硫酸镁0.4,磷酸二氢钾0.1,淀粉酶0.2,碳酸钙0.5,豆油0.5。
1.3 试 剂
国药集团化学试剂有限公司:NaCl,MgSO4·7H2O,KNO3,K2PO4·3H2O,FeSO4·7H2O,硫酸铵,碳酸钙,磷酸二氢钾,氯化铵,琼脂粉。
北京奥博星生物技术有限公司:葡萄糖,牛肉膏,可溶性淀粉,玉米粉,玉米浆,蛋白胨,黄豆饼粉,豆油,淀粉酶。
安琪酵母有限公司:酵母粉,酵母膏。
阿拉丁化学试剂网:安普霉素标准品(K0231610 1mg 含517 单位安普霉素)。
北京中海生物科技有限公司:抗生素检定培养基1 号。
美国Fisher公司:甲醇(色谱纯)。
1.4 仪器及设备
本实验使用的仪器设备见表1。
表1 仪器及设备型号Tab.1 Models of instruments and equipment
1.5 实验方法
以Streptomyces tenebrarius菌株A-0 为出发菌株,采用改进后的气液相等离子体诱变技术进行诱变育种,实验路线见图2。
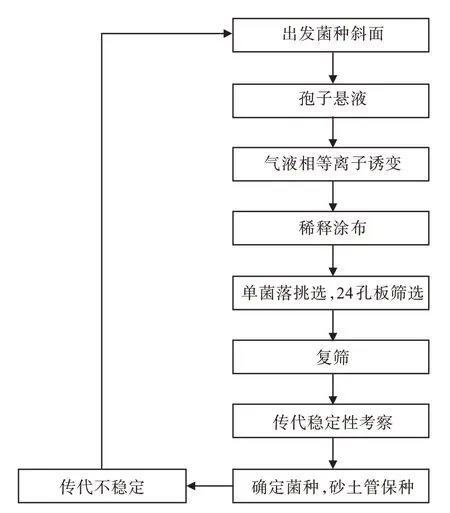
图2 安普霉素菌种气液相等离子体诱变实验路线Fig.2 Experimental route of gas-liqiud phase plasma mutagenesis of apramycin strains
1.5.1 安普霉素斜面培养 制备安普霉素茄子瓶斜面,30 ℃空培5~7 d,目测无杂菌后接种0.1 mL孢子液,37 ℃培养7 d,待斜面孢子转白后收入冰箱保藏备用。
1.5.2 菌悬液制备 取灭菌后的纯化水20 mL 将斜面孢子洗下打散并用纱布过滤,调整孢子量为1.0~1.2×108CFU/mL,备用。
1.5.3 气液相等离子体诱变处理菌悬液 以孢子数为1.0~1.2×108CFU/mL 的菌悬液,进行气液相等离子体诱变,基本参数如下:无菌空气流量2.5 L/h,放电功率10 W,温度25~30 ℃,压力为标准大气压,调节离子喷射探头至液面下,距杯底1.0~1.5 cm处,分别处理30、45、60、75、90、105、120 s。处理过程中,在到达预设处理时间时,通过特定取样管道进行取样,用质量分数0.85%生理盐水稀释不同梯度涂布平板,37 ℃恒温培养箱培养5 d,进行平板活菌计数(colony-forming units,CFU),计数诱变致死率,制作致死率曲线。
1.5.4 诱变菌悬液涂布分离 将诱变后的菌悬液用质量分数为0.85%生理盐水按10 的倍数进行梯度稀释,选择10-3、10-4、10-5共3 个梯度进行平板涂布,取样量为100 μL/皿,每批涂布3 个平板,设置空白对照,37 ℃培养5~7 d。
1.5.5 安普霉素菌落初筛 不同单孢子接种的培养平板长满后,分别用灭菌打孔器将(约2~3 cm2)菌片接种到24 孔板中,每孔装5 mL 的发酵培养基,37 ℃,220 r/min,培养120 h。3 000 r/min,5 min 离心发酵液,取上清液用高效液相色谱(high performance liquid chromatography,HPLC)进行含量测定,选择安普霉素含量高的菌株。
1.5.6 安普霉素摇瓶复筛 选择安普霉素初筛后效价较出发菌株有明显提高的突变菌株进行摇瓶复筛。500 mL 摇瓶中装50 mL 培养基,37 ℃,220 r/min,培养120 h,每个菌号做3 组平行实验,采用HPLC 测定安普霉素含量,同时通过枯草芽孢杆菌使用牛津杯法测定安普霉素突变菌株的生物效价。
1.5.7 突变菌株遗传稳定性考察 复筛得到的突变菌株连续传代至第五代,37 ℃,220 r/min,120 h摇瓶考察突变菌株传代的效价,选择第一代和第五代之间效价差距低于5%的菌种,为选育成功,遗传稳定性较好,可以用于生产的菌株。
1.5.8 安普霉素检测及计算方法[14]
(1)致死率计算
诱变后的菌悬液和未经诱变的对照菌悬液分别进行10 的倍数梯度稀释,取10-4、10-5、10-6分别涂布3 个平板,37 ℃,7 d 后进行活菌计算,根据平板上的菌落数量计算致死率。
其中:Q为诱变前对照品菌悬液的菌落数/(CFU/mL);H为ARTP 诱变处理后菌悬液的活菌数/(CFU/mL)。
(2)突变率计算
以安普霉素出发菌A0的效价作为对照组,将效价提高20%及以上和效价降低20%及以下的菌株归为突变菌株,其中效价提高20%及以上的称为正突变菌株,根据下面公式计算突变率和正突变率。
(3)菌浓测定
体积法:用移液管取混合均匀的发酵液10 mL至离心管中,3 000 r/min 离心10 min,然后将上清液倒入计量管中,读取上清液体积,计算菌渣体积,即菌浓。
(4)安普霉素生物效价测定
生物效价测定方法:培养基为抗生素检定培养基1 号;检测菌:枯草芽孢杆菌;样品浓度:高浓度标准品、高浓度样品、低浓度标准品、低浓度样品;培养温度:35~37 ℃;培养时间:16~18 h;R值选取范围:0.9~1.1(若低于或高与则需要重新估供试品效价)。
(5)安普霉素高效液相色谱法测定含量
HPLC检测:色谱柱为Apollo C18 5 μm×250 mm×4.6 mm;柱温:30 ℃;流动相:用20 mL/L 三氟乙酸和1 mL/L七氟丁酸混合后加超纯水定容至1 000 mL;进样量:20 μL;流速:0.8 mL/min;蒸发光温度:110 ℃;气体流量:3.0 L/min。
2 结果与分析
2.1 初始菌种A-0 的安普霉素生物含量
配制0.2 mg/mL 的安普霉素标准溶液为100%,稀释成5 个不同浓度的水平标准溶液,进样检测,以测得的响应信号对应被测物浓度作图,获得标准曲线方程lgA=1.213 2lgC+2.451(R2=0.999 9),其中lgA为峰面积,lgC为样品浓度,R值在0.99 范围内,可见安普霉素标准品溶液线性良好。将安普霉素摇瓶发酵液离心后,取上清液,用0.22 μm 微孔滤膜过滤后进样检测,获得安普霉素的HPLC 图谱,如图3 所示,安普霉素的出峰时间在13.5 min 左右,将峰面积带入标准曲线方程,经过计算得出安普霉素初始菌株A-0 的安普霉素120 h 发酵的生物含量为0.282 mg/mL。
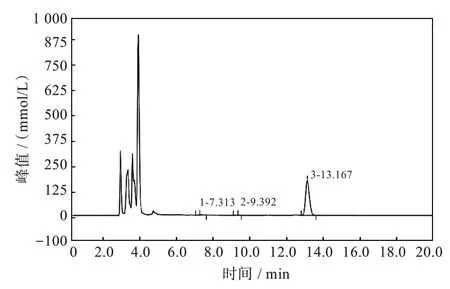
图3 产安普霉素原始菌株A-0 发酵120 h 的HPLC 图谱Fig.3 HPLC diagram of apramycin fermentation broth produced by original strain A-0 after 120 h fermentation
2.2 致死率曲线
通过平板涂布计算气液相等离子诱变每间隔20 s 诱变下菌株的存活个数,确定诱变的致死率,得到最佳的诱变时间。以0 min 诱变时间菌落的死亡率为0 制作致死率曲线,如图4 所示。
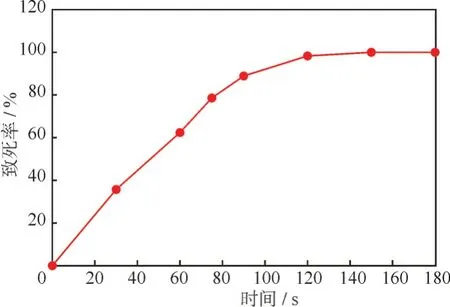
图4 气液相等离子诱变黑暗链霉菌致死率曲线Fig.4 Streptomyces tenebrarius lethality rate curve of gas-liquid phase plasma mutagenesis
由图4 可知,随着气液相等离子体诱变时间的延长,安普霉素菌种的存活率在不断降低,在处理90 s后黑暗链霉菌的的致死率接近90%,处理120 s后基本不再变化,维持在100%的死亡率,。根据现代科学的诱变统计,致死率在75%左右是最佳的诱变点,因此,选择诱变时间75 s 作为后续诱变菌株的最佳节点,在该时间内,黑暗链霉菌的致死率为78.6%,突变率经过计算为43.5%,其中正突变率为22.6%。
2.3 突变菌株筛选结果
2.3.1 气液相等离子体诱变诱变菌株初筛 选择75 s 处理时间用气液相等离子体诱变处理黑暗链霉菌,梯度稀释诱变后的菌悬液,涂布平板选择培养基,37 ℃培养7~12 d 后进行挑单菌落。根据菌落的形态、大小、生长情况,选择较饱满、生长旺盛、单个或形态与原种相比发生很大变化的菌落进行挑选传代,然后将余下的菌苔整个挑下放入24 孔板发酵5 d 考察效价。通过HPLC 法检测安普霉素发酵含量,与原种A-0 含量相比较,50 个筛选菌种里面,共获得5 个较出发菌株安普霉素产量增幅大于5%~30%的突变菌种,如图5 所示,挑选菌号分别为8,12,25,35,47,对突变菌种重新编号,分别对应A-01,A-02,A-03,A-04,A-05。
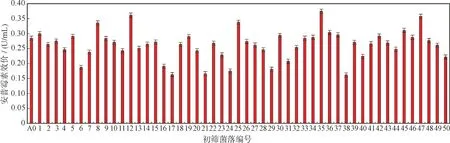
图5 气液相等离子体诱变诱变后突变菌株安普霉素产量的初筛结果Fig.5 Preliminary screening results of apramycin yields after gas-liquid phase plasma mutagenesis
2.3.2 突变菌株复筛 通过初筛得到5 株突变的高效价菌株,将得到的菌株进行3 轮摇瓶复筛,管碟法测定生物效价,与对照A-0 相比较,筛选出来的5 个突变菌株中A-4 的效价最为稳定,基本3 轮复筛都维持在(3 300±100)U/mL 的范围内,其他4个突变菌株在复筛中效价相对稳定,但效价水平均低于A-4 突变菌株,如下图6 所示,故选择A-4进行连续传代考察稳定性。
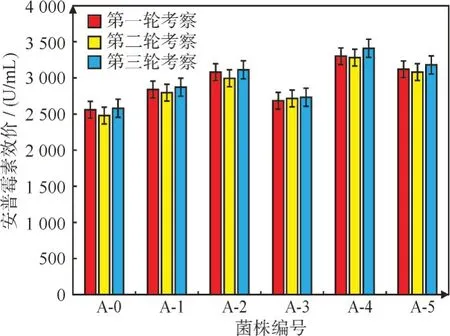
图6 安普霉素突变菌株三轮复筛数据Fig.6 Data of rescreening of apramycin mutant strains for three times
2.3.3 安普霉素A-4 传代遗传稳定性考察 安普霉素突变菌株A-4 在初筛和复筛中菌表现优良,对A-4 突变菌进行连续五次传代,以A-4 一代菌为对照组,摇瓶考察传代后的稳定性,如图7 所示,A-4在连续传代的过程中,一代效价3 330 U/mL,到第五代是效价3 274 U/mL,降低幅度在5%以内,符合生产标准,高效液相色谱测定含量一代最高达到0.375 mg/mL,传代到第5 代,含量维持在0.358 mg/mL,可以进行菌种保藏和生产应用。
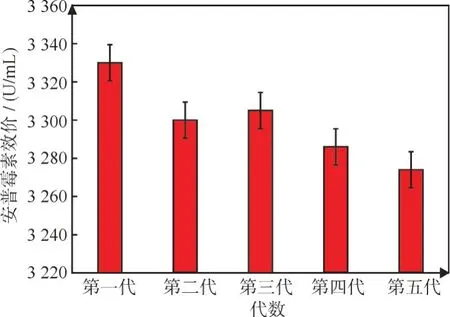
图7 突变菌株A-4 连续传代遗传稳定性考察Fig.7 Genetic stability test of mutant strain A-4 through continuous subculturing
2.3.4 安普霉素突变菌株A-4 摇瓶发酵过程监控 以安普霉素出发菌株A-0 作为对照组,气液相等离子体诱变突变菌株A-4 为试验组,进行安普霉素突变菌的摇瓶发酵,发酵过程中菌丝体积变化(菌浓)和安普霉素产物积累如图8 所示。
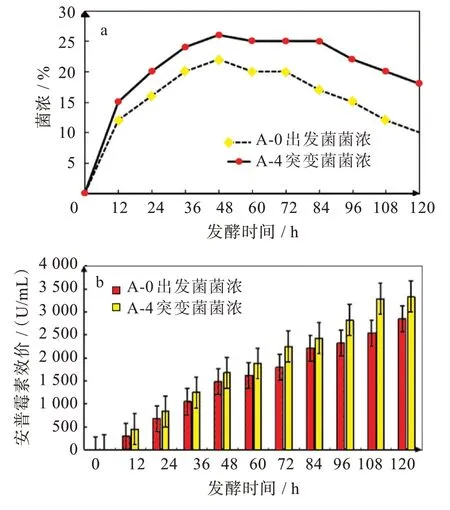
图8 A-0 对照菌与突变菌A-4 发酵过程菌浓变化和发酵过程产物积累情况:(a)菌浓变化情况,(b)发酵过程产物积累情况Fig.8 (a)Variation trends of strain concentration during fermentation process,(b)comparison of product accumulation during fermentation process of comparison strain A-0 and mutant strain A-4
从图8 可以看出突变菌株的菌丝生长更快,在48 h 达到生长的最高峰,未诱变的出发菌株A-0 的菌丝开始溶解,菌浓在72 h 后不断下降,而突变菌A-4 则在84 h 菌浓才开始下降,突变菌菌丝溶解速度较原始菌缓慢,可见突变菌的稳定期要比原始菌株长,推测突变菌株A-4 生长和合成安普霉素的时间较长,从而在相同发酵时间内积累更多产物,从而发酵水平有所提高。如图8 所示,84 h 以后原始菌株A-0 安普霉素的积累变得缓慢,到发酵结束36 h 内增长的效价不多,在500 U/mL 左右,但突变菌株A-4 在84 h 后产物仍维持较快的增长速度,到120 h 时,突变菌株的生物效价为3 420 U/mL,较84 h 效价增长了900 U/mL 左右,突变菌株较原始菌株A-0 发酵终点的生物效价2 580 U/mL,提高了32.6%。
3 结 论
本研究通过气液相等离子体技术诱变安普霉素产生菌黑暗链霉菌A0,获得了一株效价提高并具有稳定遗传性的安普霉素高产突变菌株A-4。结果表明气液相等离子体诱变技术对黑暗链霉菌在一定的致死率下有较强的诱变效果,处理75 s后致死率达到78.6%,正突变率达到最佳效果28.9%,筛选得到的突变菌株A-4 生物效价达到3 420 U/mL,摇瓶发酵安普霉素含量0.375 mg/mL,较出发原始菌株A-0 效价提高了32.6%。气液相等离子体诱变得到的突变菌株在经过连续传代后,仍维持在5%范围内的效价波动,稳定性高。可见诱变用的活性离子导致细胞DNA 损伤和破坏,在其自我修复的过程中形成了不完全修复的突变,获得稳定遗传的突变菌株。
