基于网络药理学探究防己茯苓汤治疗肾病综合征的成分与机制
2023-10-27杨长游汤婷婷刘秋美黄遵楠
杨长游,汤婷婷,刘秋美,黄遵楠
广东医科大学东莞市计算机辅助药物设计重点实验室,广东 东莞 523808
肾病综合征(nephrotic syndrome,NS)是指各种原因导致的、以大量蛋白尿(>3.5 g/d)和低蛋白血症(<30 g/L)为主要症状的一组临床症候群,常常伴有水肿和高脂血症。其流行病学显示全球18岁以下儿童NS 发病率为(2~7)×10-5,微小病变型肾病是儿童NS 的主要类型(77%~85%)[1]。相关研究表明NS 的发病机制尚未完全明确,可能与免疫功能紊乱或肾小球足细胞损伤有关[2]。目前针对NS,糖皮质激素(glucocorticoid,GC)和免疫抑制剂是西医用于治疗的主要药物,但长期使用会造成严重副作用,如感染、骨髓抑制、高脂血症等[3]。因此,研究和开发具有显著疗效并能够减轻激素副作用的药物具有重要的诊疗意义。
中医药在治疗NS 上具备独特的作用,复方药物遵循“君臣佐使”的经典配伍原则,能通过药物间协同效应来减轻激素副作用和减缓疾病高复发率[4]。防己茯苓汤(fangji fuling decoction,FJFL)来自中医古代药典《金匮要略》,由茯苓、防己、黄芪、桂枝、甘草五味草药加水煎煮而成,具有消除水肿,减轻蛋白尿的功效[5]。防己-茯苓是复方的核心组合,其成分具有利水消肿和改善肾脏病变的作用。 如Hattori 等[6]发现茯苓提取物pachyman 对大鼠原代抗肾小球基底膜的抗肾炎作用;Yu 等[7]发现防己成分中的粉防己碱能够通过阻断TRPC6 高表达减轻足细胞损伤。然而,尽管复方中相关成分具有一定的疗效已被证实,但临床上大多应用汤剂治疗NS,复方整体治疗NS的机制尚未明确。
网络药理学是研究中药治疗机制的新方法,它将经典的“单基因-单药物-单疾病”的研究模式转向为“多药物-多靶点-多通路”的新模式,其基于靶点网络的综合分析与中药配伍之间的协同作用和整体理念不谋而合[8]。本研究采用网络药理学与分子对接相结合的方法,通过对FJFL 的活性成分和作用靶点进行分析,探究其治疗NS 的物质基础和潜在药理机制,为临床治疗提供理论依据;此外,天然化合物药理网络的构建和共同靶点的确定对探索FJFL 的“异病同治”和“同病异治”提供一定参考。
1 实验部分
1.1 中药复方活性成分的获取
使用中药系统药理学数据库TSCMP(traditional Chinese medicine systems pharmacology database and analysis platform,https://old.tcmsp-e.com/tcmsp.php),根据口服生物利用度(oral bioavailability,OB)≥ 30% 且药物类药性(drug likeness,DL)≥0.18 为标准[9],筛选出防己茯苓汤(fangji fuling,FJFL)的相关活性成分。
1.2 复方靶标网络的构建
利用TCMSP 数据库中获取FJFL 的活性成分靶标,对于没有靶标的化合物,在PubChem 数据库下载其化合物2D 结构,于SwissADME(http://www.swissadme.ch/)进行药物代谢动力学分析,满足“Lipinski's Rule of Five”规则(分子量≤500;脂水分配系数≤5;氢键供体≤5;氢键受体≤10)后利用SwissTargetPrediction 分子预测平台(http://www.swisstargetprediction.ch/)进行靶点预测[10],随后使用Cytoscape(v3.7.2,https://cytoscape.org/)软件构建了FJFL 的“ 草药-活性化合物- 靶点”(herbs-compounds-targets,HCT)网络。
1.3 获取疾病相关靶标
使用DisGenet 数据库(https://www.disgenet.org/home/),以“Nephrotic Syndrome”为关键词收集NS 疾病靶点。另外,在基因表达综合数据库GEO(gene expression omnibus,https://www.ncbi.nlm.nih.gov/geo/)检索NS 基因表达数据,结果获得来自平台:GPL19983,系列:GSE108109,得到一个包含6 个健康人样本的正常组和一个包含90个多种病理类型样本的NS 组。选取该系列中正常组和NS 组之间肾小球mRNA 转录组差异表达的系列矩阵数据,利用GEO2R 分析差异基因,通过p< 0.05 且|log2 fold change(FC)|> 1 的标准筛选,获取NS 的差异表达芯片[11],再利用R 语言(v4.0.2,https://www.r-project.org/)进行可视化。最终将两个数据库中获得的靶点基因进行合并得到NS 靶点基因。
1.4 PPI作用分析与网络构建
将复方FJFL 预测靶点和NS 疾病靶点进行交联得到“FJFL-NS”的共同靶点,是FJFL 治疗NS 的潜在靶点。使用String 数据库(v11.0,https://string-db.org/)获得靶点蛋白质互作PPI(proteinprotein interaction)网络。将结果导入Cytoscape软件并使用其MCODE 插件对PPI 网络进行模块聚类分析,获取网络中最密集且具备潜在生物意义的蛋白质复合体,作为FJFL 治疗NS 的核心网络[12]。
1.5 KEGG(Kyoto encyclopedia of genes and genomes)和GO(gene ontology)分析
将核心网络靶点数据导入DAVID 数据库(v6.0,https://david.ncifcrf.gov/),进行GO 功能注释和KEGG 通路富集分析[13]。GO 分析通过生物过程(biological process,BP),细胞组分(cellular component,CC)和分子功能(molecular function,MF)3 个途径对核心靶点基因进行注释,了解基因富集的定位、途径和功能。KEGG 分析用来探究核心靶点富集的潜在生物学信号通路,进一步了解FJFL 的治疗机制。
1.6 分子对接
在“草药-活性化合物- 靶点”HCT 网络中,根据拓扑学参数Degree 值计算排名前五的核心化合物作为配体,分子配体结构来自PubChem 数据库,使用ChemDraw 3D 软件通过最小能量优化处理。将核心靶点网络中所有靶点作为对接受体,于RCSB PDB 数据库检索和下载关键靶蛋白的3D结构文件,并进行蛋白质脱水、加氢、去除残基等处理,再利用AutoDock Vina 软件进行分子对接[14]。最后,通过结合自由能大小来评价“配体-受体”的结合程度,相关研究表明受体与配体之间低于-5.00 kcal/mol 的结合自由能具有较好的相互作用[15],用Pymol(v2.5.0,https://pymol.org/2/)软件对最优的配体靶点对接姿势进行可视化。
1.7 基于网络的药物-药物关系邻近度测量
药物模块是药物发挥效应的基础,两种药物及其靶点之间基于网络的关系将有助于阐明有效药物组合的作用机制。选择基于人类PPI 网络的高质量药物组合测量基础上使用分离度量(separation measure)来测量5 个核心化合物目标模块的网络接近度[4,16]。
其中:dAA和dBB代表目标模块内的最短距离,dAB表示草药A 和草药B 目标对之间的最短距离,SAB表示草药A 和草药B 的网络邻近度。
2 结果与分析
2.1 成分与复方靶点网络
TCMSP 数据库中获取到116 个复方活性化合物,包含茯苓14 个、防己6 个、桂枝7 个、甘草74个、黄芪15 个,删除共同成分后,最终确定了106个活性化合物。对于复方化合物的预测靶标,删除重复后获得309 个。根据“草药-活性化合物-靶点”HCT 网络(图1),绝大部分化合物包含2 个或以上的靶点(平均个数为17.3,从1~151 不等),具有较高的靶点集中趋势,其中PTGS2 是Degree 值最高的靶点。根据拓扑学计算结果,排名前五的分别是槲皮素(quercetin)、山奈酚(kaempferol)、7-甲氧基-2- 甲基异黄酮(7-methoxy-2-methyl isoflavone)、芒柄花素(formononetin)、β-谷甾醇(beta-sitosterol)。图1 中GC 表示甘草,FL 代表茯苓,GZ 代表桂枝,HQ 代表黄芪,FJ 表示防己;菱形代表靶点,正方形代表草药,圆形代表化合物。
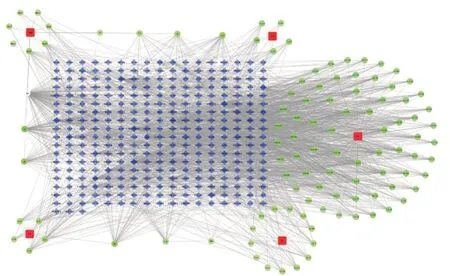
图1 草药-化合物-靶点网络Fig.1 Herbal-compound-target network
2.2 疾病的靶标与分析
通过GEO 数据库中基因芯片GSE108109,确定了与NS相关的1 494个差异表达基因[图2(a)]。此外,利用DisGenet 数据库得到384 个与NS 相关靶点,合并两个数据库分析给出的基因并消除重复后得到NS 的1 835 个靶点。最后,将FJFL 的药物靶点与NS 的309 个疾病靶点进行交联,得到72个共同靶点[图2(b)]。
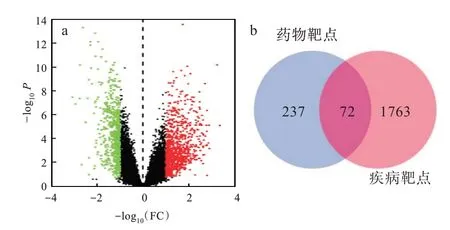
图2 NS 差异表达基因和潜在治疗靶点:(a)NS 疾病组差异表达基因图,(b)FJFL 与NS 靶点映射图Fig.2 Differentially expressed genes and potential therapeutic targets of NS:(a)differentially expressed genes in NS disease,(b)targets mapping of FJFL to NS
2.3 PPI网络分析
根据PPI 网络分析得到一个包含71 个节点的PPI 网络和一个游离网络外的靶点(GABRA2)。MCODE 插件对PPI 网络聚类分析后得到3 个重要模块:一个包含30 个节点,397 条线的网络,MCODE 得分为27.379;另外两个均是包含3 个节点,3 条线的网络,MCODE 得分均为3。最终选择得分最高的模块网络作为FJFL 治疗NS 的核心治疗网络(图3),30个靶点被认定为核心靶点(表1)。
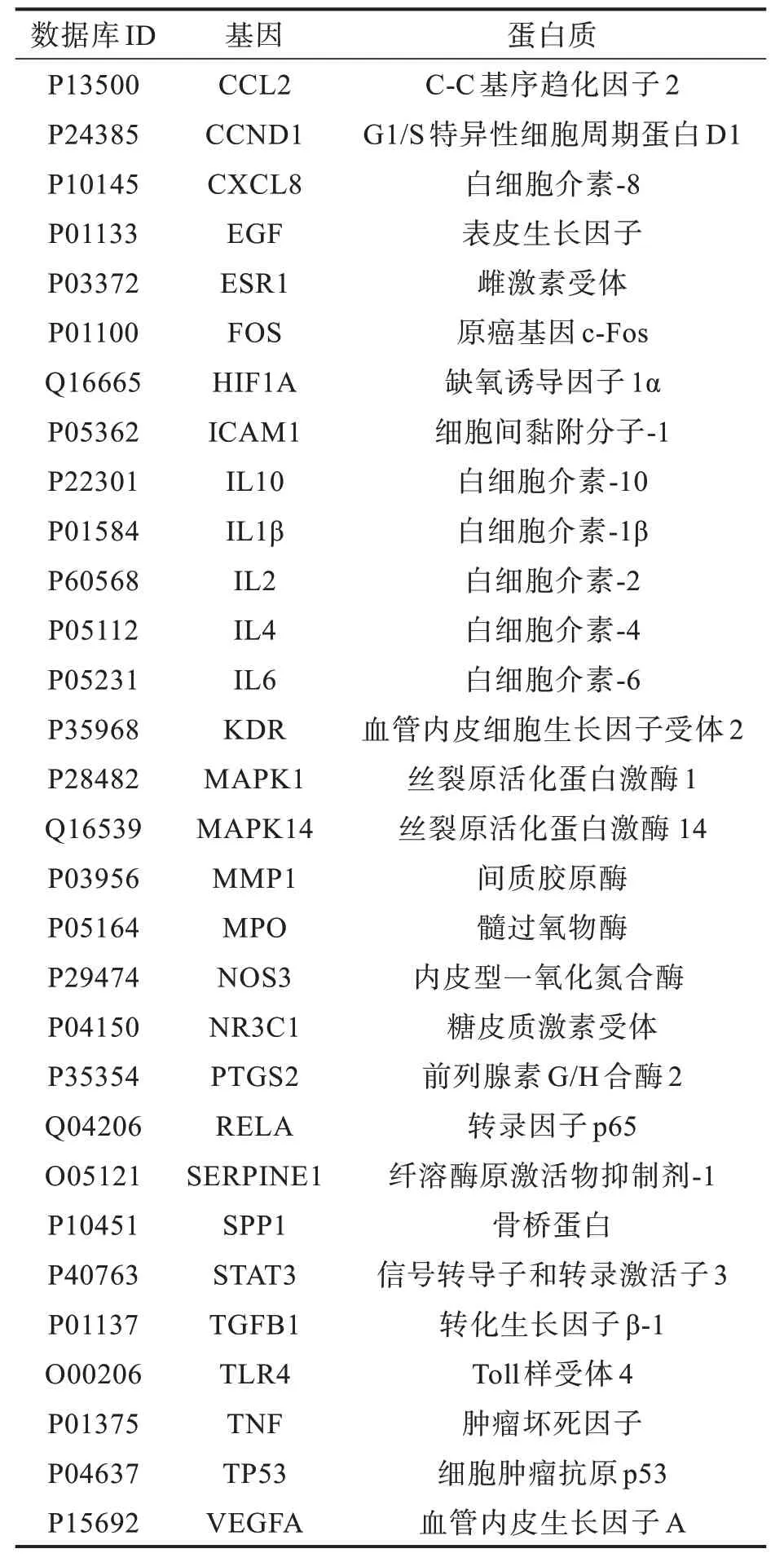
表1 核心靶点信息Tab.1 Core target information
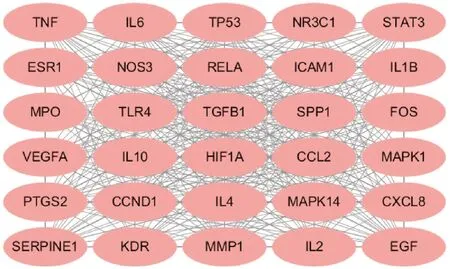
图3 FJFL 治疗NS 的模块分析结果图Fig.3 Result diagram of module analysis of FJFL for treatment of NS
2.4 GO 功能分析和KEGG 通路分析
GO 富集分析确定了核心目标涉及生物过程215 个,细胞组分14 个,分子功能28 个(p<0.05)。结果显示:生物过程富集于RNA 聚合酶II 启动子转录的正调控、血管生成、炎症反应等;细胞组分包括细胞外间隙、细胞质、细胞膜等;分子功能涉及细胞因子活性、生长因子活性等。将GO 分析生物过程前15 个分析结果进行可视化(图4)。KEGG 富集分析确认30 个核心靶点参与84 条信号通路(false discovery rate,FDR<0.05),将前20条信号通路可视化(图5)。根据查阅与NS 相关研究,最终得到与NS 高度相关的21 条通路,主要是VEGF 信号通路、NF-κB 信号通路和HIF-1 信号通路等,涉及缺氧、细胞凋亡、炎症因子等多种生理模块,对结果构建“核心化合物-核心目标-信号通路”网络图(图6)。值得一提的是,靶点NR3C1 游离该网络之外。
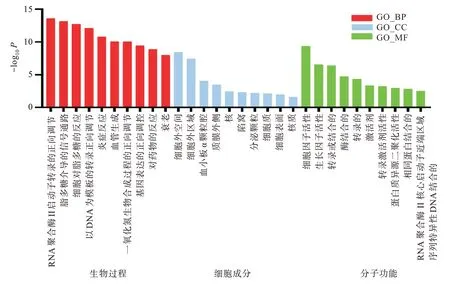
图4 FJFL 治疗NS 的GO 分析图Fig.4 Gene Ontology analysis of FJFL
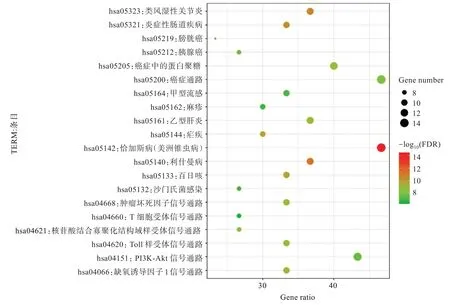
图5 FJFL 治疗NS 的KEGG 通路分析图Fig.5 Diagram of KEGG pathway analysis of FJFL
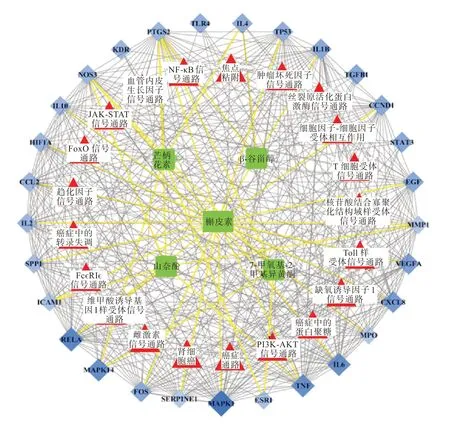
图6 核心化合物-核心靶点-信号通路图Fig.6 Diagram of core compounds-targets-signaling pathway
2.5 分子对接
分子对接结果表明5 个核心化合物与核心网络靶点都具有很好的结合活性(见表2),各化合物最优对接结果分别为NOS3_quercetin,其结合能为-9.6 kcal/mol;7-Methoxy-2-methyl isoflavone_PTGS2,其 结 合 能 为 -8.4 kcal/mol;Beta-Sitosterol_MAPK1,其结合能为-9.1 kcal/mol;formononetin_PTGS2,其结合能为-9.5 kcal/mol。另外化合物kaempferol的最优对接结果有两个,分别是Kaempferol_PTGS2 和Kaempferol_NOS3,其结合能均为-9.4 kcal/mol。这6 个配体和靶点的对接姿势请见图7。
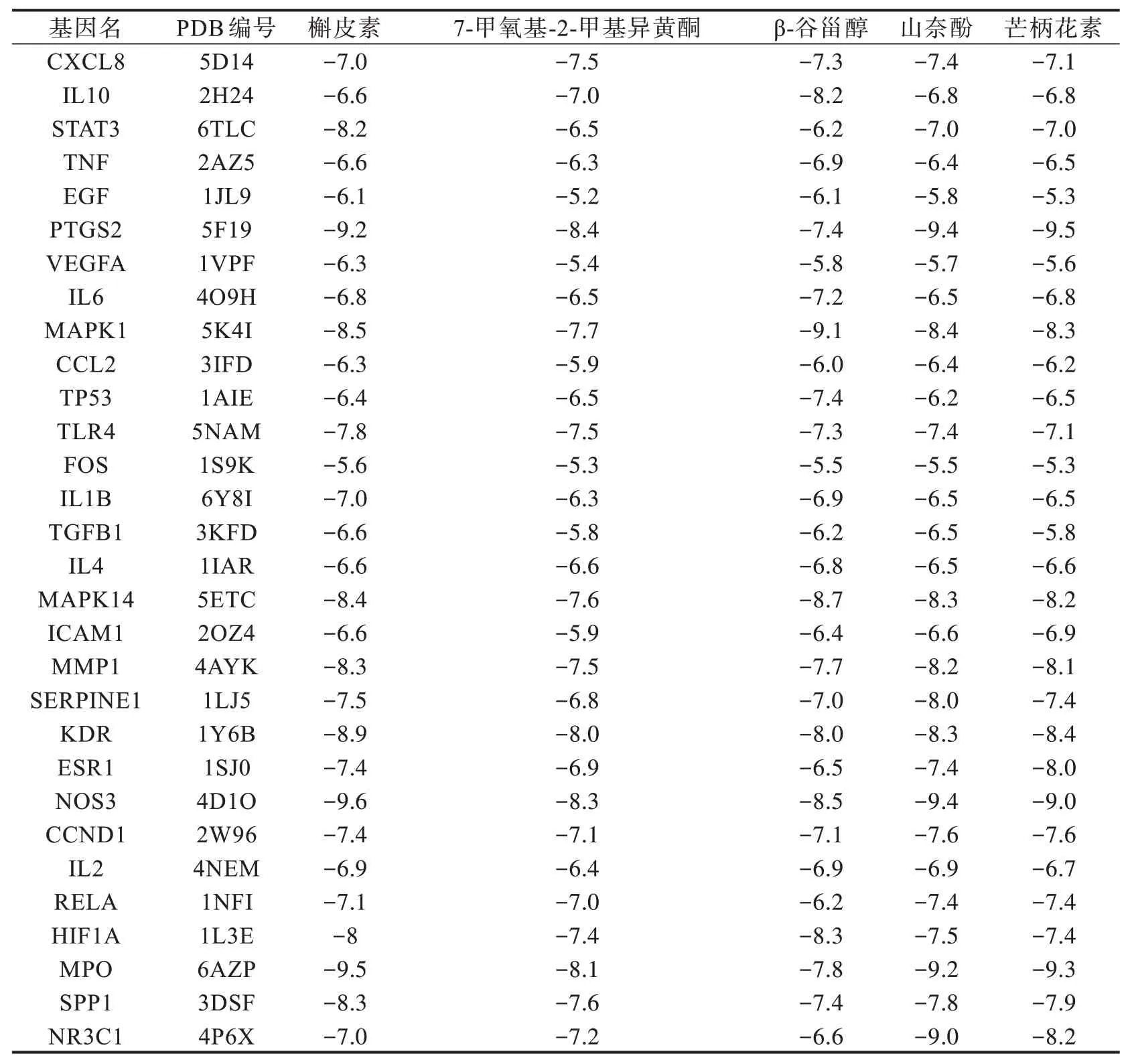
表2 FJFL 治疗NS 的核心成分与关键靶点分子对接结果表Tab.2 Molecular docking results of core compounds and key targets of FJFL in treatment of NS kcal/mol

图7 5 个核心化合物最优对接姿势图:(a)槲皮素和NOS3 蛋白,(b)山奈酚和PTGS2 蛋白,(c)山奈酚_NOS3,(d)7-甲氧基-2-甲基异黄酮和PTGS2 蛋白,(e)芒柄花素和PTGS2 蛋白,(f)β-谷甾醇和MAPK1 蛋白Fig.7 Best docking pose diagrams of five core compounds:(a)quercetin_NOS3,(b)Kaempferol_PTGS2,(c)kaempferol_NOS3,(d)7-methoxy-2-methyl isoflavone_PTGS2,(e)formononetin_PTGS2,(f)Beta-Sitosterol_MAPK1
2.6 基于网络的邻近度测量
在经实验验证的药物-靶点相互作用的公开数据中包含核心化合物中的quercetin(DrugBank_ID:DB04216)和 kaempferol(DrugBank_ID:DB01852),其分别有58 和19 个潜在靶标,它们间共同靶标达13 个。选定以quercetin-kaempferol为例,探究两种核心化合物之间是否具备这种分子相关性。经过计算得到quercetin-kaempferol 的S(AB)为-0.054,这表明它们在人类PPI 网络中的网络邻近度较高(图8)。
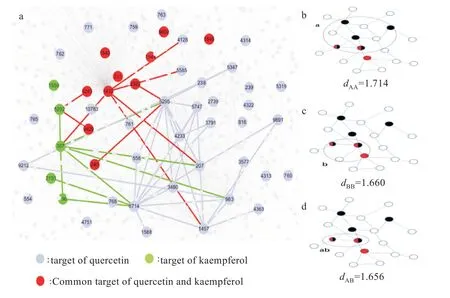
图8 基于网络的邻近度测量图:(a)槲皮素和山奈酚靶点网络,(b)槲皮素中靶点最短距离,(c)山奈酚中靶点最短距离,(d)槲皮素与山奈酚最小网络邻近度Fig.8 Network based proximity measure plots:(a)target network of quercetin and kaempferol,(b)minimum distance between targets in quercetin,(c)minimum distance between targets in kaempferol,(d)minimum network proximity between quercetin and kaempferol
3 讨 论
NS 是美国终末期肾病的主要病因之一,大多数NS 患者疾病后期会出现对皮质类固醇耐药,继而导致疾病反复发作,极大程度上地降低了患者生活质量并增加了肾脏疾病进展恶化的风险[17]。FJFL 在NS 治疗中可显著改善NS 患者的临床症状,促使肾功能恢复。相关实验表明,防己茯苓汤能显著降低ANP、β2-微球蛋白、Cys C 水平来保护病损肾脏[18]。然而,FJFL 治疗NS 的具体机制仍待明确。本研究采用网络药理学和分子对接方法探究“复方-靶点-疾病”之间的关系,揭示FJFL 对NS 的潜在治疗机理。
药物与疾病之间的共同靶点是联系两者的关键桥梁,多靶点药物联合治疗成为新的趋势。本研究结果显示HCT 网络有超过87 个化合物的靶点集中于PTGS2、ESR1、MAPK14,且同时包含三者的化合物达33 个,而PPI 网络分析结果表明PTGS2、ESR1、MAPK14 同样隶属于核心靶点网络。环氧合酶2(PTGS2/COX-2)在肾脏生理学中起重要作用,COX-2 的过表达易导致肾小球足细胞损伤,而COX-2 抑制剂可以减少肾病实验模型中的蛋白尿[19]。ESR1 是雌激素受体,雌激素与其受体ESR1 结合能抑制小鼠肾足细胞PTPRO 表达,使JAK/STAT 信号通路失活,而促进肾小球足细胞增殖达到减轻NS 的效果,针对雌激素信号通路来预防NS 已成为一个新的热点[20]。MAPK14和MAPK1 同属于丝氨酸-苏氨酸蛋白激酶家族,能通过激活炎症通路等途径引起蛋白尿,p38 MAPK 抑制剂在体外和体内实验对减少足细胞损伤和蛋白尿中发挥重要作用[21-22]。进一步对靶点进行KEGG 富集分析,结果表明FJFL 治疗NS 的机制可能与VEGF 、NF-κB 和HIF-1 信号通路有关。 其中血管内皮因子(vascular endothelial growth factor ,VEGF)与NS 密切相关,足细胞中VEGF164的过表达诱导nephrin 和MMP9 下调将导致小鼠出现蛋白尿和肾小球损伤[23]。炎症因子的激活会加重NS 的肾损伤,NF-κB 在NS 幼鼠体内的高表达促进了炎症因子IL-1、IL-6 等增加,加重肾损伤,而抑制NF-κB 表达可以减轻蛋白尿和肾损伤[24-25]。 缺氧诱导因子(hypoxia-inducible factor ,HIF)主要存在于足细胞和内皮细胞中,抑制HIF-1 信号通路而导致HIF 的降解对肾脏具有保护作用[26]。综上,FJFL 极大可能通过效应关键靶点或激活靶点富集的信号通路等方式发挥治疗作用。
靶点NR3C1 是30 个关键靶点中唯一一个游离在“核心化合物-核心靶点-信号通路”之外(表2,图6),但不表明其不重要。NR3C1 是表达糖皮质激素受体(glucocorticoid receptor,GR)的基因原件,属于核受体家族。糖皮质激素(glucocorticoid,GC)是临床上治疗NS 的最主要药物,一方面,GC与GR 结合选择性启动GC 依赖性基因网络来发挥效应;但另一方面,GC 也能通过结合GR 片段GRα引起反式激活并以此介导副作用发生,如骨质疏松症等[27]。因此不能忽略NR3C1 是复方发挥效应的重要机制。同时,天然化合物存在通过影响GR 的表达来达到减弱GC 介导的不良反应的作用;与人工合成化合物相比,天然植物化合物具备很少的副作用,更有可能通过反式阻遏的方式在发挥抗炎的同时减弱GC 的副作用,是选择性GR调节剂的更好替代物[28-29]。更重要的是,中药是靶向GR 天然化合物的重要来源,许多文献中表明中药对GC 介导的受体下调具有改善调节作用,如Ling 等[30]发现人参皂甙可逆转地塞米松诱导的GR 下调,Sun 等[31]发现淫羊藿苷能通过促进GRα核转位和上调GRα 表达抑制LPS 诱导的细胞炎症反应,Liu 等[32]发现黄芪甲苷IV 在体内和体外都被证实能直接与GR 结合,并积极激活GR 介导的信号通路。因此,本研究进一步利用核心化合物和阳性治疗药物(皮质醇,cortisol)与GR 分子对接来对比分析核心化合物是否能通过与GR 有效结合进而发挥效应。PDB ID_ 4P6X 是PDB 数据库中Cortisol 与GR 的结合复合物的晶体结构,描述了GC 与GR 结合的对接姿势[33]。Cortisol 与GR上氨基酸位GLN-570、THR-739、GLN-642、ASN-564、ARG-611 产生氢键作用[图9(a)]。在“Cortisol_GR”的活性结合口袋里,核心化合物中的kaempferol能够与GR 较好的结合,且结合能达-9.0 kcal/mol,其局部相互作用力发现,kaempferol能够与GR 上氨基酸位GLN-570、THR-739、MET-604 产生氢键作用[图9(b)]。因此,Cortisol 和kaempferol 共享了与GLN-570 和THR-739 氨基酸位点的氢键结合。上述研究结果表明kaempferol能够与GR 较好的结合,有潜力成为GR 的天然调节剂,但其是否在复方中通过减弱GC 介导的不良反应或上调GR 受体活性的机制产生的治疗效果还有待进一步验证。
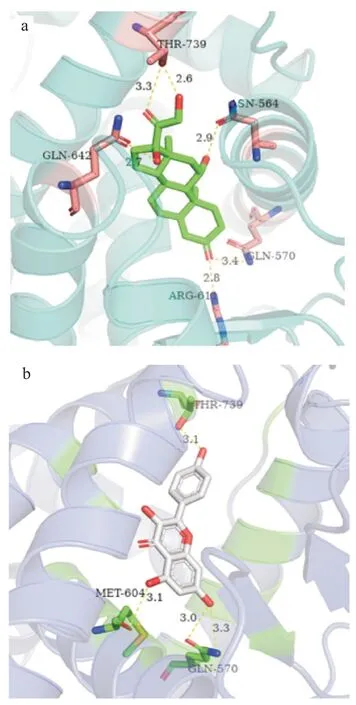
图9 分子对接局部作用图:(a)皮质醇和糖皮质激素受体,(b)山奈酚和糖皮质激素受体Fig.9 Molecular docking local interaction maps:(a)Cortisol_GR,(b)Kaempferol_GR
Quercetin、Kaempferol、7-Methoxy-2-methyl isoflavone、Formononetin、Beta-sitosterol 是FJFL 起关键疗效的核心化合物。不过临床上并未使用单一化合物治疗NS,复方的整体应用是发挥药物间协同效应的关键。两个药物-靶标模块之间的网络邻近度(SAB)能够充分反映两者的生物学和药理学关系,明显优于传统的化学信息学和生物信息学方法。在基于人类PPI 互作内SAB提供了可靠的药物-药物关系(图8),当S(AB)< 0 时,两种药物的靶点位于同一个网络邻域内,它们具备疗效相似性;而对于S(AB)≥0,两个药物靶点在网络拓扑上是分开的[4,16]。 本研究中Quercetin-Kaempferol 的计算结果为-0.054,这有效地说明了Quercetin 和Kaempferol 之间药物-靶标模块的效应重叠,表明它们很可能在化学特性、生物学功能和临床特征方面具有相关性。除此之外,相关研究表明槲皮素和山柰酚是黄酮醇类物质的重要代表,在人癌细胞系中具备协同抗增殖作用[34],这一研究与我们网络药理学分析认为两者之间具备协同作用的结果相符。因此,虽然在临床实验和FDA 批准药物中并未证明两者可以作为药物对使用,但基于这种分析模式认为在分子网络上被证明是可行的,它们之间具备生物学和药理学相似性。
4 结 论
本研究通过网络药理学初步探究FJFL 治疗NS 的作用机制。通过确立了复方中quercetin,kaempferol,7-Methoxy-2-methyl isoflavone,formononetin,beta-sitosterol 等5 种成分为治疗的核心化合物;通过PPI 网络分析发现PTGS2、ESR1、MAPK14 等30 个靶点组成的核心治疗网络最有可能是治疗NS 的机制网络,主要涉及VEGF、NF-κB和HIF-1 等多条信号通路。分子对接显示核心化合物和核心靶点具备很好的结合活性;通过对比Cortisol_GR 和Kaempferol_GR 的分子对接结果表明Kaempferol 与GR 受体结合域能良好结合,有潜力成为天然调节剂。对核心化合物Quercetin 和Kaempferol 进一步基于网络的测量表明在化学特性、生物学功能和临床特征方面具有很高的相关性,有成为药物对使用的潜力。本研究为进一步探究FJFL 作用于肾病综合征的潜在药理机制提供了新思路,可供临床应用提供参考,不过,但具体结论仍需要后续相关实验进行证明。
