miR-29c-3p/IGF1 分子轴对肝星状细胞活化,增殖和凋亡的作用机制
2023-10-27王保全雷喜锋
张 梁 ,王保全 ,雷喜锋 ,王 旭 ,柯 阳 ,张 玮
(1)渭南市中心医院普外科,陕西 渭南 714000;2)昆明医科大学第二附属医院肝胆胰外科,云南 昆明 650101)
过量饮酒会促进酒精性肝病(alcoholic liver disease,ALD),如脂肪变性、脂肪性肝炎、纤维化到肝硬化,最终导致肝细胞癌,这是所有慢性肝病的主要死亡原因[1-2]。在ALD 的发展进程中,肝星状细胞(hepatic stellate cells,HSCs)扮演者重要的角色。HSCs 是慢性肝损伤创面愈合相关纤维化过程的主要参与者之一[3-4]。在健康器官中,它们是非实质细胞群的一部分,占据肝细胞和窦状内皮细胞之间的间隙[5]。在组织损伤、炎症和伴随的可溶性介质(例如TGF-β)激活后,HSCs转分化为肌成纤维细胞样细胞,表现出增殖、收缩和成纤维特性,成为纤维化肝脏中纤维性胶原的主要来源[4,6]。HSCs 还参与邻近细胞的复杂交互,以促进肝纤维化进展。因此,阐明HSCs的分子调控机制对ALD 的治疗具有重要的意义。
微小RNA(microRNAs,miRNAs)是一种由18~24 个核苷酸的组成的非编码RNA,通常情况下,miRNA 在细胞质RNA 诱导沉默复合体中与靶mRNA 的3'-UTR 相互作用以抑制mRNA 翻译和诱导降解它[7-8]。具体来说,一些miRNA,如miR-122 和miR-21 已被证明在ALD 的肝纤维化的发展中发挥作用,调节包括组织炎症、细胞凋亡和HSCs 的激活等过程[9-10]。此外,由于miRNA 释放到血液中的疾病依赖性以及它们在血清中的相对稳定性,miRNA 是检测ALD 严重程度和致癌性的潜在非侵袭性生物标志物[11]。近期,Zhang 等[12]通过生物信息学分析发现,miR-29c-3p 在ALD 模型小鼠肝脏的表达水平显著低于正常小鼠,且预测其为ALD 治疗的潜在靶标。然而,目前还没有文献报道,miR-29c-3p 对ALD 中HSCs 活化,增殖和凋亡的调控机制。
综上所述,本研究拟探讨miR-29c-3p 在静息和活化HSCs 中的表达差异,并且检测其对HSCs 活化,增殖和凋亡的影响,此外,笔者还拟通过生物信息学方法预测miR-29c-3p 的下游靶标,并验证miR-29c-3p 是否通过该靶标参与HSCs 生物学行为的调控。
1 材料与方法
1.1 小鼠HSCs 的原代培养和鉴定
从C57BL/6 J 小鼠(24.0~26.0 g,8~10 周龄)中分离HSCs。简而言之,C57BL/6 J 小鼠原位灌注四乙酸和胶原酶获得全肝细胞悬液,用Percoll密度梯度离心法获得HSCs。将细胞调整到3×106细胞/mL,接种在25 cm2的培养瓶中,其中含有包含10%胎牛血清的5mL DMEM 完全培养基和1%青霉素/链霉素。采用TGF-β 活化HSCs后,采用免疫荧光检测HSCs 活化标志物ɑ-SMA的表达。简而言之,HSCs 与一抗抗ɑ-SMA(1∶250)在4℃下孵育过夜,随后用二抗染色。在400 倍放大的荧光显微镜下测量细胞ɑ-SMA荧光阳性表达的变化并收集图像。
1.2 细胞分组及转染
首先,为观察miR-29c-3p 对HSCs 的影响,将细胞分为NC 组(未转染)、NCmimic 组(转染miRNAmimic 阴性对照)和miR-29c-3pmimic 组(转染miR-29c-3pmimic)。为进一步观察miR-494-3p 和IGF-1 对HSCs 的影响,将细胞分为NC 组(未转染)、sh-NC 组(转染sh-NC 阴性对照)、sh-IGF-1 组(转染sh-IGF-1)和sh-IGF-1+miR-29c-3pinhibitor 组(同时转染sh-IGF-1 和miR-29c-3pinhibitor)。miR-29c-3pmimic/inhibitor和sh-IGF-1,及它们对应的阴性对照购买于广州锐博生物技术有限公司。将HSCs 接种于6 孔板(5×104细胞/mL),按照说明书使用Lipofectamine 2000 试剂及分组信息,进行50 nM miR-29c-3p mimic/inhibitor/NCmimic/sh-IGF-1/sh-NC 的转染。转染48 h 后,采用RT-qPCR 和WB 检测转染效率。
1.3 实时荧光定量聚合酶链反应(real-time quantitative polymerasechain reaction,RTqPCR)
使用TRIzol Regent 按照说明书提取HSCs 的总RNA 样本,然后用TurboDNase 试剂盒去除DNA。用NanoDrop 对提取的总RNA 进行定量。用带用gDNA Eraser 的PrimeScriptTM RT 试剂盒逆转录将2 µg 总RNA 逆转录为cDNA。采用SYBR Green PCR Master Mix 在Bio-Rad Real-Time PCR 仪上进行qPCR 检测miR-29c-3p 的表达。采用U6 作为内部参考。每个数据重复3 次,用2-ΔΔCt 法计算miR-29c-3p 的相对表达水平。本研究使用的引物如下:miR-29c-3p sense:5’-GCTGACCGATTTCTCCTGGT-3’ ;miR-29c-3p antisense:5’-TCCCCCTACATCATAACCGA-3’;U6 sense:5’-CTAGATAATGGTGCTGATAGATGGA-3’;U6 antisense:5’-GGCACACCAGAAATCGAAGC-3’。
1.4 免疫印迹实验(western blot,WB)
使用RIPA 裂解缓冲液从HSCs 中提取总蛋白,使用BCA 蛋白测定试剂盒测定蛋白浓度。通过聚丙烯酰胺凝胶电泳,将60 µg 总蛋白质样本进行分离后,转移到硝化纤维素膜上。用5%脱脂牛奶进行阻断,在4℃下用小鼠单克隆抗ɑ-SMA(1∶1 000),DDR2(1∶2 000),FN1(1∶1 000),ITGB1(1∶2 000)和GFAP(1∶1 000)孵育过夜。用TBST 清洗膜,然后与适当的辣根过氧化物酶结合的二抗孵育。采用增强型化学发光试剂进行膜的显影,并使用Image Lab™软件捕获信号并定量条带灰度值。
1.5 双荧光素酶报告基因实验
采用Starbase 数据库预测IGF-1 和miR-29c-3p 的3’ UTR 结合序列。用PCR 分别扩增野生型和突变型IGF-1 与miR-29c-3p 的3’ UTR 结合序列,将片段装入pMIR-REPORT luciferase microRNA expression reporter vector。参照Lipofectamine 2000试剂盒说明书,将0.1 µg 野生型和突变型的IGF-1 荧光素酶报告载体分别共转染到带有miR-29c-3pmimic 的HEK-293 细胞中。转染48 h 时后,收集细胞裂解液,根据制造商的说明书,使用双荧光素酶报告基因检测试剂盒测量各组的荧光素酶活性。
1.6 CCK-8 实验
采用CCK-8 试剂盒检测HSCs 的细胞活力。简而言之,将5×104细胞/mL 的各组HSCs 加入96 孔板中孵育24 h。各组HSCs 转染24、48 和72 h 后,分别在各孔加入CCK8 溶液。2 h 后,使用酶标仪测量450 nm 处的吸光度。
1.7 克隆形成实验
各组HSCs(5×102细胞/mL)接种到含有37℃预热培养基的6 孔板中,置于37℃培养箱中培养。每2 d 更换一次培养基,放置14 d。随后,各组HSCs 用1∶3 乙酸/甲醇固定30 min,用Giemsa染色20 min,肉眼计数细胞克隆数。
1.8 流式细胞术
采用Annexin V-FITC/PI 试剂盒检测HSCs 凋亡情况。取1×Annexin V 结合液500 µL 制备终浓度为1×106细胞/mL 的HSC 悬液,加入6 孔板上。在细胞悬液中加入5 µL Annexin V-FITC 和5 µL 丙二碘,室温暗培养15 min。流式细胞术检测细胞凋亡情况。坏死细胞位于左上区(AnnexinV-,PI+),晚期凋亡细胞位于右上区(AnnexinV+,PI+),活细胞位于左下区(AnnexinV-,PI-),早期凋亡细胞位于右上区(AnnexinV+,PI-)。
1.9 统计学处理
所有数据重复3 次独立实验,数据以均数±标准差表示,并通过SPSS 22.0 软件进行统计分析。根据数据组成,2 组间比较使用student’st检验,多组间比较采用单因素方差分析(两两比较采用LSD 法),P< 0.05 为有统计学意义。
2 结果
2.1 HSCs 的分离及miR-29c-3p 表达差异
如图1A 所示,ɑ-SMA 阳性表达表明成功从小鼠中分离出HSCs。TGF-β 处理细胞后,HSCs 活化相关蛋白ɑ-SMA,DDR2,FN1 和ITGB1 表达水平明显增加,而GFAP 的表达水平则反之(P< 0.01,图1B)。值得注意地,miR-29c-3p 在激活的HSCs 中呈现低表达(P< 0.01,图1C)。以上结果表明,HSCs 被成功分离并激活,且miR-29c-3p 在不同状态的HSCs 中异常表达。

图1 成功分离HSCs,并且miR-29c-3p 在不同状态的HSCs 中差异表达Fig.1 Successful isolation of HSCs and differential expression of miR-29c-3p in HSCs of different status.
2.2 miR-29c-3p 对HSCs 活化,增殖和凋亡的影响
由于miR-29c-3p 在HSCs 中的异常状态,进一步探讨了miR-29c-3p 对HSCs 活化,增殖和凋亡的影响。首先,通过miRNAmimic 外源性的调控了活化的HSCs 中miR-29c-3p 的表达。转染效率结果表明,miR-29c-3p mimic 可以增加活化的HSCs 中miR-29c-3p 的表达水平(P< 0.001,图2A)。WB 结果表明,过表达miR-29c-3p 能够减低活化相关蛋白ɑ-SMA,DDR2,FN1 和ITGB1 表达水平,并增加GFAP 的表达(P< 0.01,图2B)。相较于NCmimic 组,miR-29c-3pmimic组中活化HSCs 的增殖活力(P< 0.01,图2C)和克隆形成数(P< 0.01,图2D)均有降低,并且凋亡比例增加(P< 0.01,图2E)。以上结果表明,miR-29c-3p 能够抑制HSCs 的活化和增殖,并促进其凋亡。

图2 miR-29c-3p 抑制HSCs 的活化和增殖,并促进其凋亡Fig.2 miR-29c-3p inhibits the activation and proliferation of HSCs and promotes their apoptosis.
2.3 miR-29c-3p 下游靶标预测及验证
调控下游mRNA 的表达是miRNA 在生物学进程中的主要功能之一。因此,笔者通过Starbase 数据库预测了miR-29c-3p 的下游可能靶标。如图3A 所示,IGF-1 可能是miR-29c-3p 的下游靶标,并且通过双荧光素酶报告基因检测发现,miR-29c-3p mimic 能够抑制细胞内野生型IGF-1 的荧光素酶活性(P< 0.01),但是对突变型IGF-1 的荧光素酶活性无影响(P> 0.01)。进一步,通过WB 检测了miR-29c-3p 对活化HSCs 中IGF-1 表达的影响。结果显示,过表达miR-29c-3p 可抑制IGF-1 的表达(P< 0.01,图3B),低表达miR-29c-3p 能促进活化HSCs 中IGF-1 表达(P<0.01,图3B)。以上结果表明,在HSCs 中,IGF-1 是miR-29c-3p 的下游靶标。
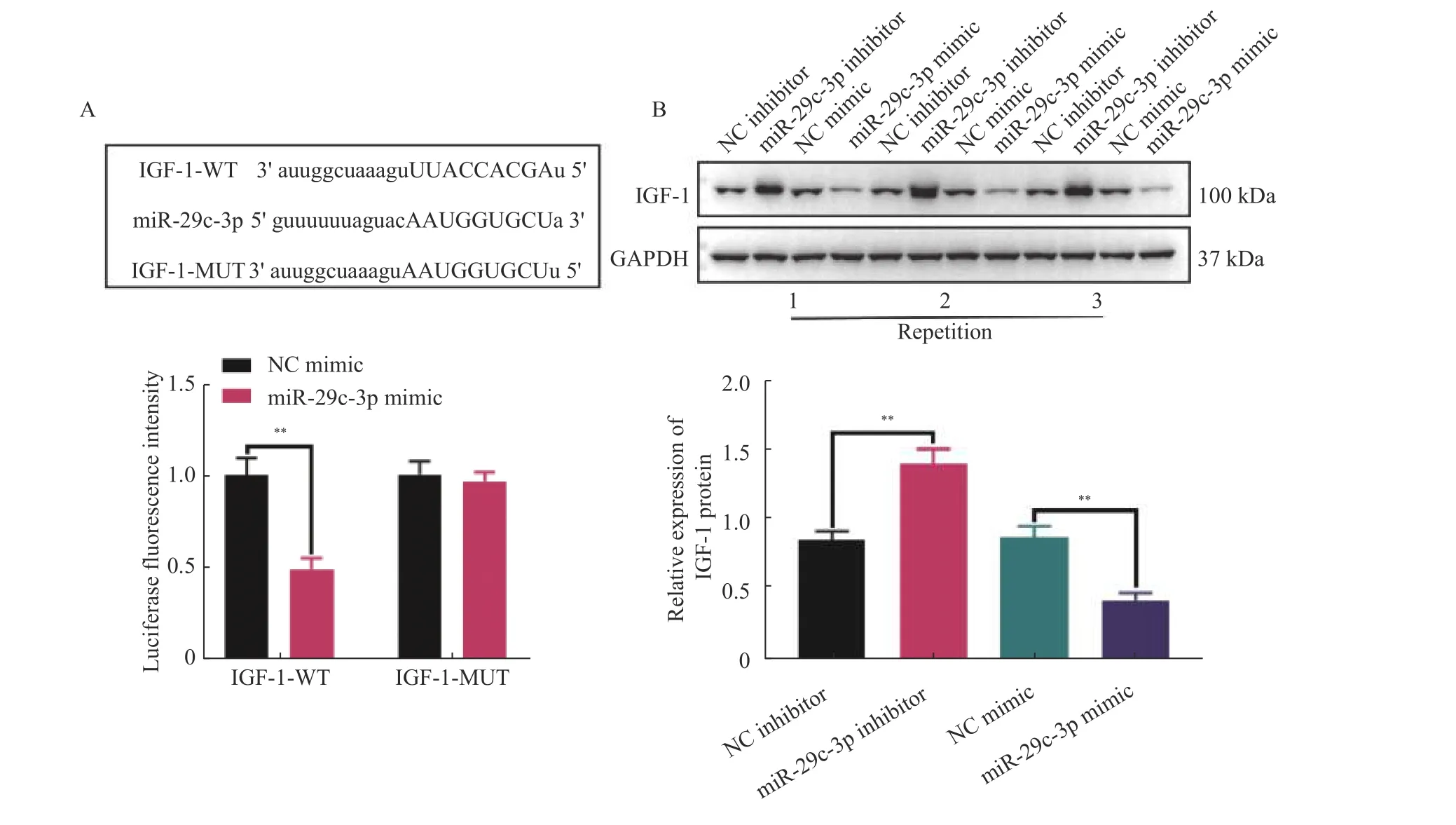
图3 IGF-1 是miR-29c-3p 下游靶标mRNAFig.3 IGF-1 is a downstream target mRNA of miR-29c-3p.
2.4 miR-29c-3p 通过IGF1 对HSCs 活化,增殖和凋亡的影响
进一步探讨了miR-29c-3p 是否是通过IGF1对HSCs 活化,增殖和凋亡产生影响的。结果表明,活化的HSCs 中转染miR-29c-3pinhibitor 或sh-IGF-1 能够降低miR-29c-3p 或IGF-1 的表达水平(P< 0.05,图4A、图4B)。回复实验表明,相较于sh-NC 组,sh-IGF-1 组中活化相关蛋白ɑ-SMA,DDR2,FN1 和ITGB1 表达水平降低,并且GFAP 的表达增加(P< 0.05,图4C);相较于sh-IGF-1 组,sh-IGF-1+miR-29c-3pinhibitor组中活化相关蛋白ɑ-SMA,DDR2,FN1 和ITGB1表达水平增加,并且GFAP 的表达减少(P< 0.05,图4C)。此外,敲低IGF-1 的表达能够降低活化HSCs 的增殖活力(P< 0.01,图4D)和克隆形成数(P< 0.01,图4E),并且增加其凋亡水平(P<0.001,图4F),但是在此基础上同时敲低miR-29c-3p 的表达则会逆转这一过程。以上结果表明,IGF-1 能够促进HSCs 的活化和增殖,并抑制其凋亡,这一功能被miR-29c-3p 靶向抑制。

图4 miR-29c-3p 通过IGF-1 抑制HSCs 的活化和增殖,并促进其凋亡Fig.4 miR-29c-3p inhibits the activation and proliferation of HSCs and promotes their apoptosis through IGF-1.
3 讨论
非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)及其晚期形式-非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)已成为一种代谢性流行病[2]。此前的生物信息学分析表明,miR-29c-3p 在ALD 患者血液中的表达水平显著低于正常人群[12],但是其功能还没有在ALD 中得到验证。在本研究中,笔者成功分离了小鼠中的HSCs,并且发现激活的HSCs 中miR-29c-3p 异常低表达。此外,笔者还发现,过表达miR-29c-3p 能够抑制HSCs 的激活和增殖,并促进其凋亡。值得注意地,miR-29c-3p 的这一功能是通过靶向调控IGF-1 的表达实现的。这些结果证实了Yao 等[12]的预测,并为miR-29c-3p作为ALD 的治疗靶标提供了理论基础。
HSCs 活化是ALD 进程中肝纤维化的关键事件,也是肝脏细胞外基质的主要来源之一,它们已被确定为主要负责肝脏纤维化发展的前体细胞类型[13]。肝损伤后,HSC 经历活化,导致典型的星形,脂肪储存表型的丧失和肌成纤维母细胞样表型的获得[13-14]。因此,为了缓解ALD 的发展进程,如何抑制HSCs 的活化成为了主要目标之一。研究表明,ɑ-SMA,DDR2,FN1,ITGB1和GFAP 已成为研究做多的HSCs 活化标志物[15-16]。在笔者的研究中发现miR-29c-3pmimic 可以抑制ɑ-SMA,DDR2,FN1 和ITGB1,并促进HSCs中GFAP 的表达。这表明,过表达miR-29c-3p可以抑制HSCs 的活化,这对缓解ALD 的肝纤维化至关重要。此外,介导HSCs 增殖和凋亡对明晰ALD 的机制也是十分重要的。例如,Liang 等[17]表明,嘌呤信号通路调节HSCs 激活和增殖,这在ALD 中起着关键作用。研究表明,miRNA-150-5p 抑制HSCs 增殖,并在肝纤维化期间使HSCs凋亡敏感,这有利于缓解ALD 的肝纤维化进程[18]。本研究表明:miR-29c-3p 的过表达对HSCs 的增殖是有抑制作用的,并且促进HSCs 的凋亡。此外,Chen 等[19]表明,miR-29c-3p 通过激活ADH6 增强子促进酒精脱氢酶(alcohol dehydrogenase,ADHs)基因簇表达,而ADHs 在酒精代谢和酒精毒性中起着至关重要的作用,这或许是miR-29c-3p 调控HSCs 参与ALD 的机制之一。
众所周知,miRNAs 通过介导下游靶标mRNA 的表达是参与调控多种生物学进程的主要途径之一[20-21]。在本研究中,通过Starbase 数据库预测发现IGF-1 是miR-29c-3p 的下游靶标之一,并通过双荧光素酶报告基因实验进行了验证。IGF-1 是一种70-氨基酸合成代谢激素,具有多种内分泌,旁分泌和自分泌作用[22]。胰岛素样生长因子-1(Insulin-like growth factor-1,IGF-1)和IGF 结合蛋白(IGF-binding proteins,IGFBPs)在包括肝脏在内的多种组织中产生,主要是对生长激素(growth hormone,GH)信号的反应。肝脏合成的IGF-1 和 IGFBPs 占全身循环 IGF-1 和 IGFBPs 的大部分[23]。众所周知,IGF-1 主要由肝脏产生(占循环IGF-1 的75%),但几乎每个组织都能够分泌IGF-1 用于自分泌/旁分泌的目的[22-23]。此前的研究表明,IGF-1 是非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)/非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)治疗的生物学靶标,IGF-I 可以调控细胞衰老和激活,从而介导NASH 中的肝纤维化[24-26]。IGF-I 治疗已被证明可以改善NASH 和肝硬化的动物模型[27-28],表明IGF-I 在这些条件下的潜在临床应用。在ALD 中,有研究表明,S-烯丙基巯半胱氨酸通过直接调节IGF-I 信号通路来改善ALD[29]。Mølle 等[30]表明,IGF-I 是ALD 患者的生存独立预测因子。本研究中,HSCs 中转染sh-IGF-1 能够降低细胞活化和增殖,并上调其凋亡比例。但是,这一过程受miR-29c-3p 的调控。
综上所述,笔者证明了miR-29c-3p 能够通过靶向下调IGF-1 的表达水平,进而抑制HSCs活化和增殖,并促进其凋亡。本研究为AH 提供了新的治疗策略。但是,本研究仅仅只在HSCs验证了miR-29c-3p 的功能,体内实验验证miR-29c-3p 在ALD 中的功能仍需进一步的挖掘。
