浙江省猪圆环病毒2型流行株遗传变异分析
2023-10-26安慧婷王雅婷张红丽董建斐孙仁杰赵灵燕谢荣辉
张 璐,安慧婷,王雅婷,黄 靖,张红丽,董建斐,孙仁杰,刘 霞,赵灵燕,徐 辉,谢荣辉
(浙江省动物疫病预防控制中心,浙江 杭州 311199)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)为无囊膜、单股负链环状DNA病毒,可引起断奶仔猪多系统衰竭综合征、猪皮炎与肾病综合征、增生性坏死性肠炎和繁殖障碍等多种疾病,该病原体已在全球流行,给养猪业造成了巨大的经济损失[1-3]。PCV2包含11个重叠的开放阅读框(Open reading frames,ORFs),其中ORF1和ORF2为2个主要开放阅读框,ORF1基因编码与病毒复制相关的蛋白;ORF2基因编码病毒主要的结构蛋白——衣壳蛋白(Capsid,Cap),该蛋白参与宿主免疫应答,是病毒主要的免疫原性蛋白[4,5]。由于PCV2基因具有较高的突变率和重组率,导致新的PCV2变异株不断出现[6-9],根据PCV2全基因组和ORF2基因分型,PCV2可分为PCV2a、PCV2b、PCV2c、PCV2d、PCV2e、PCV2f、PCV2g和PCV2h共8个基因型,各基因型之间存在抗原差异[10]。因此,对不同地区的PCV2流行毒株开展基因序列分析,有助于了解不同地区PCV2的分子流行病学特征及其遗传变异情况。为了进一步了解近年来浙江省内的PCV2流行毒株和变异状况,为科学选择疫苗和有效防控PCV2提供依据,本试验对2021年采自浙江省各地的PCV2阳性组织病料进行了PCV2全基因组扩增、克隆、测序和遗传变异分析。
1 材料与方法
1.1 主要试剂 DNA凝胶回收试剂盒MiniBEST Agarose Gel DNA Extraction Kit、ExTaq酶、DL2 000 DNA Marker、DH5α感受态细胞和X-gal,均购自宝生物工程(大连)有限公司;pGEM®-T Easy Vector Systems,购自Promega公司;病毒核酸提取试剂盒MagNA Pure 96 DNA and Viral NA Small Volume Kit,购自Roche公司;LB固体培养基、LB液体培养基、异丙基硫代半乳糖苷,均购自生工生物工程(上海)股份有限公司。
1.2 主要仪器 荧光定量PCR仪(型号ViiA 7),为ABI公司产品;PCR仪(型号 Mastercycler nexus)、冷冻高速离心机(型号5430R),为Eppendorf公司产品;全自动核酸提取仪MagNA Pure 96,为Roche公司产品。
1.3 组织样品采集和处理 为了监测PCV2遗传变异状况,收集2021年浙江省杭州市、宁波市、温州市、湖州市、绍兴市、金华市、衢州市、丽水市和嘉兴市无害化处理场和屠宰场经荧光定量PCR鉴定的PCV2阳性组织病料。取适量的组织病料剪碎,加1 mL无菌PBS缓冲液进行研磨,冻融3次,10 000 r/min离心5 min,取上清液置于-80 ℃冰箱中备用。
1.4 引物设计与合成 根据GenBank中PCV2基因序列,设计PCV2全基因组扩增引物(PCV2-FF491:5′-GAACCGCGGGCTGGCTGAACTTTTGAAAGT-3′,PCV2-FR470:5′-GCACCGCGGAAATTTCTGACAAACGTTACA-3′),引物由生工生物工程(上海)股份有限公司合成。
1.5 PCV2全基因组扩增、克隆和测序 按照病毒核酸提取试剂盒说明书提取经处理的组织病料中的病毒核酸。以提取的病毒核酸为模板,利用引物PCV2-FF491和PCV2-FR470扩增PCV2全基因组片段。PCV2全基因组扩增反应体系(50 μL):10×ExTaqBuffer 5 μL,ExTaq0.25 μL,PCV2-FF491 1 μL,PCV2-FR470 1 μL,dNTP Mixture 4 μL,模板5 μL,无RNA酶水33.75 μL。PCR反应程序:94 ℃预变性1 min;98 ℃变性 10 s,54 ℃退火30 s,72 ℃延伸2 min,共35个循环;最后72 ℃延伸10 min。对PCR产物进行2%琼脂糖凝胶电泳检测。按照试剂盒说明书切胶回收目的基因片段,并将目的基因克隆至pGEM®-T Easy载体,转化DH5α感受态细胞,在含有氨苄青霉素的LB平板上培养18~24 h。挑选并扩增单菌落,采用菌落PCR方法筛选重组菌株。将含目的基因片段的重组菌株送生工生物工程(上海)股份有限公司测序。
1.6 PCV2全基因组和ORF2基因序列分析 利用DNASTAR软件分析本试验获得的PCV2流行株与不同国家和地区的参考毒株(表1)之间的全基因组和ORF2基因核苷酸序列,及其推导的Cap蛋白氨基酸序列,以分析各毒株之间全基因组和ORF2基因核苷酸序列同源性及Cap蛋白氨基酸序列同源性。采用Mega 7软件中的邻接法(Neighbor-joining method)构建遗传进化树。
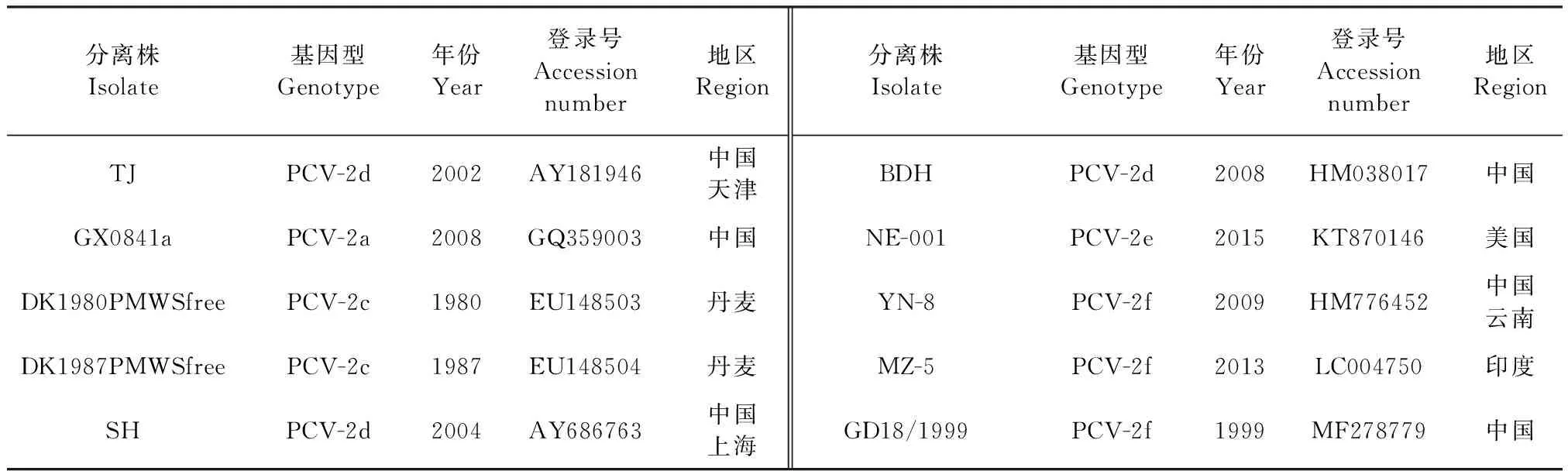
表1 本试验参考毒株信息Table 1 Information of the reference strains in the study
2 结果
2.1 PCV2全基因组同源性和遗传进化分析 对PCV2阳性病料进行PCV2全基因组扩增、克隆和测序,共获得浙江省内不同地区的27株PCV2流行株全基因组序列。PCV2全基因组序列分析结果显示,27株PCV2流行株全基因组核苷酸序列长度介于1 766~1 777 bp,其中1株为1 766 bp、18株为1 767 bp、7株为1 768 bp、1株为1 777 bp。27株PCV2流行株之间全基因组核苷酸序列同源性为91.0%~99.9%,与不同国家和地区的PCV2参考株之间的核苷酸序列同源性为90.7%~ 99.9%。其中与PCV2a代表株(GX0841a、HN-LH-2018、HN-JY-2015)核苷酸序列同源性为91.1%~99.6%;与PCV2b代表株(CL02、SD-QH、ZJ)核苷酸序列同源性为92.1%~99.9%;与PCV2c代表株(DK1980PMWSfree、DK1987PMWSfree)核苷酸序列同源性为92.5%~95.0%;与PCV2d代表株(TJ、SH、SDWH1809、ZB2811)核苷酸序列同源性为92.3%~99.9%;与PCV2e代表株(NE-001、USA/45358/2015)核苷酸序列同源性为90.7%~99.7%;与PCV2f代表株(YN-8、MZ-5、GD18/1999)核苷酸序列同源性为92.0%~96.8%;与PCV2g代表株(ZrBd_wb UKR、P2425 NT、YL5)核苷酸序列同源性为93.1%~97.1%;与PCV2h代表株(PCV2Izn-89-13、HD1-9、HUN-11)核苷酸序列同源性为91.7%~97.2%;与疫苗株(LG、ZJ、DBN-SX07-2)核苷酸序列同源性为91.1%~98.5%。
进化树分析结果显示,27株PCV2流行株分布于4个分支,其中8株PCV2流行株与参考毒株GX0841a、HN-LH-2018和HN-JY-2015亲缘关系较近,处于同一簇,为PCV2a基因型毒株;6株PCV2流行株与参考毒株CL02、SD-QH、ZJ和DBN-SX07-2亲缘关系较近,处于同一簇,为PCV2b基因型毒株;12株PCV2流行株与参考毒株TJ、SH、SDWH1809和ZB2811亲缘关系较近,处于同一簇,为PCV2d基因型毒株;1株PCV2流行株与参考毒株NE-001和USA/45358/2015亲缘关系较近,处于同一簇,为PCV2e基因型毒株(图1)。
2.2 PCV2ORF2基因核苷酸及其推导的氨基酸序列分析 PCV2ORF2基因核苷酸序列分析结果显示,16株PCV2流行株ORF2基因长度为702 bp,编码233个氨基酸;10株PCV2流行株ORF2基因长度为705 bp,编码234个氨基酸;1株ORF2基因长度为717 bp,编码238个氨基酸。27株PCV2流行株之间ORF2基因核苷酸序列同源性为81.7%~99.9%,Cap蛋白氨基酸序列同源性为80.8%~100%;与不同国家和地区PCV2参考株之间的核苷酸序列同源性为81.8%~100%,Cap蛋白氨基酸序列同源性为80.8%~100%;其中与PCV2a代表株(GX0841a、HN-LH-2018、HN-JY-2015)的核苷酸序列同源性为81.8%~100%,Cap蛋白氨基酸序列同源性为80.8%~100%;与PCV2b代表株(CL02、SD-QH、ZJ)核苷酸序列同源性为84.4%~100%,Cap蛋白氨基酸序列同源性为83.4%~100%;与PCV2c代表株(DK1980PMWSfree、DK1987PMWSfree)核苷酸序列同源性为86.8%~90.8%,Cap蛋白氨基酸序列同源性为82.9%~88.9%;与PCV2d代表株(TJ、SH、SDWH1809、ZB2811)核苷酸序列同源性为 84.2%~100%,Cap蛋白氨基酸序列同源性为81.7%~100%;与PCV2e代表株(NE-001、USA/45358/2015)核苷酸序列同源性为81.2%~99.9%,Cap蛋白氨基酸序列同源为性为80.8%~100%;与PCV2f代表株(YN-8、MZ-5、GD18/1999)核苷酸序列同源性为83.4%~94.0%,Cap蛋白氨基酸序列同源性为83.4%~94.5%;与PCV2g代表株(ZrBd_wb UKR、P2425 NT和YL5)核苷酸序列同源性为85.5%~94.8%,Cap蛋白氨基酸序列同源性为83.8%~95.7%;与PCV2h代表株(PCV2Izn-89-13、HD1-9、HUN-11)核苷酸序列同源性为83.8%~95.3%,Cap蛋白氨基酸序列同源性为83.8%~96.6%;与疫苗株(LG、ZJ、DBN-SX07-2)核苷酸序列同源性为82.5%~99.4%,Cap蛋白氨基酸序列同源性为81.2%~98.7%。PCV2ORF2基因进化树分析结果显示,27株PCV2流行株分布于4个分支,其中8株属于PCV2a基因型分支;6株属于PCV2b基因型分支;12株属于PCV2d基因型分支;1株属于PCV2e基因型分支(图2)。
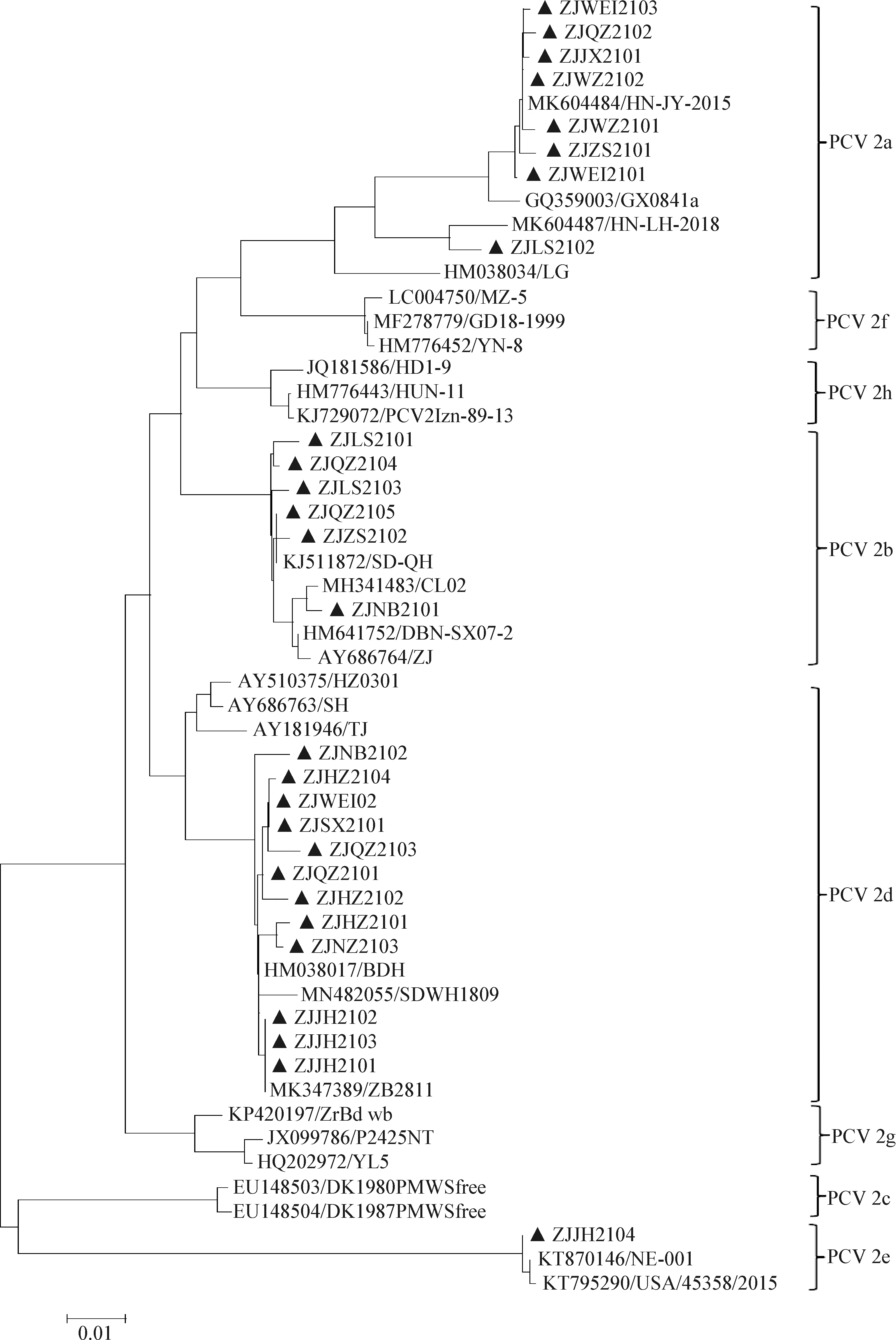
图2 PCV2 ORF2基因核苷酸进化树Fig.2 Phylogenetic tree based on PCV2 ORF2 gene nucleotide sequences
27株PCV2流行株 Cap蛋白在糖基化位点(aa 143~145)和核定位信号区(aa 12~18和aa 34~41)呈高度保守,未发生突变。与3株疫苗株Cap蛋白氨基酸序列比对发现,27株PCV2流行株在Cap蛋白的B细胞抗原表位区(aa 47~63、65~87、113~139、165~200、C端最后4个氨基酸)[11,12]和T细胞表位区[13](aa 61~160、210~230)存在多个氨基酸突变(图3)。本试验获得的8株PCV2流行株具有PCV2a基因型典型氨基酸序列TNKISI(aa 86~91),6株PCV2流行株具有PCV2b基因型典型氨基酸序列SNPRSV(aa 86~91),11株PCV2流行株具有PCV2d基因型典型氨基酸序列SNPLTV(aa 86~91)和TGID(aa 190、191、206、210)(图3)。
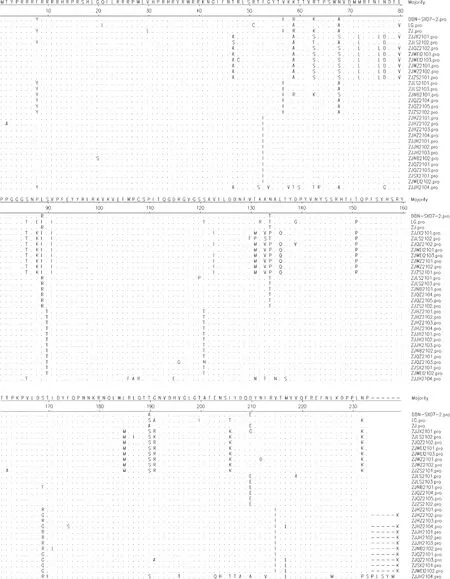
图3 PCV2 ORF2基因编码的氨基酸序列分析Fig.3 Analysis of amino acid sequences encoded by ORF2 gene
3 讨论
目前,PCV2在世界各国广泛流行,给养猪业造成了巨大的经济损失。根据PCV2全基因组核苷酸序列可将其分为8个基因型,即PCV2a、PCV2b、PCV2c、PCV2d、PCV2e、PCV2f、PCV2g和PCV2h。2000年以前,我国流行的PCV2基因型主要以PCV2a为主;2003—2012年,PCV2b成为我国主要的流行毒株,2012年以后,我国流行的PCV2b基因型逐渐向PCV2d基因型转变,同时存在着PCV2a、PCV2b、PCV2e和PCV2h等多个基因型毒株[8,14-18]。本试验共获得27株PCV2流行株,8株为PCV2a基因型毒株、6株为PCV2b基因型毒株、12株为PCV2d基因型毒株、1株为PCV2e基因型毒株,其中PCV2d基因型毒株占比达44.44%(12/27),表明PCV2d基因型毒株为浙江省优势毒株,这与近年来国内主要流行PCV2d基因型毒株的报道一致[19-23]。
ORF2基因编码的衣壳蛋白(Cap蛋白)为PCV2主要结构蛋白,介导了病毒复制和宿主免疫应答,具有高度的变异性,Cap蛋白部分氨基酸的突变可导致抗原变异或毒力改变[5,8,24,25]。本试验中27株PCV2流行株ORF2基因核苷酸及其推导氨基酸序列同源性分别为81.7%~99.9%和80.8%~100%;与PCV2参考株ORF2基因核苷酸及其氨基酸序列同源性分别为81.8%~100%和80.8%~100%,表明浙江省PCV2毒株发生了不同程度的变异。Cap蛋白氨基酸序列分析结果显示,27株PCV2流行株的Cap蛋白存在着3个主要突变区(aa 47~92、120~139、185~232)。研究表明,Cap蛋白第77位和第206位氨基酸是抗体识别的关键位点,该位点的突变可影响抗体对PCV2毒株的识别[4]。与3株疫苗株(LG、ZJ、DBN-SX07-2)的Cap蛋白氨基酸序列相比,本试验中部分毒株Cap蛋白第77位和第206位发生变异,可能导致其可逃避疫苗的免疫保护。
本试验获得的8株PCV2a基因型流行株与3株疫苗株Cap蛋白氨基酸序列的同源性为88.0%~91.5%;6株PCV2b基因型流行株与3株疫苗株Cap蛋白氨基酸序列的同源性为90.6%~98.7%;12株PCV2d基因型流行株与3株疫苗株Cap蛋白氨基酸序列的同源性为89.7%~94.0%;1株PCV2e基因型流行株与3株疫苗株Cap蛋白氨基酸序列的同源性仅为81.2%~84.6%,同源性较低。目前,国内商品化疫苗多基于PCV2a和PCV2b基因型而研制,研究表明,该类型的疫苗对PCV2a、PCV2b和PCV2d毒株具有良好的保护效果[26,27],但对国内新出现的PCV2e和PCV2f保护效果如何有待于进一步研究。
