3株鸡传染性贫血病毒的分离鉴定、VP1基因遗传进化分析及致病性评价
2023-10-26胡小飞段佳蕾霍环艳薛景景张盼涛田克恭
张 亚,胡小飞,段佳蕾,田 辉,孙 哲,霍环艳,薛景景,张盼涛,田克恭
(1. 国家兽用药品工程技术研究中心,河南 洛阳 471000 ; 2. 普莱柯生物工程股份有限公司,河南 洛阳 471000)
鸡传染性贫血(Chicken infectious anemia,CIA)是由鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)引起的雏鸡以贫血和免疫抑制为主要特征的传染病。该病于1979年首次在日本被发现[1],我国于1992年由崔现兰等[2]首次报道,此后全国各地陆续出现相关报道[3-5]。CIA发病特征主要表现为淋巴器官萎缩、骨髓细胞脂肪化和再生障碍性贫血[6]。育成鸡群感染CIAV表现为生长迟缓、体重下降。若产蛋鸡群在开产初期感染CIAV,会导致产蛋率上升缓慢;在产蛋高峰期感染该病毒则导致产蛋率下降10%~25%。种鸡感染CIAV,可传播给后代雏鸡,造成雏鸡死亡率增加。商品鸡群感染CIAV则引起饲料转化率下降、料肉比增加,严重影响经济效益。CIAV的另一重大危害是与其他病原(如马立克氏病病毒、网状内皮组织增生征病毒、禽白血病病毒等)混合感染,可使CIAV的致病性增强,加剧鸡群病症表现,死亡率增加[7]。张言坤[8]研究显示,CIAV感染可影响其他疫苗的免疫效力。
目前,CIAV只有1个血清型,但是不同地区CIAV分离株之间的基因组序列存在差异,毒力也有所不同[9,10]。CIAV基因组由单链环状负链DNA组成,大小为2 298 bp或2 319 bp,共编码3种病毒蛋白,分别为VP1、VP2和VP3[11]。VP1为病毒的主要结构蛋白,变异率最大,高变区为第139~151位氨基酸,Renshaw等[12]报道显示,高变区内的第139和144位氨基酸在CIAV的繁殖和传播中起重要作用;VP2为非结构蛋白,较为保守;VP3又称为凋亡素,可诱导感染细胞发生凋亡。因此,VP1基因序列常被用来进行毒株的变异情况分析,关键氨基酸位点常被用来进行毒株的致病力分析。本试验于2020年从江西省、宁夏回族自治区和山东省3个大型鸡场采集的临床样品中分离CIAV,并对CIAV分离株进行VP1基因遗传进化分析,以期对CIAV的流行、病毒的遗传变异规律及防控技术研究提供理论和方法的参考。
1 材料与方法
1.1 临床样品 共10份肝脏和脾脏组织样品,于2020年分别采集自山东省、江西省和宁夏回族自治区3个疑似感染CIAV的养殖场,3个养殖场发病鸡临床表现均为精神沉郁、羽毛粗乱,部分鸡只鸡冠苍白,剖检肝脏和脾脏肿大。
1.2 SPF种蛋和SPF鸡 SPF种蛋,购自济南斯帕法斯家禽有限公司;SPF鸡胚,购自济南斯帕法斯家禽有限公司,于普莱柯生物工程股份有限公司[实验动物生产许可证号:SCXK(豫)2014—0001]禽用负压区动物房饲养至1日龄开展试验。
1.3 主要试剂 DNA抽提试剂盒,购自旭基科技股份有限公司;DNA Marker和PremixTaq(ExTaqVersion 2.0 Plus Dye),均购自宝日医生物技术有限公司;引物合成和基因测序,均由苏州金唯智生物科技有限公司完成。
1.4 主要仪器 PCR仪(C1000 Touch)和凝胶成像系统(Gel Doc TMXR),美国伯乐公司产品;电泳仪(DYY-2C),北京六一生物科技有限公司产品;多样品组织研磨器,上海净信实业发展有限公司产品;负压型安全隔离器,苏州市冯氏实验动物设备有限公司产品。
1.5 病毒分离培养和鉴定 取黄豆大小脏器组织样品,剪碎,按照1∶1比例加入pH 7.4无菌PBS,充分研磨,按1∶5体积比加入含5 000 U/mL三抗(青霉素、链霉素和卡那霉素)的PBS,反复冻融3次,于2~8 ℃作用4 h,4 ℃、5 000 r/min离心10 min,收集上清并滤过除菌。取200 μL过滤病毒液用于基因组DNA提取,并进行PCR鉴定。PCR鉴定为阳性的病毒液,接种6日龄SPF鸡胚,每胚0.2 mL,置于37 ℃孵育观察14 d,收获1~14 d死亡鸡胚和14 d存活鸡胚的肝脏组织。按上述相同方法研磨、冻融、离心、滤过除菌制备组织上清液,接种6日龄SPF鸡胚,如此盲传3代,提取第3代盲传产物基因组DNA,以此为模板,进行PCR鉴定。引物序列、扩增条件和检测方法均参照国家标准[13]进行,PCR产物采用1%琼脂糖凝胶电泳检测,结果为阳性的病毒液置于-40 ℃保存备用。
1.6VP1基因序列扩增和测序 根据GD-101株(GenBank:KU050680)基因序列设计合成2对针对VP1基因的测序引物,引物名称和序列见表1。参照病毒DNA抽提试剂盒说明书,提取病毒DNA,以其作为模板进行PCR扩增。PCR反应总体系50 μL:2×PremixTaq25 μL,上、下游引物各1 μL,模板2 μL,灭菌双蒸水21 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,共35个循环;最后72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳确认并纯化后,送公司测序。
1.7VP1基因序列分析和进化树构建 应用Lasergene软件,按照Clustal W计算方法,对分离获得的VP1基因序列,与GenBank中CIAV参考毒株(参考毒株信息见表2)核苷酸序列进行比对。应用MEGA 6.0分析软件进行VP1基因的系统发育分析,采用邻位相接法(Neighbor-Joining)构建系统发育进化树,用Bootstrap值评估进化树的可靠性。
1.8 动物回归试验 取1.5获得的所有阳性病毒液分别进行动物回归试验,根据阳性病毒液的数量进行动物试验分组。将1日龄SPF鸡随机分为试验组和对照组,每组10只,其中试验组为病毒感染组,分组的数量依阳性病毒液的数量而定。试验组以腿部肌肉注射方式分别接种0.2 mL病毒液(103.5EID50),对照组接种同样剂量的pH 7.4无菌PBS。每日观察鸡只的临床症状,试验第14天于各组中随机抽取3只鸡采集抗凝血,比较对照组与试验组血液变化。采血后剖检鸡只,观察剖检病变,同时将骨髓、胸腺、法氏囊用10%福尔马林固定,经常规组织脱水、透明、包埋、切片,进行苏木精-伊红(Hematoxylin-eosin, H.E.)染色,显微镜下观察并记录病理变化。第21天将全部剩余鸡只按上述同样操作,进行观察、采血、剖检和组织病理学检查。
2 结果
2.1 病毒分离培养和鉴定 将10份组织样品按照1.5方法操作获得第3代盲传产物,以提取的基因组DNA为模板,进行PCR扩增。结果显示,3份样品扩增出675 bp条带,与预期结果一致,为CIAV阳性;其余7份样品无条带产生,为阴性(图1)。将分离获得的3株阳性毒株分别命名为202006-JX-016、202006-NX-4-2和202006-SD-2-1。

图1 病料样品的PCR鉴定Fig.1 PCR identification of diseased samplesM:DL2 000 Marker; +:阳性对照; -:阴性对照; 1~3:来自江西省的3份病料; 4~6:来自宁夏回族自治区的3份病料;7~10:来自山东省的4份病料M:DL2 000 Marker;+:Positive control;-:Negative control;1-3:Three diseased samples from Jiangxi;4-6:Three diseased samples from Ningxia;7-10:Four diseased samples from Shandong
2.2VP1基因序列扩增和测序 应用CIAV分段引物对3株分离毒株的VP1基因进行PCR分段扩增,扩增产物片段分别为1 499 bp和783 bp(图2),与预期结果一致。将PCR产物测序、拼接后得到分离株VP1基因序列。
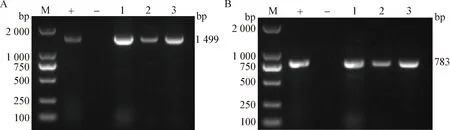
图2 VP1基因序列的PCR扩增Fig.2 PCR amplification of VP1 gene sequenceA:VP1基因的PCR扩增片段1; B:VP1基因的PCR扩增片段2 (M:DL2 000 Marker; +:阳性对照; -:阴性对照; 1:202006-JX-016; 2:202006-NX-4-2; 3:202006-SD-2-1)A:PCR amplification fragment 1 of VP1 gene; B:PCR amplification fragment 2 of VP1 gene (M:DL2 000 Marker; +:Positive control;-:Negative control; 1:202006-JX-016; 2:202006-NX-4-2; 3:202006-SD-2-1)
2.3VP1基因序列分析和进化树构建
2.3.1VP1核苷酸相似性分析 3株分离株202006-JX-016、202006-NX-4-2和202006-SD-2-1的核苷酸相似性介于97.7%~99.6%。202006-NX-4-2株与Ⅱ分支参考株核苷酸相似性介于97.8%~99.3%,与GX1804株相似性最高,且除与JL15120株相似性为97.8%外,与其他Ⅱ分支参考株相似性均在99.0%以上;202006-SD-2-1株和202006-JX-016株与Ⅱ分支参考株核苷酸相似性分别介于97.1%~99.6%和97.2%~99.5%,均与JL15120株相似性最高(图3)。
2.3.2VP1基因氨基酸序列分析 将3株分离株和国内强毒株GD-101株的VP1基因氨基酸序列进行比对,发现202006-JX-016株、202006-NX-4-2株和202006-SD-2-1的株的毒力相关位点(第75、89、125、139、141、144和394位)均与GD-101株一致(表3)。

表3 202006-JX-016株、202006-NX-4-2株和202006-SD-2-1株氨基酸位点比较Table 3 Comparison of amino acid sites among strains 202006-JX-016,202006-NX-4-2 and 202006-SD-2-1
2.3.3 遗传进化分析 将3株分离株VP1基因核苷酸序列与国内外参考株序列(表2)进行比对,构建VP1基因进化树,结果显示,进化树由4个分支组成,3株分离株均属于同一进化分支(Ⅱ分支),与经典株Cux-1株(Ⅰ分支)不属于同一进化分支;202006-JX-016株和202006-SD-2-1株与JL15120株进化关系最近,202006-NX-4-2株与其他Ⅱ分支参考株有更近的遗传距离(图4)。

图4 基于分离株VP1基因的遗传进化树Fig.4 Plylogenetic tree based on VP1 gene of the isolates●:本试验分离株; ▲:疫苗参考株●:Strains isolated in this study; ▲:Vaccine reference strains
2.4 动物回归试验 选择1日龄SPF鸡对3株分离毒株进行动物回归试验,设定3个试验组和1个对照组。结果显示,202006-NX-4-2株试验组8/8发病,感染后第11~14天死亡2只;202006-SD-2-1株试验组8/10发病,感染后第18~19天死亡2只;202006-JX-016株试验组10/10发病,感染后第19~20天死亡2只。临床症状观察结果显示,与对照组相比,试验组鸡群精神萎靡、羽毛蓬乱、鸡爪和鸡冠苍白。试验第14和21天剖检可见各试验组均有明显病变,表现为胸腺、法氏囊和脾脏萎缩,骨髓黄化,脾脏颜色变淡(图5A),血液稀薄(图5B)。病理切片结果显示,骨髓中造血细胞和红细胞数目明显减少,胸腺和法氏囊中胸腺小叶/淋巴滤泡体积变小、明显萎缩,淋巴细胞数目明显减少、逸失(图5C)。
3 讨论
CIAV的VP1蛋白是核衣壳蛋白,并且是唯一的结构蛋白和主要的免疫原蛋白,可刺激机体产生较高的中和抗体。VP1基因的突变率最高,且有研究表明,基于CIAV全基因组和基于VP1基因构建的进化树一致,而基于VP2和VP3基因构建的进化树不能够细致分群[14]。本试验对2020年发病鸡场采集的样品进行CIAV的分离培养和特异性PCR检测,获得3株CIAV分离株,对其进行VP1基因测序和比对,结果显示,3株CIAV分离株相似性介于97.7%~99.6%;202006-NX-4-2株与GX1804株相似性最高,且除与JL15120株相似性为97.8%外,与其他Ⅱ分支参考株相似性均在99.0%以上;202006-SD-2-1株和202006-JX-016株均与JL15120株相似性最高。进化树分析结果显示,3株CIAV分离株均属于遗传进化树Ⅱ分支,与国内大多数CIAV病毒株属同一分支。其中Ⅰ分支的Cux-1株是德国2008年分离株,我国早期分离株大多与其亲缘关系较近[15],而从本试验的毒株系统发育进化树可以看出,3株分离株均与Cux-1株亲缘关系较远,分别处于2个不同的进化分支,说明目前我国流行毒株基因发生了变异。CIAV VP1蛋白的第394位氨基酸是病毒毒力强弱的主要决定因素,当该位点为谷氨酰胺(Q)时,病毒表现为高致病性,当该位点为组氨酸(H)时,病毒表现为低致病性[16]。本试验分离的3株毒株在VP1蛋白第394位均为Q,提示3株分离株均为高致病性病毒株,而3株分离株动物回归试验均引起严重的淋巴器官萎缩、骨髓黄化、血液稀薄等病理变化也证实了这一点。
CIAV可以通过水平和垂直传播,大日龄鸡只感染后不会出现临床症状,但该病毒可以垂直传播给子代鸡只,感染CIAV的子代鸡只可引起继发感染,影响其他疫苗的免疫效力。目前CIA主要通过免疫弱毒活疫苗进行预防,较多养殖场使用的弱毒活疫苗为德国Cux-1株疫苗。本试验结果表明,该疫苗株与我国近期分离株的亲缘关系较远,对高致病性CIAV毒株引起CIA的保护作用较弱,不能满足当前CIA预防和控制的需要。
本试验结果提示,我国近几年CIAV分离株已经发生变异,现有弱毒活疫苗在未来可能不适用于我国CIA的免疫预防。且弱毒活疫苗存在毒力返强风险,当务之急是研发更为安全有效的亚单位疫苗或核酸疫苗。本试验为筛选我国当前流行病毒株和研发适合国内的更为有效的疫苗提供了科学依据和技术支撑。
