2021年我国部分省份猪圆环病毒2型流行病学调查和基因分析
2023-10-26黄正波董雅琴代飞燕吴发兴
黄正波,崔 进,张 慧,尼 博,刘 爽,张 锋,董雅琴,魏 荣,代飞燕,吴发兴
[1.云南农业大学动物医学院,云南 昆明 650201 ; 2.中国动物卫生与流行病学中心,山东 青岛 266032 ;3. 农业农村部动物生物安全风险预警及防控重点实验室(南方),山东 青岛 266032]
猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科(Circoviridae)圆环病毒属(Circovirous),为单股负链环状DNA病毒。PCV感染能够引起断奶仔猪多系统衰弱综合征、猪皮炎肾病综合征等。PCV可导致猪产生免疫抑制,使猪抵抗力降低,从而继发其他疫病的发生。临床中PCV易与猪伪狂犬病毒(Porcine pseudorabies virus,PRV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)等其他病原混合感染[1]。
根据基因型的不同,PCV可以分为猪圆环病毒1型(Porcine circovirus type 1,PCV1)、猪圆环病毒2型(Porcine circovirus type 2,PCV2)和猪圆环病毒3型(Porcine circovirus type 3,PCV3)3个血清型,其中PCV2为对我国影响较为严重的血清型[2]。目前,PCV2可以分为5种基因亚型,包括PCV2a、PCV2b、PCV2c、PCV2d和PCV2e亚型,其中除PCV2c亚型外,其他基因亚型均存在于我国猪群中[3]。系统发育分析比较表明,PCV2b亚型在2007—2014年期间在意大利北部最为流行[4]。我国PCV2流行毒株于2000年由PCV2a亚型向PCV2b亚型转换,且PCV2b亚型毒株数量逐渐增加并存在基因缺失的变异株[5]。目前,PCV2d亚型毒株已经在全球范围内广泛存在,我国也正在发生从PCV2b亚型到PCV2d亚型的过度[6]。2016年,PCV2e亚型在我国山西省[7]、湖北省[8]被发现。
PCV2基因组有3个主要的开放阅读框(Open reading frame,ORF),其中,ORF2基因编码的衣壳蛋白(Capsid protein,Cap)是一种PCV特有的结构蛋白,也是PCV2的主要抗原决定簇,与病毒免疫原性有关,常用于分析PCV2的遗传多样性,且ORF2基因的核苷酸突变也使得PCV2不断进化并伴有新毒株的出现[9]。本试验对2021年我国7个地区共16个省、市、自治区的猪源样品进行PCV2流行病学调查,分析我国PCV2的感染情况和遗传变异趋势,以期为PCV2的防控提供参考。
1 材料与方法
1.1 样品采集和区域划分 2021年分别于天津市、黑龙江省、新疆维吾尔族自治区等16个省、市、自治区进行样品采集,将16个省、市、自治区划分为7个地区:华北地区(北京市、天津市、河北省)、华东地区(山东省、安徽省、福建省)、东北地区(黑龙江省、辽宁省)、华中地区(河南省、湖南省)、华南地区(广东省、广西壮族自治区)、西北地区(陕西省、新疆维吾尔自治区)、西南地区(贵州省、云南省)。为获得真实有效的数据,本试验采取随机采样的方式,依据各地屠宰场的数量和规模,并在工作便利性和条件限制性的基础上,于以上7个地区随机选取10家以上的屠宰场进行采样,各地区均需采集样品200份以上,共计从107个屠宰场中采集到1 685份组织(脾脏、淋巴结、肺脏等)样品,保存于-20 ℃冰箱备用。
1.2 主要试剂 TaKaRaExTaq®Hot Start Version RR006a和PremixTaqTM(ExTaqTMVersion 2.0 plus dye) RR902a,均购自宝日医生物技术(北京)有限公司;病毒DNA/RNA提取试剂盒(4.0),购自西安天隆科技有限公司。
1.3 主要仪器 NP968-C核酸提取仪,西安天隆科技有限公司产品;CFX96 Real-Time PCR Detection System和BIO-RAD凝胶成像系统,美国伯乐公司产品;2720 Thermal Cycler PCR仪,美国 Applied Biosystems公司产品。
1.4 组织样品处理 将各组织样品剪碎,加入1 mL PBS研磨,2 000 r/min离心 10 min后取上清,按照病毒DNA/RNA提取试剂盒说明书操作,分别提取1 685份组织样品总DNA,保存于-20 ℃备用。
1.5 实时荧光定量PCR检测 参考我国PCV2流行毒株的全基因组序列,设计PCV2实时荧光定量PCR检测方法引物和探针。引物序列:上游引物PCV2/F:5′-GGATATTGTAGTCCTGGTCG-3′;下游引物PCV2/R:5′-CCACTATTGATTACTTCCAACC-3′;探针序列:PCV2/real-Probe:5′-FAM-TCGAACGCAG-TGCCGAGGCC-BHQ1-3′,引物和探针均由生工生物工程(上海)股份有限公司合成。以1.4中提取的DNA为模板进行检测,实时荧光定量PCR扩增反应体系(总体积为25 μL):10×Buffer 2.5 μL,dNTPs 2.0 μL,ExTaqHS 0.2 μL,上、下游引物各0.5 μL,探针0.5 μL,ddH2O 16.8 μL,模板2.0 μL。反应程序:95 ℃预变性3 min;95 ℃变性10 s,62 ℃退火20 s,共计45个循环。结果判定标准:Ct<35为阳性,35≤Ct≤37为疑似,Ct>37为阴性。需要对疑似结果进行复检,如复检结果为阳性则记为阳性,复检结果仍为疑似或阴性记为阴性。统计各省、市、自治区以及7个地区的样品阳性率和场阳性率[场阳性率(%)= 检出阳性的场数÷总场数×100%]
1.6 PCV2全基因组PCR扩增 参考我国PCV2流行毒株的全基因组序列,设计PCV2全基因组分段PCR扩增引物。第1段PCR引物序列:上游引物PCV2/F1:5′-TCCGCTGCCACATCGAG-3′;下游引物PCV2/R1:5′-AAACTACTCCTCCCGCCACA-3′,扩增产物大小为1 007bp。第2段PCR引物序列:上游引物PCV2/F2:5′-ATTGTACATACATGGTTACACGGAT-3′;下游引物PCV2/R2:5′-GAACGGTCACCAGACTCCC-3′,扩增产物大小为1 025bp,引物均由生工生物工程(上海)股份有限公司合成。第1段和第2段PCR扩增反应体系(50 μL):DNA模板5.0 μL,上、下游引物各1.0 μL,ExTaqVersion 2.0 plus dye 25.0 μL,去离子水18.0 μL。第1段和第2段PCR扩增反应程序:95 ℃预变性5 min;95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,30个循环;最后72 ℃延伸10 min,4 ℃ 10 min。选取45份实时荧光定量PCR检测结果为阳性的样品进行全基因组PCR扩增,第1段和第2段PCR产物经1.2%琼脂糖凝胶电泳检测,核酸扩增为阳性的样本送至生工生物工程(上海)股份有限公司测序,测序结果使用DNASTAR 软件拼接,获得全基因组序列。
1.7 PCV2全基因组序列比对分析 用DNASTAR 软件将45株分离毒株的全基因组序列与GenBank数据库中的26个参考序列(表1)进行同源性分析。用MEGA 6.0软件,以Minimum-Evolution方法绘制分子遗传进化树。用MegAlign软件,以Clustal W方法比对ORF2基因序列和Cap蛋白氨基酸序列。
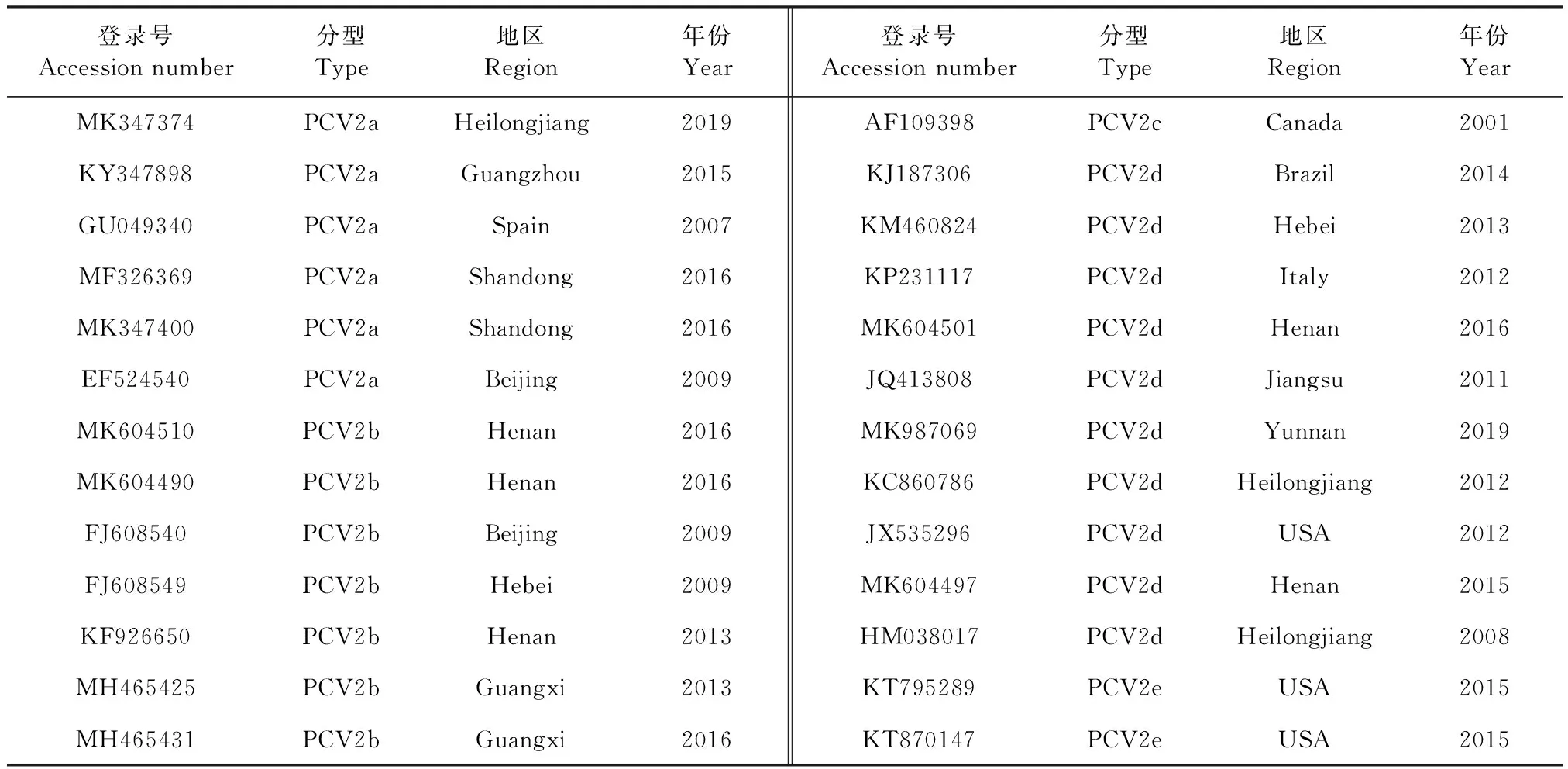
表1 参考毒株Table 1 Reference strains
2 结果
2.1 PCV2流行病学调查 组织样品PCV2实时荧光定量PCR检测结果如表2所示,被检样品总阳性率为9.85%(166/1 685),场总阳性率为32.71%(35/107);各地区样品阳性率介于4.29%~19.00%,其中东北地区最高,为19.00%,西北地区最低,为4.29%;各地区场阳性率介于6.90%~60.00%,其中华中、东北、华东地区场阳性率较高,分别为60.00%、53.85%、50.00%,华北、西南、华南、西北地区次之,分别为33.33%、30.00%、29.14%、6.90%。除北京市、陕西省和贵州省外,其余各省、市、自治区均检出PCV2。PCV2阳性省份中,天津市、山东省、黑龙江省等7个省、市样品阳性率高于10.00%;河北省、安徽省、湖南省等6个省、自治区的样品阳性率低于10.00%;广东省样品阳性率最高,为30.00%,广西壮族自治区样品阳性率最低,为2.22%。PCV2阳性省份中,场阳性率最高的省份为湖南省,达到100%,最低的省份为新疆维吾尔自治区,为8.33%。
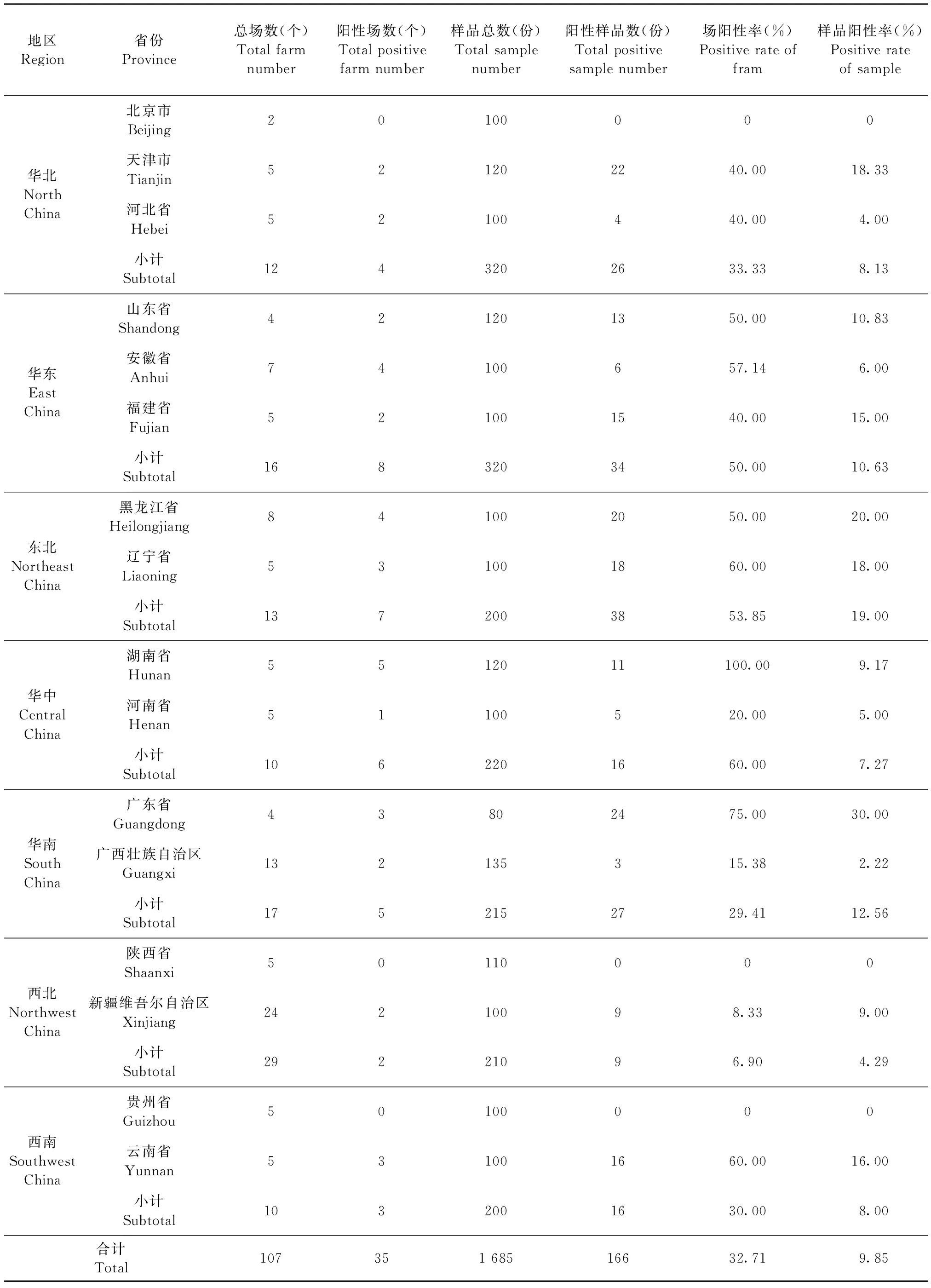
表2 2021年各地区PCV2感染情况Table 2 PCV2 infection in each regions in 2021
2.2 PCV2全基因组序列比对分析 选取45份PCV2阳性样品进行全基因组测序分析,结果显示,45株PCV2分离毒株的同源性介于94.2%~100%,与参考毒株间的同源性介于94.1%~100%;在45份样品中共检出PCV2a、PCV2b、PCV2d三种亚型(图1),其中14株分离毒株为PCV2a亚型,占比为31.11%;2株分离毒株为PCV2b亚型,占比为4.44%;29株分离毒株为PCV2d亚型,占比为64.44%;未检测到PCV2c和PCV2e亚型。
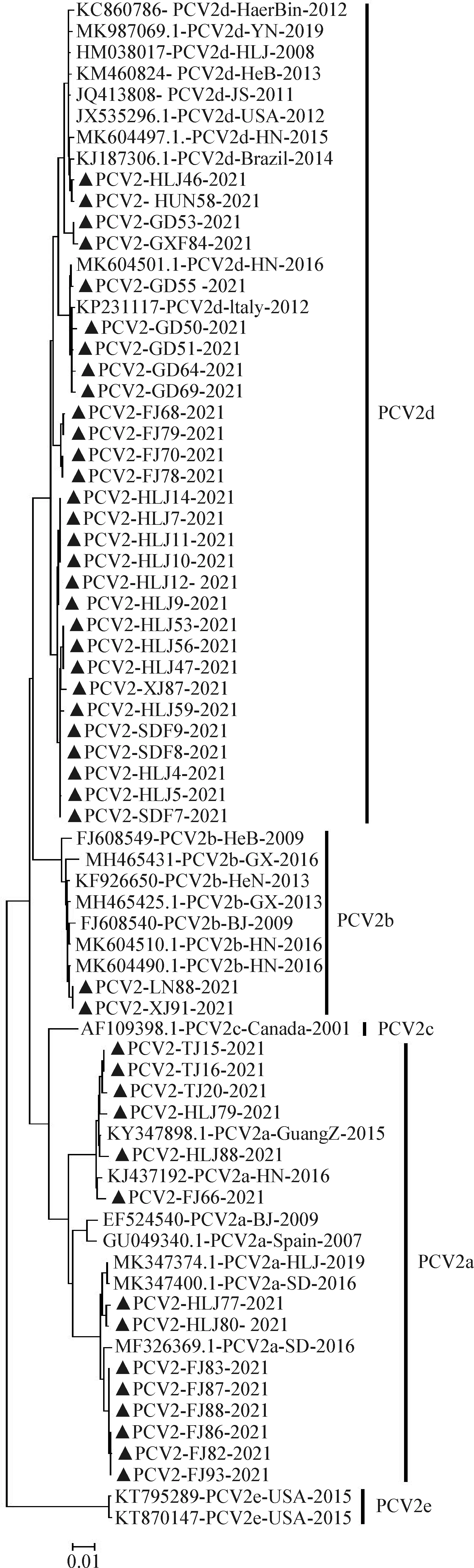
图1 PCV2全基因组遗传进化分析Fig.1 Phylogenetic analysis of PCV2 whole genome▲:本试验分离毒株▲:Strains isolated in this study
2.3 分离毒株ORF2基因和Cap蛋白序列分析 45株分离毒株的ORF2基因长度介于702~705 nt,其中14株PCV2a亚型分离毒株的ORF2基因核苷酸同源性介于92.3%~100%,与7株参考毒株核苷酸序列同源性介于91.8%~100%;2株PCV2b亚型分离毒株的ORF2基因核苷酸同源性为100%,且与7株参考毒株核苷酸序列同源性介于96.2%~100%;29株PCV2 d亚型分离毒株的ORF2基因核苷酸同源性介于98.3%~100%,且与10株参考毒株核苷酸序列同源性介于96.2%~100%。
ORF2基因编码Cap蛋白的氨基酸序列比对分析结果显示,PCV2a亚型分离毒株的第86~91位氨基酸序列为TNKISI,PCV2b亚型分离毒株为SNPRSV;PCV2d亚型分离毒株为SNPLTV(图2)。PCV2a亚型分离毒株第190、191、206、210位的氨基酸序列为SR(K)DK,PCV2b亚型分离毒株为TGIE,PCV2d亚型分离毒株为TGID(图3)。有24株PCV2分离毒株的ORF2基因终止密码子发生突变,由TAA突变为AAA或AAG,导致ORF2基因由702个核苷酸变为705个核苷酸,其编码的Cap蛋白在C末端有1个赖氨酸(K)延伸,这24株PCV2分离毒株均为PCV2d亚型;另有1株PCV2d亚型分离毒株的ORF2基因终止密码子由TAA突变为ATG,ORF2基因由702个核苷酸变为705个核苷酸,其编码的Cap蛋白在C末端有1个蛋氨酸(M)延伸。
3 讨论
本调查涉及我国7个地区共16个省、市、自治区,共采集1 685份组织样品,样品总阳性率为9.85%,场总阳性率为32.71%。7个地区的样品阳性率介于4.29%~19.00%,其中东北、华南和华东地区的样品阳性率超过10.00%,表明这些地区PCV2感染较为严重;各地区的场阳性率介于6.90%~60.00%,其中华中、东北和华东地区的场阳性率超过50.00%,提示这些地区PCV2的污染面较广;各地区中西北地区的样品阳性率和场阳性率均最低,分别为4.29%和6.90%。北京市、陕西省和贵州省在此调查中未检测出PCV2,其余省份的样品阳性率介于2.22%~30.00%,场阳性率介于8.33%~100%。生猪主产区山东省、安徽省、黑龙江省、广东省、湖南省和云南省等省份的场阳性率均高于50.00%,进一步证明我国PCV2的流行具有程度深、污染广的特点。除采样范围和样品数量不均等因素外,各地区样品阳性率和场阳性率差异大的原因还可能与各地区的养殖密度、生物安全水平、交易频率差异等因素有关。
梁鹏帅等[10]采用套式PCR方法对我国华南地区2010—2011年间采集的807份猪血清样品进行检测,结果发现,PCV2的阳性率为30.61%;郭建超等[11]采用PCR方法对华南地区2017年采集的26个种猪场的血液样品进行检测,PCV2的总体感染率为37.87%,而本调查华南地区样品的PCV2阳性率为12.56%。山东省在2015—2018年间的PCV2总体平均阳性率达36.98%[12]。云南省在2016—2019年间的PCV2阳性率为60.93%[13]。与上述研究相比,本调查结果表明,虽然我国PCV2的污染面仍较广,但其样品阳性率有所下降,这可能与非洲猪瘟感染造成的饲养密度下降、防控政策变化和养殖主体生物安全水平提高有关。
PCV2a亚型是在我国发现最早的亚型,近年来PCV2d亚型的检出率有所提高,逐步成为我国PCV2的主导基因型[14,15],这种现象的发生可能与疫苗的使用有关[16]。蔡扩军等[17]对新疆地区PCV2分离毒株进行基因遗传进化分析,结果显示,PCV2d亚型可能成为该地区的优势基因型。2013年,孟张丽等[18]对广东地区经PCV2疫苗免疫后受PCV2感染的病猪进行病毒分离,结果显示,5/9的分离毒株为PCV2d亚型、3/9为PCV2b亚型、1/9为PCV2a亚型。张民秀等[1]研究发现,2014—2016年广西地区猪群受到PCV2d亚型感染的病例呈现增多的趋势。本调查结果显示,PCV2阳性样品中PCV2a亚型占31.11%,分布于福建省、天津市、黑龙江省等地;PCV2d亚型占64.44%,分布于黑龙江省、广东省、福建省等地区;PCV2b亚型占4.44%,分布于辽宁省、新疆维吾尔自治区等地。结果表明,2021年PCV2a、PCV2b和PCV2d亚型的PCV2在我国猪群中流行,其中PCV2d亚型占比较高,但PCV2d亚型是否已成为我国PCV2的主导基因型还需要收集更多的序列进行下一步研究。
PCV2的全基因组大小为1 767或1 768个核苷酸[5,19]。本试验全基因组测序分析发现,45株PCV2分离毒株的全基因组大小与前人研究报道一致。有报道称,存在全基因组大小为1 766个核苷酸的PCV2毒株[20],本试验未发现类似毒株。本试验PCV2分离毒株的ORF2基因核苷酸同源性介于92.3%~100%,与我国各地区参考毒株具有较高的同源性,且无明显的地域性,相似毒株的大面积感染可能与各地区间感染PCV2的生猪频繁交易有关。
研究表明,PCV2ORF2基因长度介于702~705 nt[9]。本试验中共有25株PCV2分离毒株的ORF2基因终止密码子发生突变,导致ORF2基因由702个核苷酸变为705个核苷酸,这25株PCV2分离毒株均为PCV2d亚型,其中24株分离毒株的Cap蛋白在C末端有1个赖氨酸(K)延伸,1株分离毒株的Cap蛋白在C末端有1个蛋氨酸(M)延伸,这种末端延伸和突变是否对病毒产生影响仍需进一步研究。
PCV2 Cap蛋白具有最多的抗原表位,这些表位的氨基酸变化能够影响单克隆抗体与病毒的结合[21]。PCV2各亚型Cap蛋白的氨基酸序列存在差异,PCV2a亚型基序为TNKISI(AA86~91),PCV2b亚型基序为SNPRSV(AA86~91),PCV2d亚型基序为SNPLTV(AA86~91)[14],本试验结果与此一致。Cap蛋白的第190、191、206、210位氨基酸对PCV2的体外复制至关重要[22],PCV2a亚型基序为SRKD(AA190/191/206/210)[23],PCV2b亚型基序为AGIE(AA190/191/206/210)或TGIE(AA190/191/206/210),PCV2d亚型基序为TGID(AA190/191/206/210)[24],本试验PCV2b和PCV2d亚型分离毒株的基序与上述研究报道一致,而部分PCV2a亚型分离毒株的基序出现SKKD(AA190/191/206/210)的突变。Cap蛋白的第173、174、175、179位氨基酸对抗体识别至关重要[25],本试验中3个亚型PCV2的这4个位点均保守。
本试验结果表明,2021年我国PCV2感染范围广,污染程度高,且正在不断发生遗传变异,PCV2流行毒株中PCV2d亚型占比最高。大范围的感染可能促使PCV2不断的发生遗传进化,产生新的变异株,近年新发现的PCV2e亚型可能与此有关,因此需要持续的跟踪监测PCV2的流行情况,制定有效防控措施。
