基于半刚性咪唑羧酸配体构筑的Cu(I)有机骨架材料:合成、晶体结构和性质
2023-10-25潘会宾吴婷婷卢久富
潘会宾,吴婷婷,高 霞,卢久富
(1.商洛职业技术学院,公共课教学部,商洛 726000;2.陕西理工大学化学与环境科学学院,陕西省催化基础与应用重点实验室,汉中 723001;3.商洛学院化学工程与现代材料学院,商洛 726000)
0 引 言
金属有机框架(metal organic frameworks, MOFs)是由金属离子和有机配体组成的结晶固体,由于其在磁性[1]、催化[2]、发光[3]和电化学[4],以及气体吸附[5]和化学传感[6]等方面的应用前景,引起了化学和材料科学家们的广泛关注。然而,MOFs的合理设计和组装仍然面临挑战,有机配体、金属离子和有机溶剂以及pH值等因素对其结构影响较大,导致其分子结构的构建难以预测[6-9]。化学的多功能性和结构定制能力为MOFs的物理和化学性质提供了重要的可调节性[10]。金属离子与预先设计的有机配体在适当的反应条件下结合,可以得到多种具有理想功能的MOFs结构[11]。在配位化学中,具有可变配位数和通用配位几何结构的Co(II)和Cu(I)离子广泛地应用于构建一维、二维或三维配位聚合物[12]。这些金属离子主要与含N或者O原子的供体配体进行配位,其中,含N-杂环芳香羧酸配体是构建MOF的最佳候选配体。4-(2-甲基咪唑)苯甲酸(HMIBA)作为一个多齿配体,具有多种结合和配位模式,易形成具有多孔结构的MOFs材料。一般来说,多孔材料可以通过优化孔隙空间的填充,使体系中的能量最小化。因此,当单个网的孔隙空间足够大,可以容纳另一个网透过,结构互渗才有可能会发生。当配体和金属簇的相同组合产生了两个或者两个以上的网络结构,仅在穿插程度上有所不同时,会成为特定类型的互穿异构体的框架结构[13]。
1 实 验
1.1 仪器及试剂
仪器:红外光谱仪(德国 BRUKER EQUINOX-55);元素光谱仪(美国Elementar Vario ELⅢ);X射线单晶衍射仪(Bruker APEX CCDC);SDT Q600同步热分析仪(升温速率10 ℃/min,氮气气氛,美国TA公司);荧光分光光度计(RF-5301型SHIMADAU公司)。
试剂:4-(2-甲基咪唑)苯甲酸,分析纯,济南恒化科技有限公司,其余所用试剂均为分析纯。
1.2 配位聚合物[Cu(H2O)(MIBA)]n的合成
将CuI(0.1 mmol,19.0 mg)、NaOH(0.15 mmol,12 mg)、HMIBA(0.1 mmol,20.1 mg)、2 mL DMF和4 mL H2O的混合溶剂密封在20 mL内衬为聚四氟乙烯的高压反应釜,将其加热至110 ℃并在该温度下恒温反应3 d,然后在24 h内冷却至室温。收集到聚合物[Cu(H2O)(MIBA)]n的蓝色块状晶体。产率为81%,分子式C22H20CuN4O5(Mr=483.96),元素分析值测量结果(%):C 54.55, H 4.13, N 11.57;实验值(%):C 54.23, H 4.22, N 11.81。IR(cm-1): 3 344(ms), 2 894(m), 2 360(w), 1 622(s), 1 502(m), 1 405(w), 1 345(m), 1 003(s)和525(s)。
1.3 晶体结构测定与解析
选取晶型完整、大小合适的晶体通过Bruker P4CCD单晶衍射仪收集晶体的衍射数据,测试温度为273 K,辐射源(Mo-Kα)波长为0.071 073 nm,在3.15°≤θ≤25.05°以φ-ω扫描方式进行。所有非氢原子坐标用直接法解出,并对其坐标及其各向异性热参数进行了全矩阵最小二乘法修正,氢原子的坐标通过理论加氢确定。所有计算用SHELXS-97[14]和SHELXL-97[15]程序包完成。配位聚合物的晶体学数据见表1,部分键长及键角数据见表2。配位聚合物的CIF数据已经保存在英国剑桥晶体结构数据中心,CCDC号为1569499。

表1 配位聚合物的晶体学数据Table 1 Crystallographic data of coordination polymers

表2 配位聚合物的主要键长和键角Table 2 Selected bond lengths and angles of coordination polymers
2 结果与讨论
2.1 [Cu(H2O)(MIBA)]n配位聚合物的晶体结构
单晶X射线衍射研究表明,Cu(I)配位聚合物属于六方晶系,P6522空间群,不对称单元由1个单价铜原子、1个完全去质子化的MIBA配体和1个单齿配位水分子组成。如图1所示,中心配位金属Cu原子分别与2个MIBA配体中的咪唑环中的2个氮原子(Cu—N键长为1.997(12) Å)以及2个羧基氧原子(Cu—O键长为1.960(7) Å)和1个单齿配位H2O分子中1个氧原子(Cu—O键长为2.387(11) Å)配位,形成一个扭曲的金字塔形几何结构。Cu(I)离子可以看作是1个四连接四面体节点,MIBA配体作为延伸的连接体,连接Cu(I)原子以形成3D多孔结构,可简化为四连通拓扑网络结构(见图2)。图2中的咪唑环与苯环形成的π-π 共轭,聚合物通过π-π堆积连接进行相互作用并形成三维网格结构,两环质心间距离为3.24 Å。为了使大的空隙最小化并稳定框架,由单个3D网络形成的潜在空隙显示了另一个相同空隙的结合,因此提供了2重平行互穿阵列。当沿着晶体c轴观察时,可以发现一个大的1D通道(见图3)。从拓扑学的角度来看,该聚合物呈3D→3D双重互穿网络,可描述为具有(64·82)四连通单节点网络结构(见图4)。

图1 [Cu(H2O)(MIBA)]n的不对称结构单元Fig.1 [Cu(H2O)(MIBA)]n asymmetric structural unit
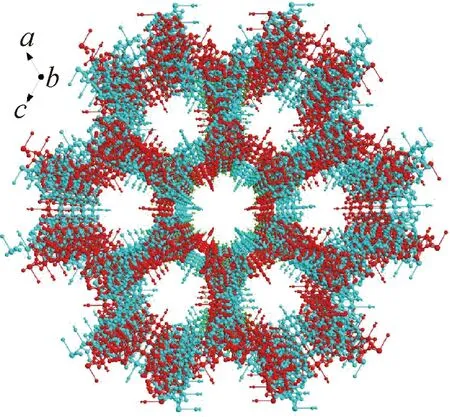
图3 沿着c轴方向具有1D通道的3D多孔框架的视图Fig.3 View of 3D porous framework with 1D channels along c-axis direction
2.2 IR分析
图5为聚合物的红外光谱图。从图中可以看出,该聚合物在3 344 cm-1处有宽带,可能是配位水分子的ν(O—H)伸缩振动。在1 622和1 502 cm-1处的特征与不对称(COO-)和对称(COO-)伸缩振动有关。Δν[νas(COO-)-νs(COO-)]的值为120 cm-1(小于200 cm-1),表明羧酸盐以螯合方式与Cu(I)配位,这与X射线衍射结构分析很好地一致。

图5 [Cu(H2O)(MIBA)]n的红外光谱图Fig.5 IR spectrum of [Cu(H2O)(MIBA)]n
2.3 PXRD分析
X射线粉末衍射(PXRD)实验证明了合成的聚合物的相纯度。实验和模拟的PXRD图谱的峰位置彼此非常一致,这表明已经成功地获得了纯晶相的聚合物(见图6)。

图6 [Cu(H2O)(MIBA)]n的PXRD图谱Fig.6 PXRD patterns of [Cu(H2O)(MIBA)]n
2.4 热稳定性分析
在氮气气氛中,在升温速率为10 ℃/min下对聚合物在35~1 000 ℃内进行了热稳定性能测试,如图7所示。聚合物在25~120 ℃显示了初始质量损失,这可归因于1个配位水分子的去除(观察值:3.9%,计算值:3.7%)。在245~290 ℃进一步质量损失表明配位框架的分解,这可归因于一个MIBA配体的去除(观察:41.7%和计算:41.5%)。分解后,最终残留物为27.7%,可归因于Cu2O(计算值为29.6%)。
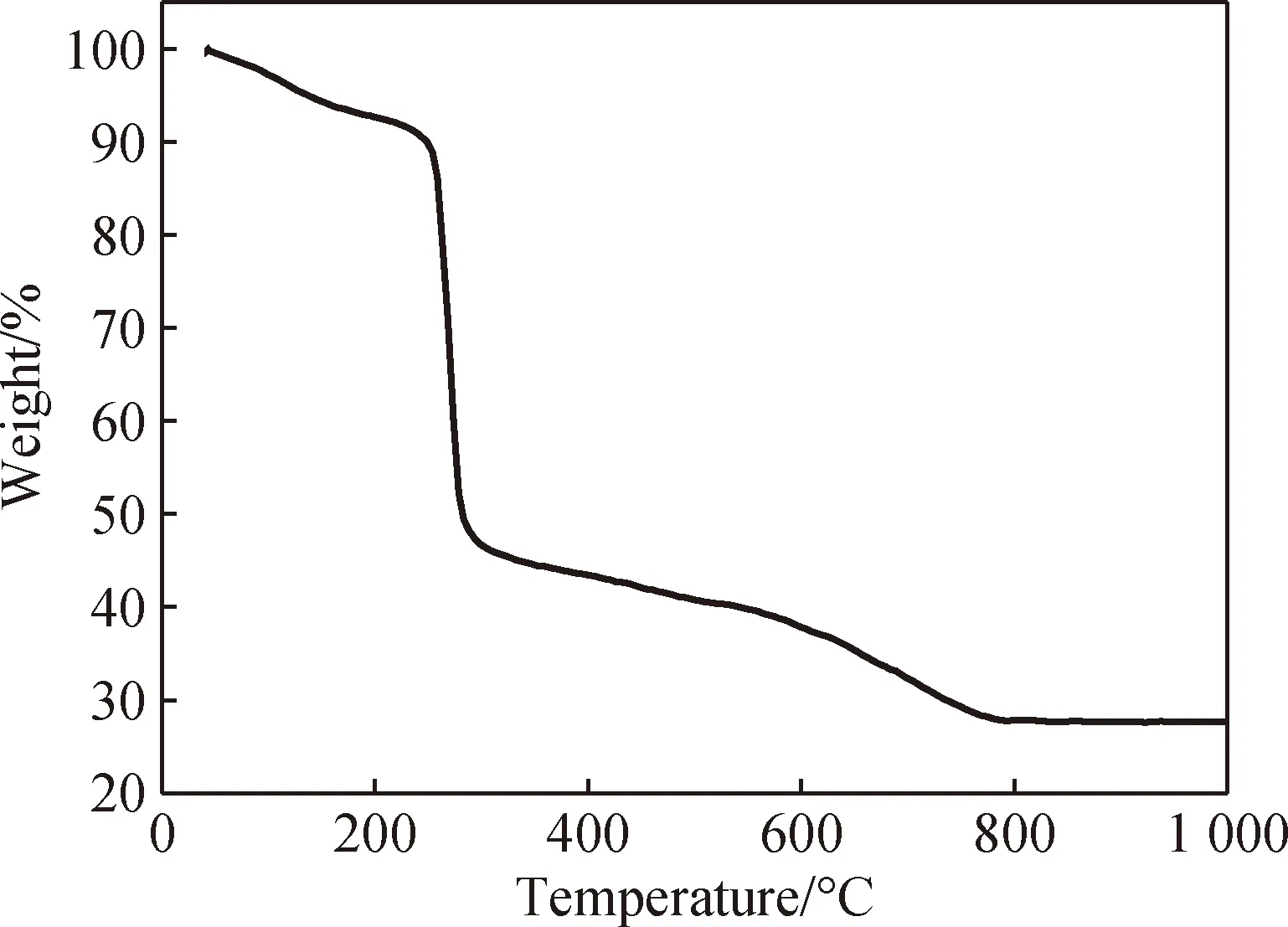
图7 [Cu(H2O)(MIBA)]n的TG曲线Fig.7 TG curve of [Cu(H2O)(MIBA)]n
2.5 配位聚合物[Cu(H2O)(MIBA)]n荧光性能研究
Cu(I)离子具有3d10电子结构,因此合成的配位聚合物[Cu(H2O)(MIBA)]n可能具有发光性质。室温下,对配位聚合物[Cu(H2O)(MIBA)]n和MIBA配体在370 nm的激发光下研究了其荧光性能(见图8), MIBA配体的最大发射峰为433 nm。配位聚合物[Cu(H2O)(MIBA)]n的最大发射峰为412 nm,同时测量了该配合物的量子产率,结果为11.52%,如图9所示,聚合物的发光寿命计算为7.2 μs,其发光性质与许多报道的Cu(I)的发光MOF相似,这主要归因于配体间的电荷转移。发射峰蓝移的现象可以归因于电荷(LMCT/MLCT)迁移机理[16]。
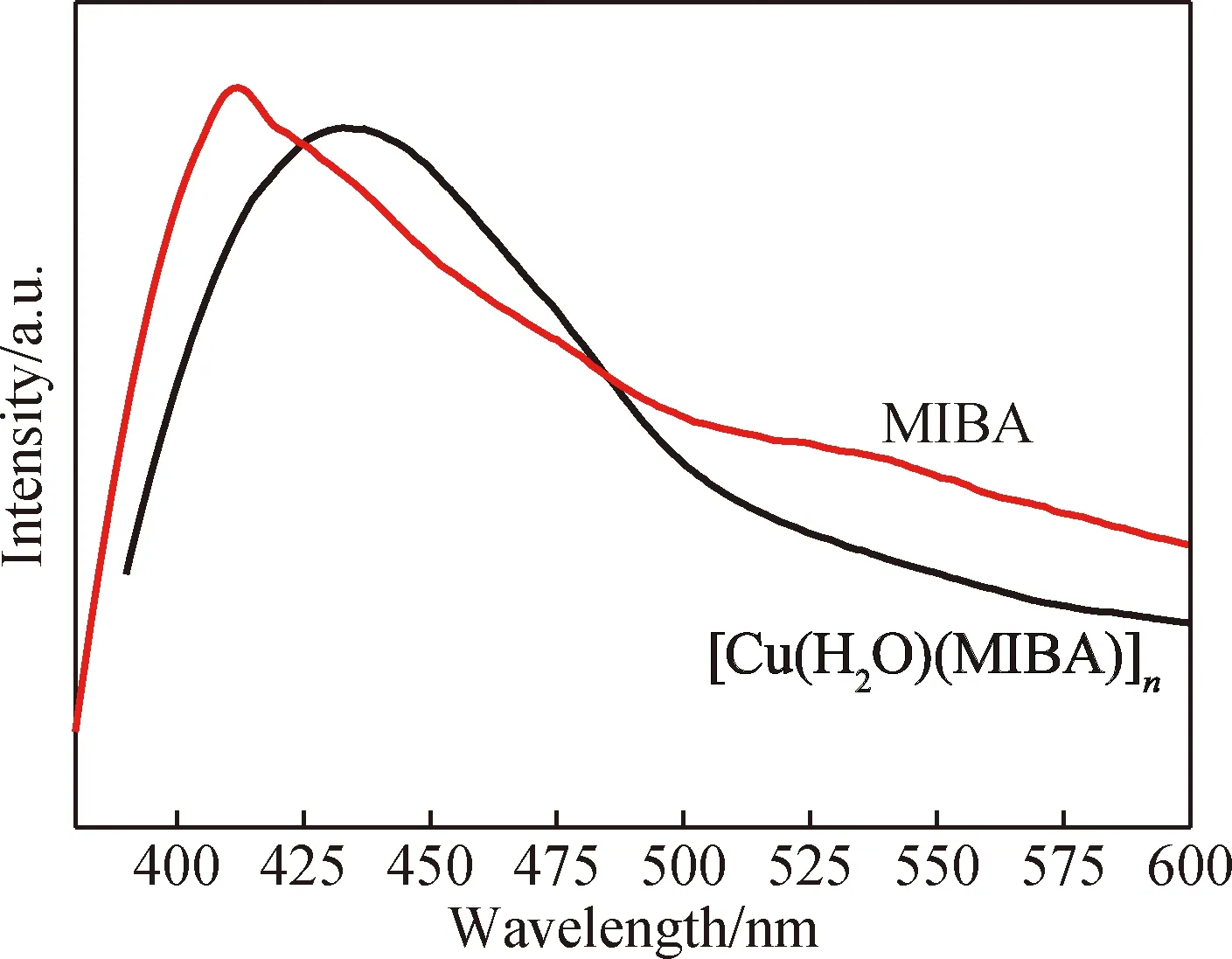
图8 [Cu(H2O)(MIBA)]n和MIBA的荧光谱图Fig.8 Fluorescence spectra of [Cu(H2O)(MIBA)]n and MIBA

图9 [Cu(H2O)(MIBA)]n的发光强度与时间曲线图Fig.9 Luminous intensity versus time graph of [Cu(H2O)(MIBA)]n
3 结 论
本实验采用溶剂热的合成方法,利用双齿配体4-(2-甲基咪唑)苯甲酸(MIBA)多配位点的特性与氢氧化钠和碘化亚铜共同作用下得到的一种新型的聚合物[Cu(H2O)(MIBA)]n。该聚合物呈现具有(64·82)的四连通单节点拓扑结构。经热重分析结果表明[Cu(H2O)(MIBA)]n的失重与其晶体结构一致。此外,聚合物[Cu(H2O)(MIBA)]n还显示出荧光性能。而荧光性能的研究表明,该聚合物可用作发光材料。本实验室正在进行进一步的实验,探索金属离子对配位聚合物的结构影响以及由此引起的物理化学性质的变化。
