配合物{[Cu(pcba)2]2·(MeOH)2}的合成、结构、HSA结合及细胞毒性
2023-10-25曾振芳蔡杰慧黄秋萍庞华钰杨达钦黄秋婵
曾振芳,蔡杰慧,黄秋萍,庞华钰,杨达钦,黄秋婵
(广西民族师范学院化学与生物工程学院,崇左 532200)
0 引 言
铜元素是人体生命活动必不可少的主要微量元素之一[1]。以金属铜为中心络合而成的配合物,在氧化还原的环境中拥有可调控的配位构型,应用于催化[2]、磁体[3]、生物医药[4]和抑菌[5]等多领域。不同的配体提供不同的配位环境,造就了配位化合物的多样性[6]。
抗肿瘤药物与蛋白质的特异性相互作用及其引起的蛋白质的构象变化是诱导肿瘤细胞凋亡作用机制研究的目标、内容和途径,人血清蛋白(human serum albumin, HSA)是血浆中含量丰富的蛋白质,由于HSA重要的生理功能和易于分离、提纯的特性,因而常被作为模型物质用于研究生物大分子与药物小分子间的相互作用[7]。铂类配合物已经作为抗肿瘤药物应用于临床多年[8],顺铂开辟了金属配合物在抗癌领域的研究,顺铂之后,卡铂、奥沙利铂等也应用于临床[9-10],但是铂类配合物因为毒副作用及耐药性等问题,在临床使用上受到限制[11]。铜可通过多种机制诱导细胞死亡,包括活性氧积累、细胞凋亡、蛋白酶体抑制和线粒体功能障碍等[12],但是目前报道的铜配合物的抗肿瘤活性不大。为了开发和发展新型具有抗肿瘤活性且毒性较小的金属铜配合物,本文合成了一个新型配合物{[Cu(pcba)2]2·(MeOH)2},通过红外、元素分析及单晶XRD等方法对配合物进行表征,研究了{[Cu(pcba)2]2·(MeOH)2}的紫外及荧光性质,与HSA的相互作用方式和其对胃癌细胞A549、宫颈癌细胞Hela、肝癌细胞HepG2和人正常肝细胞LO2细胞的增殖抑制能力。
1 实 验
1.1 实验主要仪器、试剂
实验仪器:Spectrum 65型傅里叶变换红外光谱仪(美国PerkinElmer),Smart ApexII CCD X 型X射线单晶衍射仪(德国 Bruker),Multiskan Spectrum型酶标仪(美国Thermo),RF-5301 PC型荧光分光光度计(日本岛津),UV-8000型紫外可见分光光度计(上海分析仪器有限公司),VarioEL III元素分析仪(德国艾乐曼)。
实验试剂:三羟甲基氨基甲烷(Tris)、浓盐酸、对氯苯甲酸(分析纯,上海阿拉丁生化科技),三水合硝酸铜(分析纯,天津市光复科技),甲醇(分析纯,成都市科龙化工),HSA(纯度99%,Sigma),A549、Hela、HepG2和LO2(中国科学院细胞库)。
1.2 配合物{[Cu(pcba)2]2·(MeOH)2}的合成
称取0.070 5 g(0.45 mmol)对氯苯甲酸溶于5.0 mL甲醇中。称取0.024 2 g (0.1 mmol)三水合硝酸铜溶于10.0 mL甲醇中。搅拌下,将硝酸铜甲醇溶液滴入对氯苯甲酸溶液中,结束后,溶液为深蓝透明态,室温下搅拌反应30 min后置于烧杯中,用保鲜膜封好,扎3~4个小孔,室温放置23 d,有块状淡蓝色晶体析出。将晶体过滤后,在60 ℃干燥箱中烘干。{[Cu(pcba)2]2·(MeOH)2}的分子式为C30H22Cl4Cu2O10,相对分子质量MW=811.35。元素分析理论值(%):C 44.41, H 2.73;实验值(%):C 44.25, H 2.80。
1.3 配合物的表征
1.3.1 红外光谱
在玛瑙研钵中将溴化钾研细,以1∶100(质量分数)的比例,将配合物与溴化钾研磨至完全混合状态,压片。在波长为4 500~400 cm-1下,使用Spectrum 65型傅里叶变换红外光谱仪对配合物样品片进行红外扫描。
1.3.2 晶体结构
在光学显微镜下,挑选大小为0.30 mm×0.26 mm×0.18 mm、表面光滑的晶体,293(2) K下,于Smart ApexII CCD X 型X射线单晶衍射仪上,用Cu-Kα(λ=0.154 184 nm)光源进行衍射扫描,角度范围为7.033°<θ<76.314°,在-8≤h≤7,-13≤k≤13,-15≤l≤15的衍射区中收集数据,对配合物晶体进行X单晶衍射。利用SHELXL 97和SHELXS 97[13]程序解析晶体结构,氢原子均为理论加氢。配合物的晶体学、主要键长与键角数据分别列于表1、表2。CCDC: 2104588。R(int)=0.021 0,R1=0.040 0,wR2=0.114 5。
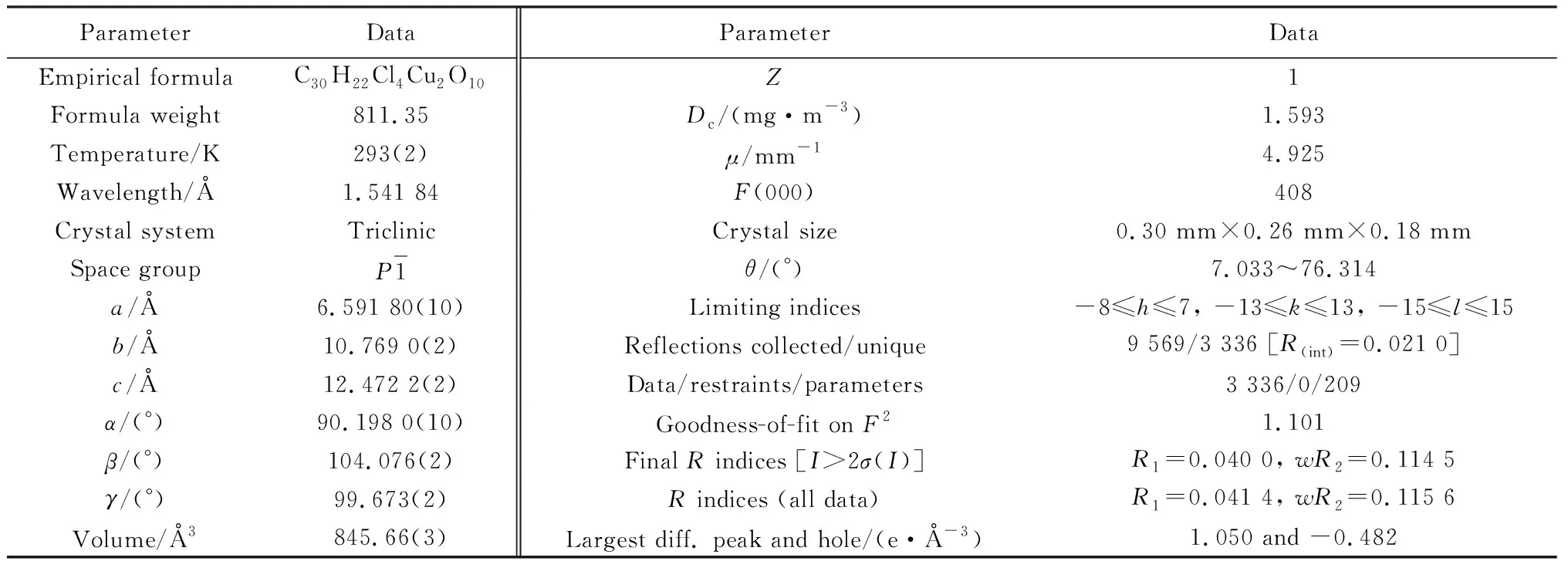
表1 配合物的主要晶体学参数Table 1 Crystallographic data of complex

表2 配合物的主要键长和键角Table 2 Selected bond lengths and bond angles of complex
1.4 配合物晶体的紫外和荧光性质
1.4.1 紫外光谱
称取0.016 2 g (20.0 μmol)样品溶解于20.0 mL DMSO溶液中,配置成浓度为1.0×10-3mol·L-1的溶液。对半稀释成5.0×10-4、2.5×10-4、1.25×10-4、6.25×10-5、3.125×10-5、1.562 5×10-5、7.812 5×10-6mol·L-1。在波长为200~700 cm-1下,用UV-8000型紫外可见分光光度计对配制的8个浓度的样品溶液进行紫外吸收扫描。
1.4.2 荧光光谱
室温下,设置激发波长为326 nm,发射波长为343 nm,在波长为320~400 cm-1下,用RF-5301 PC型荧光分光光度计(日本岛津)对上述配制的8个浓度配合物溶液进行荧光扫描。
1.5 配合物晶体与HSA的相互作用
1.5.1 溶液配制
Tris-HCl/NaCl(pH=7.4)缓冲溶液[14-15]:称取0.605 7 g(5 mmol)的Tris和2.910 2 g(0.05 mol)的NaCl加入烧杯中,加入适量双蒸水,搅拌至完全溶解,转移至容量瓶(1.0 L)中,用浓盐酸调节至所需pH值,定容,备用。HSA(2.0 mmol·L-1)溶液[16-17]:将适量HSA用上述缓冲溶液溶解,测定其在280 nm处的吸光度值A280,按照式HSA=K×A280/35 700(mol/L)计算出稀释倍数,K为稀释所需浓度的倍数,用缓冲溶液稀释,备用。配制好的溶液存放于4 ℃下,3 d内使用。
1.5.2 紫外光谱
样品池和空白池中各放入2.5 mL缓冲溶液,进行系统基线校准。缓冲溶液换成溶剂,去除溶剂影响。样品池中溶剂换成2.5 mL的HSA (2.0 mmol·L-1)溶液,在波长为190~450 nm下进行紫外光谱扫描。使用移液枪将40 μL的配合物(50.0 μmol·L-1)分别加入到样品池和空白池中,每次滴加后,吹打混匀,充分与HSA反应5 min,进行紫外光谱扫描。
1.5.3 荧光光谱
样品池中加入2.5 mL的 HSA(5 μmol·L-1)溶液,寻找到最优激发波长(λex=295 nm)。在波长范围 220~450 nm中扫描。用移液枪向样品池中加20 μL的配合物(1.2 mmol·L-1)溶液,与HSA充分反应5 min后,进行荧光光谱扫描。
1.6 Cell Counting Kit-8(CCK-8)实验
将LO2、HepG2、Hela和A549细胞复苏、传代后,配制成细胞悬液,在96孔细胞培养板中每孔加入5×103个细胞,在37 ℃、5% CO2培养箱中培养20~24 h,每孔加入100 μL配合物溶液,培养48 h,弃上清液,用培养液洗涤细胞后用CCK-8染色,用酶标仪测定OD值(λ=450 nm),每种浓度设3个平行实验。
2 结果与讨论
2.1 配合物的结构
2.1.1 红外光谱分析

2.1.2 晶体结构分析
配合物部分键长、键角列于表2,分子晶体结构如图2所示。
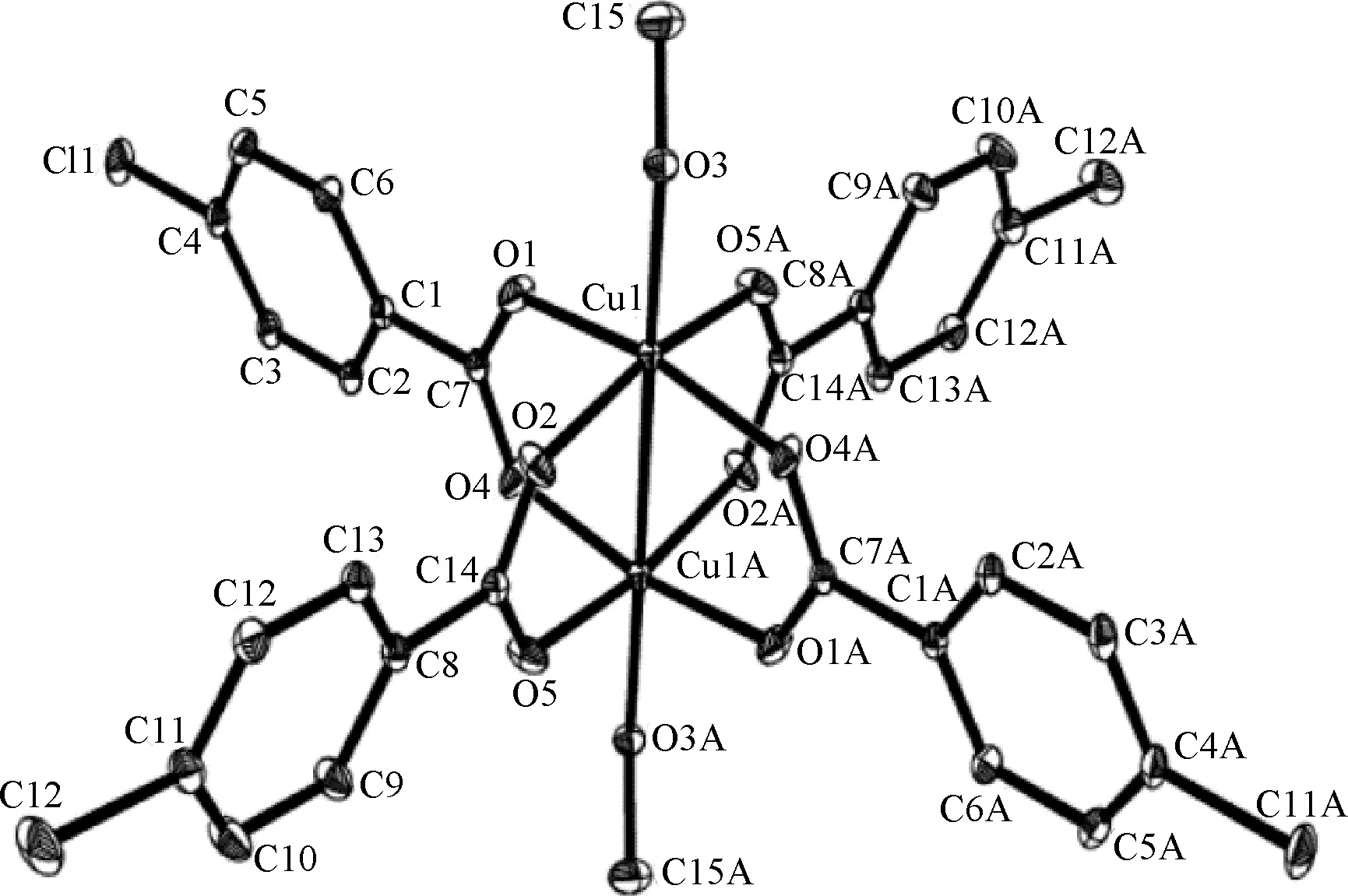
图2 配合物的晶体结构图Fig.2 Crystal structure of complex
2.2 配合物的紫外与荧光性质
2.2.1 紫外光谱分析
由图3紫外吸收谱图显示,在200~700 nm,当配合物浓度减小,紫外吸收强度降低,且最大吸收峰有蓝移现象。图4显示波长308 nm处为配合物的最大吸收峰,261 nm处为对氯苯甲酸的最大吸收峰,251 nm处为三水硝酸铜的最大吸收峰。从图中可以看出,配合物的最大吸收峰出现在不同于原料的位置,可以推断合成了新物质。
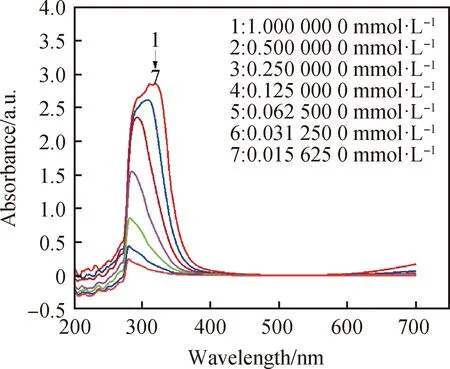
图3 不同浓度配合物的紫外可见吸收图Fig.3 UV-Vis absorption spectra of complexes with different concentrations
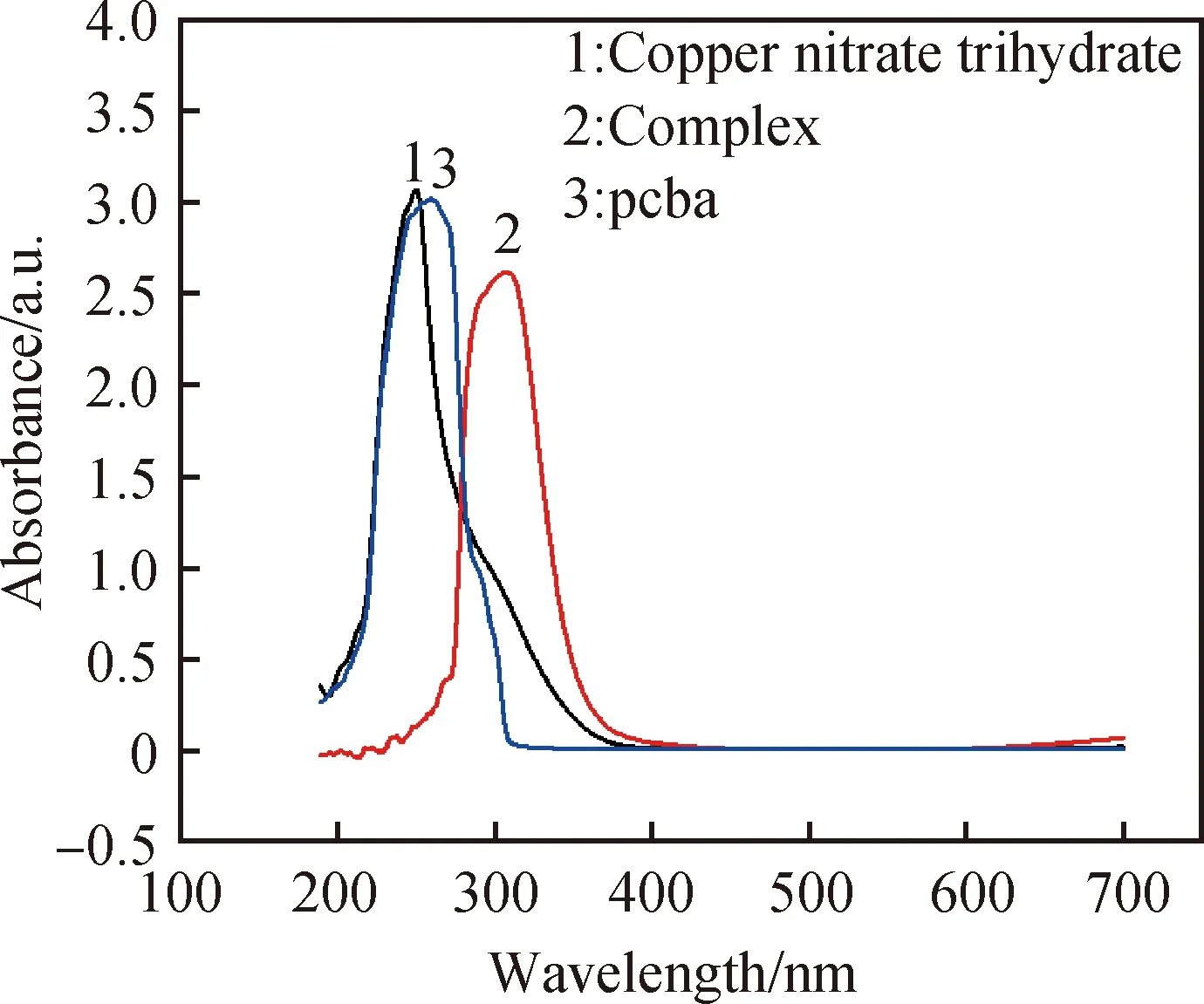
图4 原料与配合物的紫外可见吸收图Fig.4 UV-Vis absorption spectra of raw material and complex
2.2.2 荧光光谱分析
从图5可以看出,配合物的最大吸收峰出现在波长266 nm处,三水合硝酸铜最大吸收峰在波长290 nm处,对氯苯甲酸最大吸收峰出现在波长294 nm处。配合物跟原料的最大吸收峰波长所处位置及峰型不同,进一步说明合成了新物质。从图6中可以看出,配合物浓度越小,在最大吸收峰处的荧光强度越大。
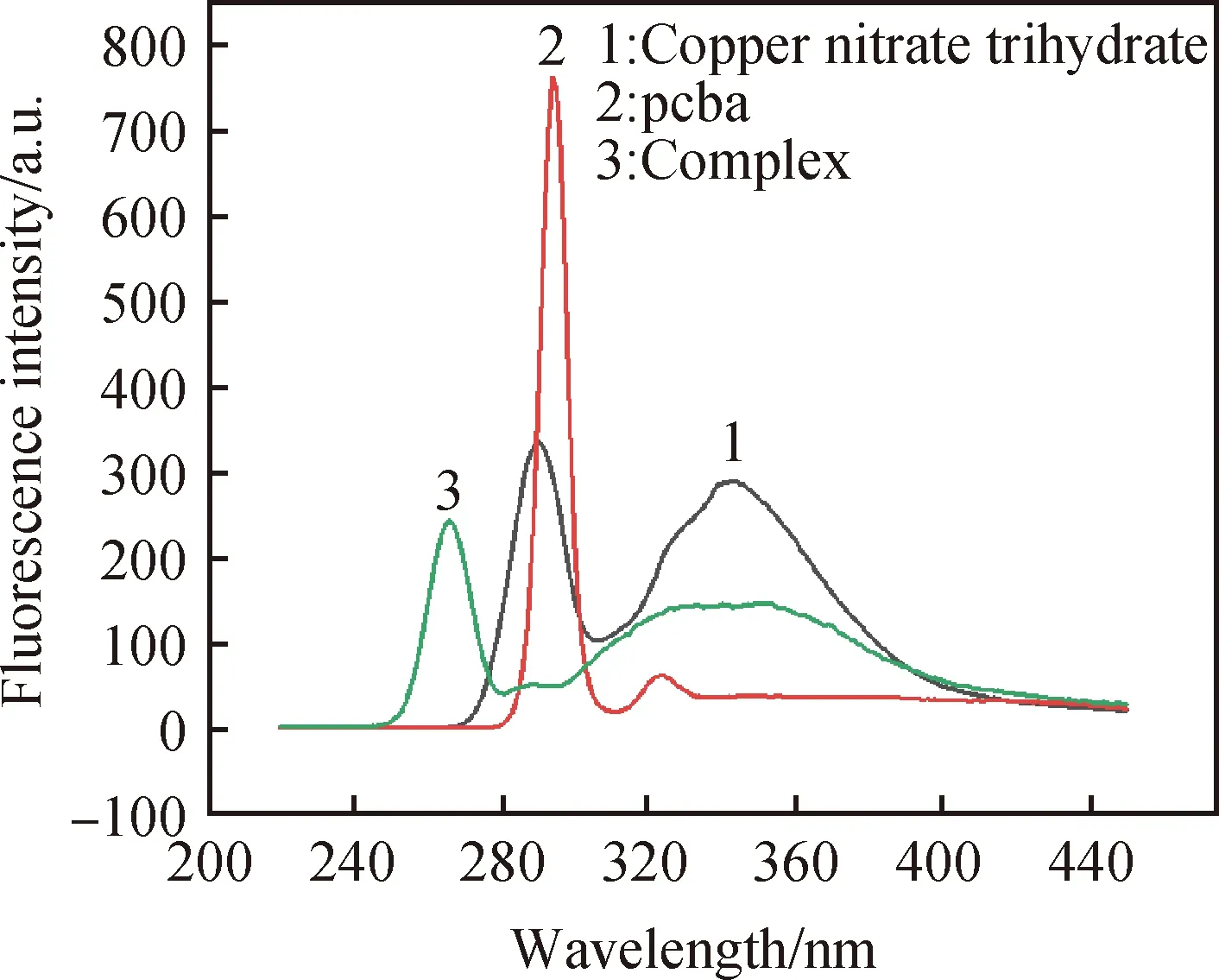
图5 原料与配合物的荧光图Fig.5 Fluorescence spectra of raw material and complex
2.3 配合物对HSA的互相作用
2.3.1 紫外光谱分析
HSA含有α-螺旋和无规则卷曲,会产生紫外吸收。α-螺旋发生变化与酪氨酸残基、色氨酸残基和苯并氨酸残基中的共轭双键发生π-π*跃迁,使金属配合物与HSA作用后紫外光谱发生峰位移动、强度变化等,可以根据该现象来判断配合物是否与HSA发生相互作用[18]。由图7可知,强吸收峰出现在267 nm处,当配合物的浓度增大时,紫外吸收强度降低,由此可见,配合物与HSA发生了相互作用。

图7 不同浓度配合物与HSA作用的紫外可见吸收图Fig.7 UV-Vis absorption spectra of the interaction between the complex with different concentrations and HSA
2.3.2 荧光光谱分析
HSA的荧光性源于色氨酸、酪氨酸和苯丙氨酸残基,当激发波长为 295 nm 时,HSA 的荧光全部来源于色氨酸残基[19]。由图8可以看到,HSA在强吸收峰326 nm处。吸收强度随着配合物浓度增大而降低。如图9所示,在不同的r值下,初始荧光强度为90.64%,配合物加了400 μL后,体系中的荧光强度为60.03%,HSA的荧光强度减弱值为30.61%。根据公式(1)和(2)[20-21]:
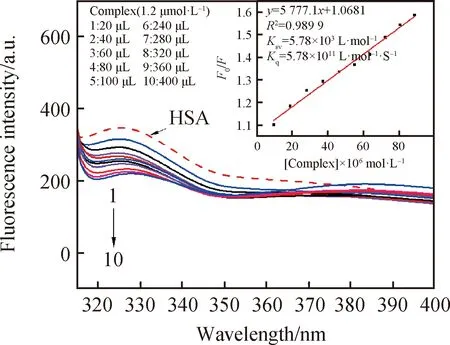
图8 不同浓度配合物与HSA作用的荧光图Fig.8 Fluorescence spectra of the interaction between the complex with different concntrations and HSA
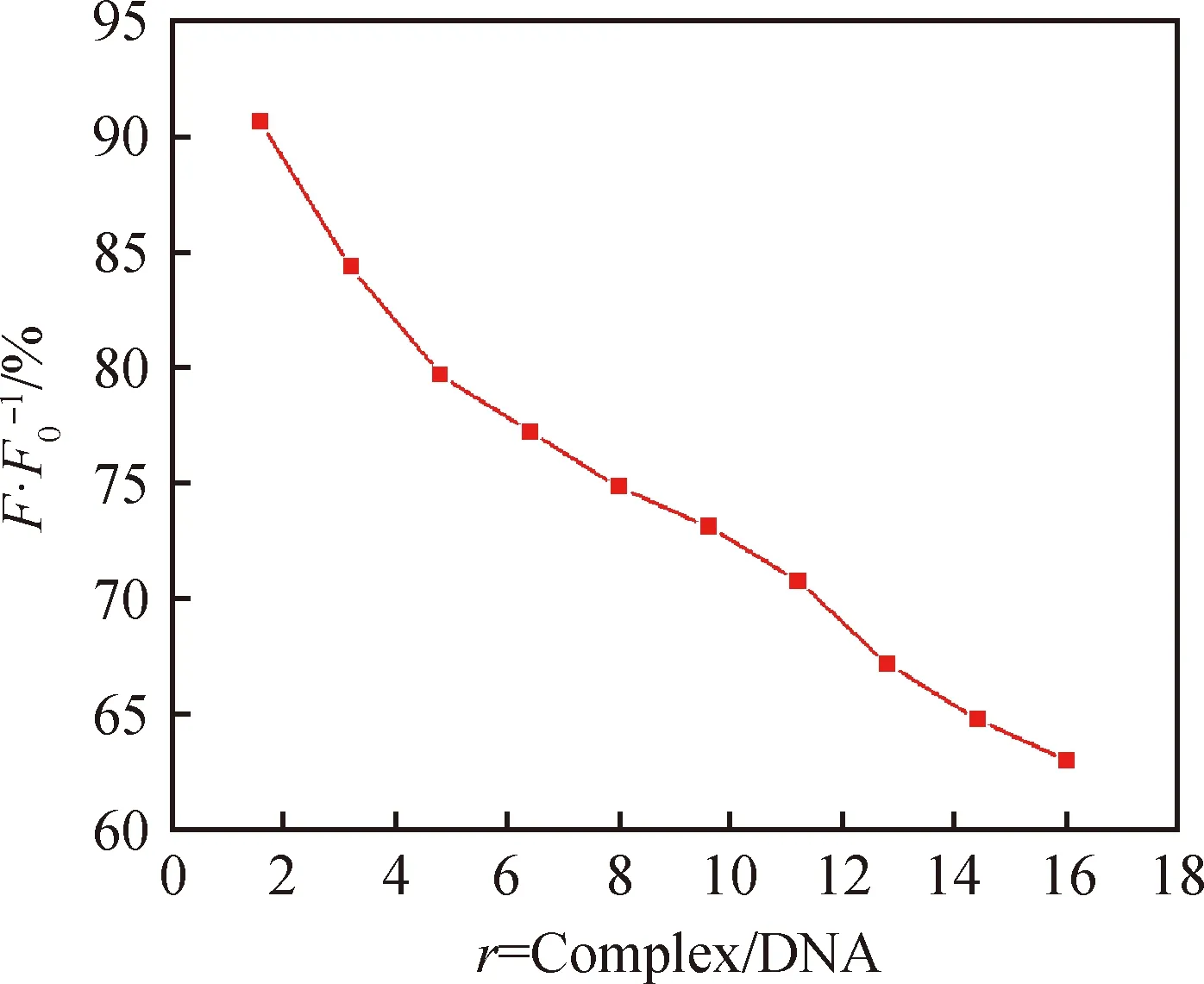
图9 (F/F0×100%)-r的关系图Fig.9 Relationship of (F/F0×100%) and r
F0/F=1+Kqτ0[C]=1+Ksv[C]
(1)
lg[(F0-F)/F]=lgKa+nlg[C]
(2)
式中:F0和F分别表示未加入和加入配合物时EB-CT-DNA体系的荧光强度,[C]表示配合物浓度,Ka是结合常数,n是结合位点数,τ0为猝灭剂不存在时荧光分子的平均寿命,猝灭常数Ksv=5.78×103L·mol-1,猝灭速率常数Kq=Ksv×108=5.78×1011L·mol-1·s-1,Kq>2×1010L·mol-1·s-1,可知配合物能够静态猝灭HSA荧光的荧光强度。如图8所示,得出配合物和HSA的结合常数Ka=1.38×102L·mol-1,结合位点数n=0.592。
2.4 CCK-8实验
配合物{[Cu(pcba)2]2·(MeOH)2}对A549、Hela、HepG2和LO2细胞作用48 h后细胞的半抑制浓度(IC50)值见表3。从表中可以看出,配合物对4种细胞都具有抗增殖作用,相同条件下,{[Cu(pcba)2]2·(MeOH)2}对3种癌细胞的抗增殖效果远远大于配体pcba,抗癌效果跟顺铂相当,对人正常肝细胞LO2细胞毒性比顺铂小,对Hela、A549、HepG2的细胞抑制毒性效果比文献报道的同类铜配合物好[19]。{[Cu(pcba)2]2·(MeOH)2}对4种细胞的毒性作用顺序为Hela>A549>HepG2>LO2。
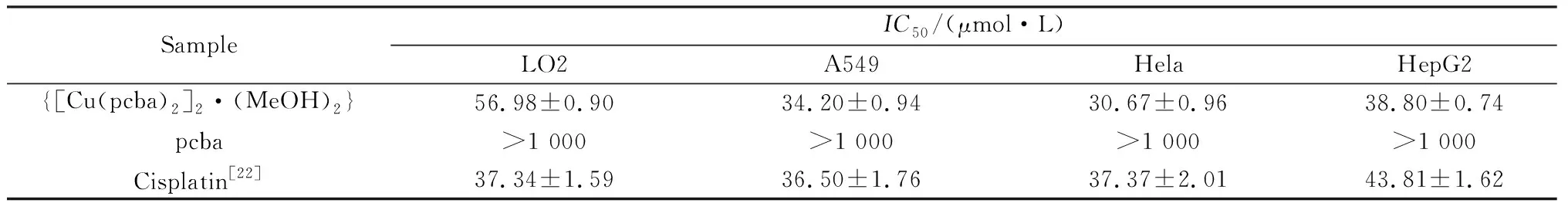
表3 配合物的对LO2、HepG2、Hela和A549细胞的IC50Table 3 IC50 of complex against LO2, HepG2, Hela, and A549 cells
3 结 论