乳酸乳球菌生产2'-岩藻糖基乳糖的途径构建及发酵培养基优化
2023-10-25程亚楠张文聪周圆孙雪李玉李庆刚
程亚楠 张文聪 周圆 孙雪 李玉 李庆刚
(1.天津科技大学生物工程学院,天津 300457;2.天津财经大学珠江学院,天津 301811)
人乳寡糖(human milk oligosaccharides, HMOs)是一类不可被人体直接吸收利用,但可被人体肠道中的有益菌群分解利用的复杂碳水化合物,是母乳中含量仅次于乳糖和脂肪的第三大成分,目前已被鉴定的就有200多种,是保护新生儿身体健康的重要组成成分[1-2]。其可作为益生元,刺激双歧杆菌(Bifidobacterium)和乳杆菌(Lactobacillus)等有益菌群的生成[3],作为配体类似物预防病原体黏附肠道[4],也可作为免疫调节因子,减轻免疫相关炎症的反应,提高婴儿肠道免疫功能[5]。同时,HMOs在大脑发育、神经元传递和突触的形成中具有重要作用[6-7]。2′-岩藻糖基乳糖(2′-fucosyllactose, 2′-FL)在HMOs中含量占比最高,可达31%[8],同时也是结构最为简单的寡糖,而且具有HMOs的大部分功能,所以探索2′-FL如何安全高效合成,对促进2′-FL的产业化具有重要意义。
2′-FL的合成方法主要有3种,化学法、酶法和微生物全细胞合成法。其中微生物全细胞合成法具有条件温和、成本低廉等特点,是最常用的2′-FL合成方法[9-10]。2′-FL的微生物合成过程如图1所示,其中GDP-岩藻糖的从头合成途径,以胞内果糖-6-磷酸为前体,通过甘露糖-1-磷酸异构酶ManA、磷酸甘露糖变位酶ManB、甘露糖-1-磷酸鸟苷酰转移酶ManC、GDP-甘露糖4,6-脱水酶Gmd,以及GDP-4-酮-6-脱氧甘露糖3,5-变旋酶/4-还原酶WcaG来合成GDP-岩藻糖[11]。补救合成途径则以L-岩藻糖为合成起始物质,通过双功能酶L-岩藻糖激酶/GDP-岩藻糖焦磷酸化酶Fkp来合成GDP-岩藻糖[12-13]。GDP-岩藻糖和乳糖在α-1,2-岩藻糖基转移酶的作用下,生成2′-FL。目前2′-FL生产研究大多在大肠杆菌(Escherichia coli)中,但大肠杆菌并不适合直接在食品中应用,因此其他食品安全级微生物,如酿酒酵母(Saccharomyces cerevisiae)、谷氨酸棒杆菌(Corynebacterium glutamicum)等也已被证实可用于生产2′-FL。在酵母细胞中通过对外源基因gmd、wcaG、fkp共表达,可以得到相对丰富的GDP-岩藻糖[14-16],进一步过表达岩藻糖基转移酶fucT2和乳糖转运蛋白lac12,2′-FL产量达到0.5 g/L左右[17-18]。谷氨酸棒杆菌具有将甘露糖转化为GDP-甘露糖的manB和manC基因,共表达manB、manC、gmd和wcaG,可有效合成GDP-岩藻糖[19],在此基础上表达岩藻糖基转移酶基因fucT2和乳糖透过酶基因lacY,以葡萄糖和乳糖为底物,2′-FL产量达到0.246 g/L[20]。而本研究中所选用的乳酸乳球菌是一种可直接应用于乳制品中的食品安全级微生物[21-22],目前还没有用于合成2′-FL的报道,但有报道证明,通过对乳酸乳球菌进行改造,可用于表达酶类和活性蛋白等[23-24]。
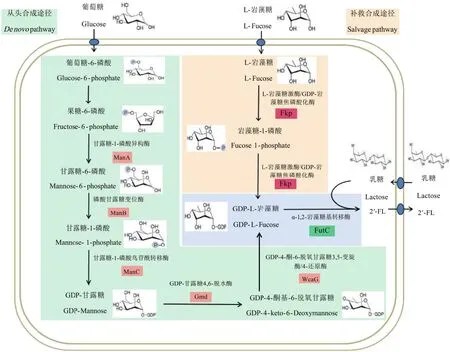
图1 2′-FL的从头合成途径和补救合成途径Fig.1 De novo and salvage synthesis pathways of 2′-FL
本研究在乳酸乳球菌原有的代谢途径基础上,将2′-FL合成途径中所需的异源微生物的相关基因,以在质粒或基因组上表达的方式转入选取的乳酸乳球菌宿主中,构建从头合成途径,进一步优化发酵培养基,实现以葡萄糖和乳糖为底物的2′-FL有效合成,为2′-FL的生物制备提供了新策略,具有重要的科研价值和研究意义。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒信息以及引物序列 本研究中所用菌株、质粒和引物信息见表1。
1.1.2 主要试剂 实验中用到的主要试剂包括PCR产物纯化试剂盒购自北京全式金生物技术有限公司,质粒提取试剂和琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司,一步法无缝克隆试剂盒(ClonExpress® CE II)购自南京诺唯赞生物科技公司,PCR扩增使用的phusion DNA polymerase购自Thermo Fisher Scientific公司,酵母粉购自英国Oxoid公司,氨苄青霉素、3-(N-吗啉)丙磺酸(MOPS)、Nisin乳链菌肽购自Sigma公司;其他试剂均为国产或进口分析纯。
1.1.3 仪器与设备 实验中用到的主要仪器设备包括PCR扩增仪(Applied Biosystems),DNA凝胶电泳槽(Baygene),高速冷冻离心机(Sigma),高效液相色谱仪(安捷伦科技有限公司),Bio电击转化仪(美国BTX公司),超声波细胞破碎机(加拿大爱威斯汀),分光光度计(北京普析通用仪器有限责任公司)。
1.1.4 培养基 LB培养基成分(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0。发酵培养基成分(g/L):磷酸氢二钠10.0,硫酸镁1.4,氯化钠4.0,无水乙酸钠1.5,酵母粉5.0,胰蛋白胨10.0,抗坏血酸0.5,MOPS 40.0,金属溶液10.0 mL/L,pH 7.0;利用补救途径合成2′-FL时,添加10.0 g/L的岩藻糖和5.0 g/L的乳糖;从头合成途径时,添加20.0 g/L葡萄糖和5.0 g/L的乳糖。如菌株携带诱导型启动子Pnis时,则在培养基中加入终浓度为0.04 μg/mL的Nisin诱导剂。金属溶液成分(g/L):硫酸亚铁10.0,硫酸锌2.2,硫酸铜1.0,硫酸锰0.38,四硼酸钠0.02,七钼酸铵0.1,氯化钙2.0。
1.2 方法
1.2.1 质粒构建 以质粒pNZ8148-1为模板,用引物48-F/R扩增出pNZ8148-1载体片段;以质粒pNZ-fkp、pET-futC为模板,用引物fkp-F1/R1、futC-F1/R1分别扩增出fkp、futC片段;以L.lactis NZ3900基因组为模板,用引物lacF-F/R扩增出lacF片段。利用重叠PCR技术扩增出片段fkp-futC-lacF。利用无缝克隆技术连接片段pNZ8148-1、fkp-futC-lacF,转化到E.coli JM109中,然后对转化子进行PCR验证,并挑取阳性转化子进行测序,构建成功的质粒命名为pNZ8148-2f(图2-A)。其中基因fkp来自Bacteroides fragilis,基因futC来自Helicobocton pyloni,基因lacF来自L.lactis。

图2 2′-FL从头合成途径所需质粒的构建流程Fig.2 Construction of plasmids required for the de novo synthesis of 2′-FL
以质粒pNZ8148-2f为模板,用引物pz-F/R扩增出线性片段pNZ8148-futC-lacF;以E.coli MG1655基因组为模板,用引物manC-F/R扩增出manC片段。利用无缝克隆技术连接片段pNZ8148-futC-lacF、manC,转化到E.coli JM109中,然后对转化子进行PCR验证,并挑取阳性转化子进行测序,构建成功的质粒命名为pNZ8148-CfF1(图2-A)。再以质粒pNZ8148-CfF1为模板,利用引物FP-F1/R1扩增出线性片段pNZ8148-manC-futC-lacF;以质粒pNZ5319为模板,用引物P32-F3/R3扩增出启动子P32片段。利用无缝克隆技术连接片段pNZ8148-manC-futC-lacF、P32,转化到E.coli JM109中,然后对转化子进行PCR验证,并挑取阳性转化子进行测序,构建成功的质粒命名为pNZ8148-CfF2(图2-A)。
以质粒pNZ5319为模板,用引物5319-F/R、P32-F1/R1、P32-F2/R2扩增出pNZ5319载体片段、启动子P32-1(含连接基因up、manB的同源臂)、P32-2(含连接基因manA、gmd的同源臂)片段;以L.lactis NZ9000基因组为模板,用引物up-F/R、down-F/R,扩增出同源重组所需的基因upp上游同源臂片段(up)和下游同源臂片段(down);以E.coli MG1655基因组为模板,用引物manB-F/R、manA-F/R、manA-F/R1、gmd-F/R、wcaG-F/R分别扩增出manB、manA-1(不含同源臂)、manA-2(含连接基因gmd的同源臂)、gmd和wcaG片段;以质粒pNZ8148-1为模板,用引物Pnis-F1/R1、Pnis-F2/R2扩增出启动子Pnis-1(含连接基因manA、gmd的同源臂)、Pnis-2(含连接基因up、manB的同源臂)片段。利用重叠PCR技术分别扩增出片段pNZ5319-updown、P32-manB-manA-gmd-wcaG、Pnis-manB-manA-gmd-wcaG、P32-manB-manA、P32-gmd-wcaG、PnismanB-manA、Pnis-gmd-wcaG。利用无缝克隆技术连接片段pNZ5319-up-down、P32-manB-manA、Pnisgmd-wcaG,转化到E.coli JM109中,然后对转化子进行PCR验证,并挑取阳性转化子进行测序,构建成功的质粒命名为pNZ5319-UBAgwD1(图2-B)。
1.2.2 菌株构建 将质粒pNZ8148-2f分别转化到L.lactis NZ3900、L.lactis NZ9000中,得到菌株NZ3900(pNZ8148-2f)和NZ9000(pNZ8148-2f)。
将质粒pNZ5319-UBAgwD1转化到L.lactis NZ9000中,平板上长出的转化子即为理论上的单交换菌株。对单交换成功的菌株连续传代7次,排除质粒pNZ5319-UBAgwD1造成的假阳性。又以单交换突变株具有同源性极高的片段,具有遗传的不稳定性,可以自发进行第二次重组。筛选能够在5-氟尿嘧啶平板上生长而氯霉素平板上不生长的转化子,获得已成功完成双交换的菌株,命名为NZ9000 1。利用同样的重组技术可得带有up-Pnis-manB-manAP32-gmd-wcaG-down片段的菌株NZ9000 2、带有up-P32-manB-manA-gmd-wcaG-down片段的菌株NZ9000 3、带有up-Pnis-manB-manA-gmd-wcaG-down片段的菌株NZ9000 4。
将质粒pNZ8148-CfF1转化到NZ9000 1中,得到菌株NZ9000 5。利用同样的方法将菌株NZ9000 1、NZ9000 2、NZ9000 3、NZ9000 4和质粒pNZ8148-CfF1、pNZ8148-CfF2分别组合,共得到8株不同的菌株NZ9000 5、NZ9000 6、NZ9000 7、NZ9000 8、NZ9000 9、NZ9000 10、NZ9000 11、NZ9000 12[25-26]。
1.2.3 菌株培养 常规的菌株培养在LB培养基中进行。进行发酵培养时,取甘油保存菌株10 μL接入到5 mL的LB液体培养基中,过夜培养作为种子液,按2%的量接种到发酵培养基中。发酵培养使用250 mL三角瓶进行,装液量为30 mL,在振荡摇床中培养,培养温度为37℃,转速为220 r/min。如菌株携带表1所示含有氯霉素抗性的质粒,则培养基中加入终浓度为50 mg/L的氯霉素。利用分光光度计检测培养液OD600测试菌株的生长状况,利用高效液相色谱/蒸发光散射检测器(HPLC-ELSD)检测发酵液中2′-FL的产量。
1.2.4 培养基优化 以含胰蛋白胨10 g/L,酵母粉5 g/L,不含氯化高铁血红素的发酵培养基为基础,测定菌株生长和发酵生产2′-FL所需最适氯化高铁血红素的浓度,添加量分别为0.5、1.0、1.5、2.0、2.5、3.0 μg/mL,每组3个平行。
以含氯化高铁血红素2.5 μg/mL的发酵培养基为基础,组合优化胰蛋白胨和酵母粉的浓度对菌株生长和发酵产2′-FL的影响。如表2所示,共有16组不同的组合形式,每组3个平行。

表2 胰蛋白胨与酵母粉协同优化浓度组合Table 2 Co-optimized concentration combination of tryptone and yeast extract
1.2.5 使用HPLC检测发酵液中2′-FL浓度 取1 mL发酵液,利用超声波破碎细胞,将破碎细胞悬液置于沸水中10 min,13 000 r/min离心10 min,收集上清。向上清中加入三倍体积的乙腈,混匀后13 000 r/min离心10 min。吸取上清,用0.22 μmol/L的有机系滤膜过滤处理后利用HPLC-ELSD检测。所用的色谱柱为Carbohydrate ES 5 μm 250 mm × 4.6 mm,检测器为蒸发光检测器,流动相组成为:70%的乙腈(乙腈∶水,体积比),柱温为30℃,进样量为10 μL,流速为0.8 mL/min[27-28]。利用不同浓度的2′-FL标准品绘制峰面积对应浓度的标准曲线,计算样品中2′-FL的含量。
2 结果
2.1 2′-FL补救合成途径的构建与底盘菌株评价
L.lactis NZ9000中本身没有乳糖吸收和分解利用途径,不会利用作为2′-FL前体的乳糖,在构建2′-FL生产菌株时需要引入乳糖透过酶基因lacF。将片段fkp、futC、lacF与表达载体pNZ8148-1连接并转化到E.coli JM109后,用引物fkp-F1和lacF-R1进行PCR验证,如果构建不成功,则无条带产生,如果构建成功,条带大小约为4 000 bp。结果如图3-A所示,PCR条带约为4 000 bp,与片段fkp-futC-lacF理论大小一致,表明质粒pNZ8148-2f构建成功。

图3 验证菌株的菌落PCR电泳图Fig.3 Electrophoresis diagram of PCR product for strain validation
利用发酵培养基,添加10 g/L的岩藻糖和5 g/L的乳糖,测试NZ3900(pNZ8148-2f)和NZ9000(pNZ8148-2f)摇瓶发酵过程中的2′-FL生产和菌株生长状况。同时,为验证基因fkp、futC和lacF过表达,以及质粒pNZ8148-1本身对菌株生长的影响,同时测试了不含质粒的野生菌以及含有空载质粒的野生菌生长状况。2′-FL产量如图4-A所示。随着发酵时间的延长,产量逐渐提高,48 h产量达到最高,分别为0.16 g/L和0.40 g/L。菌株的生长曲线如图4-B, C所示,菌株NZ3900(pNZ8148-2f)和NZ9000(pNZ8148-2f)生长速率稍慢于分别对应的带有空载质粒的野生型菌株NZ3900(pNZ8148-1)和NZ9000(pNZ8148-1)。随着生长周期的延长,NZ9000(pNZ8148-2f)的培养液菌体浓度能够与其对照出发菌株持平,而NZ3900(pNZ8148-2f)则最终低于其对照菌株。综上,将L.lactis NZ9000用作2′-FL生产的底盘菌种。
2.2 利用NZ9000构建从头合成途径生产2'-FL
尿嘧啶磷酸核糖转移酶的编码基因upp是乳酸乳球菌中公认的非必须基因,是常用的基因插入位点。在敲除upp基因的同时将基因P32、manB、manA、Pnis、gmd、wcaG整合到L.lactis NZ9000细胞中。将片段up、P32、manB、manA、Pnis、gmd、wcaG、down与表达载体pNZ5319连接并转化到E.coli JM109后,用引物P32-F1和wcaG-R进行PCR验证,如果构建不成功,则无条带产生,如果构建成功,条带大小约为5 000 bp。结果如图3-B所示,PCR条带约为5 000 bp,与片段P32-manB-manAPnis-gmd-wcaG理论大小一致,表明质粒pNZ5319-UBAgwD1构建成功。同理可得质粒pNZ5319-UBAgwD2、pNZ5319-UBAgwD3、pNZ5319-UBAgwD4。
将质粒pNZ5319-UBAgwD1化转进L.lactis NZ9000中,用引物P32-F1和wcaG-R进行PCR验证,如果单交换不成功,则无条带产生,如果单交换成功,条带大小约为5 000 bp。结果如图3-C所示。条带约为5 000 bp,与片段P32-manB-manA-Pnis-gmd-wcaG理论大小一致,证明菌株已成功进行单交换。将单交换菌株连续7次传代,筛选能够在5-氟尿嘧啶平板上生长而氯霉素平板上不生长的转化子,用引物U-F和D-R进行PCR验证,如果双交换不成功,则条带大小约为3 000 bp,与原始菌株L.lactis NZ9000在该位点的基因up-upp-down大小一致,表明菌株恢复成野生型,如果双交换成功,条带大小约为7 000 bp。结果如图3-D所示,条带约为7 000 bp,与片段up-P32-manB-manA-Pnis-gmd-wcaG-down理论大小一致,说明已成功完成双交换,菌株NZ9000 1构建成功。同理可得菌株NZ9000 2、NZ9000 3、NZ9000 4。
将片段manC、futC、lacF与表达载体pNZ8148-1连接并转化到E.coli JM109后,用引物manC-F和lacF-R进行PCR验证,如果构建不成功,则无条带产生,如果构建成功,条带大小约为3 000 bp。结果如图3-E所示,PCR条带约为3 000 bp,与片段manC-futC-lacF理论大小一致,表明质粒pNZ8148-CfF1构建成功。同理可得质粒pNZ8148-CfF2。
利用发酵培养基,添加20 g/L的葡萄糖和5 g/L的乳糖,对菌株NZ9000 5、NZ9000 6、NZ9000 7、NZ9000 8、NZ9000 9、NZ9000 10、NZ9000 11、NZ9000 12进行摇瓶发酵,检测2′-FL生产和菌株生长状况,结果如图5所示。8株菌株的2′-FL最高产量具有明显的差异,NZ9000 6最多,产量约为0.28 g/L;NZ9000 8次之,为0.26 g/L;NZ9000 11最少,为0.09 g/L(图5-A)。结果证明成功打通了L.lactis NZ9000从头合成2′-FL的途径。途径酶表达水平的优化是构建生产菌株的重要步骤,该研究中,对途径酶进行了不同程度的表达,构建出8个不同的菌株,结果(图5-A)显示,通过双启动子以P32-manB-manA-Pnis-gmd-wcaG的方式在基因组上过表达相关基因,通过双启动子以Pnis-manC-P32-futC-lacF的方式在质粒上过表达相关基因,构建出的菌株NZ9000 6,最有利于高产2′-FL。为了分析途径表达水平对菌株生长的影响,利用菌株NZ9000、NZ9000(pNZ8148-1)为对照,比较了产量最高的菌株NZ9000 6和产量最低菌株NZ9000 11的生长曲线。两者的生长速率和稳定期的生物量差别很小,但是均明显低于原始菌株,说明2′-FL合成途径的强化一定程度上影响了菌体生长(图5-B)。

图5 带有从头合成途径菌株的2′-FL产量和生长曲线Fig.5 Productions and growth curves of different strains with 2′-FL de novo synthesis pathway
2.3 发酵培养基优化
2.3.1 添加氯化高铁血红素提高菌株生产性能 乳酸菌呼吸链不完整,TCA循环途径受限,氯化高铁血红素能够帮助L.lactis形成完整的呼吸链,来提高菌株的性能,但是L.lactis本身不具有氯化高铁血红素合成能力。该研究中,为了提高最优菌株NZ9000 6的水平,向发酵培养基中添加终浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 μg/mL的氯化高铁血红素,测试了菌株生产和生长状况。结果如图6所示,随着氯化高铁血红素浓度从0-2.5 μg/mL逐渐升高,菌株生长10 h后的OD600无明显变化,2′-FL产量明显逐渐增加,浓度为2.5 μg/mL时产量最高,为0.66 g/L。综合来看,浓度为2.5 μg/mL的氯化高铁血红素最适合菌株生长和发酵产2′-FL。

图6 氯化高铁血红素浓度对菌株生长和2′-FL生产的影响Fig.6 Effects of hemin chloride concentration on cell growth and 2′-FL production
2.3.2 胰蛋白胨和酵母粉浓度协同优化提高菌株生产性能 由于L.lactis天然的代谢缺陷,其对营养要求较高。该研究中考察了胰蛋白胨和酵母粉浓度对菌株NZ9000 6生长和生产2′-FL的协同影响。在含有2.5 μg/mL氯化高铁血红素的发酵培养基基础上,测试不同胰蛋白胨和酵母粉浓度组合(表2)的影响。胰蛋白胨浓度为15 g/L时,2′-FL的产量总体处在较高水平,其中,酵母粉浓度为6 g/L时,2′-FL的产量最高,为1.58 g/L,菌株生长也处于最高水平,菌株生长10 h后OD600为10.06。因此,选择发酵培养基中胰蛋白胨为15 g/L,酵母粉为6 g/L用于菌株NZ9000 6生长和生产2′-FL(图7)。

图7 胰蛋白胨和酵母粉浓度对菌株生长和2′-FL生产的影响Fig.7 Effects of tryptone and yeast extract concentration on cell growth and 2′-FL production
3 讨论
3.1 L.lactis NZ9000菌株是2'-FL生产的优势宿主
2′-FL是一种含量最丰富的人乳寡糖,在婴幼儿成长发育过程中起着至关重要的作用。L.lactis作为可直接用于乳制品的食品级微生物,同时也是一种重要的工业底盘菌种。构建生产人乳寡糖的L.lactis菌株具有重要意义,目前还没有相关报道。出发菌株的特性对生产水平具有较大影响,本研究在常用的乳酸乳球菌底盘NZ3900和NZ9000中,利用含有fkp、futC和lacF基因的重组质粒,构建2′-FL补救合成途径,2′-FL的产量分别为0.16 g/L和0.40 g/L,从而证实了L.lactis可用于生产2′-FL,结合菌株自身性状和生长代谢分析,认为NZ9000更适合作为2′-FL生产的底盘菌。
3.2 优化途径关键酶的表达对提高2'-FL生产具有重要作用
补救合成途径需要昂贵的岩藻糖作为底物,利用从头途径合成2′-FL是实现其规模化工业生产的必然。以NZ9000为底盘,构建了2′-FL的从头合成途径,其中涉及到大量基因,而基因的表达优化是构建菌株,提高产量的重要方法。根据分析,L.lactis中缺乏合成2′-FL的途径,而E.coli作为获取方便、途径明确的常用菌株,具有2′-FL相对完整的基因,H.pylori中futC表达活性相对较高,因此为保证基因的高效稳定表达,将E.coli来源的manA、manB、gmd和wcaG基因整合到L.lactis NZ9000染色体的upp位点上进行表达[29-31],将manC和futC基因,以及为futC提供胞内底物的乳糖透过酶lacF基因通过质粒表达[32]。另外,manC和futC分别为途径中固定GDP和释放GDP分子的酶,分析其用质粒高表达可能能够提高途径的效率。本研究利用不同的启动子对途径酶的表达水平进行调控,经过48 h发酵后,2′-FL的产量出现了明显的差异,最优菌株NZ9000 6的2′-FL摇瓶产量为0.28 g/L,是最低产量菌株的3.11倍,结果证明途径调控对于菌株产量影响较大,NZ9000 6的2′-FL从头合成途径得到了较好的优化。改造后菌株NZ9000 6、NZ9000 11在生长速率和稳定期的生物量方面明显低于野生菌株NZ9000、NZ9000(pNZ8148-1),可能是因为2′-FL合成途径的强化对菌体自身的代谢造成负担,影响菌体生长。
3.3 发酵培养基添加血红素有利于2'-FL生产
乳酸菌属于兼性厌氧微生物,缺失部分呼吸链,无法解除氧气对菌株的毒害作用,也不能形成完整的三羧酸循环,可能限制菌株作为工业菌株的生产水平[33]。付龙云[34]通过在乳酸乳球菌中添加氯化高铁血红素,使细胞具有了完整的呼吸链,提高了细胞的生存能力。本研究进一步优化了培养基中氯化高铁血红素浓度,并协同优化了胰蛋白胨和酵母粉浓度。添加2.5 μg/mL的氯化高铁血红素后,菌株生长有明显的改善,2′-FL产量明显提升,达到0.66 g/L。在此基础上,优化获得了最佳的胰蛋白胨浓度15 g/L、酵母粉浓度6 g/L,菌株NZ9000 6生长和生产进一步改善。以往的研究中,利用大肠杆菌、枯草芽孢杆菌(Bacillus subtilis)等作为底盘,通过2′-FL途径过表达,利用适合底盘的发酵培养基,2′-FL摇瓶发酵水平一般为0.50-1.00 g/L[17-18,35]。本研究中,通过途径优化和培养基优化,NZ9000 6的2′-FL摇瓶发酵产量达到1.58 g/L。未来,通过基因工程改造底盘的代谢缺陷,并进一步敲除2′-FL支路途径、提高底盘和2′-FL途径的适配性等,有可能进一步提高菌种的生产水平。
4 结论
本研究筛选出更适合2′-FL生产的L.lactis NZ9000。通过优化表达manA、manB、gmd、wcaG、manC、futC和lacF,在L.lactis NZ9000中构建了从头合成途径,实现了2′-FL的积累;优化发酵培养基中氯化高铁血红素浓度、协同优化胰蛋白胨和酵母粉浓度,进一步提高了2′-FL的产量,为实现2′-FL在可直接用于乳制品的食品级微生物乳酸乳球菌中的工业化生产奠定基础。
