重庆小南海表层沉积物磷形态分布特征及影响因素*
2023-10-24伍诗宇何立平许文峰段晨辉刘正学
杨 巧 伍诗宇 何立平 许文峰 段晨辉 刘正学 张 严 兰 波
(重庆三峡学院环境与化学工程学院,重庆 404100)
磷作为水生生态系统中的重要营养物质,能显著提高水体初级生产力,常被认为是引起水体富营养化的重要限制因子[1]。含磷污水排放汇入湖泊后,进入生物地球化学循环并以多种形态赋存于水体和沉积物中,其中以沉积物为主要储存载体[2],因此沉积物可有效反映湖泊磷污染程度。湖泊水体通过水体-沉积物的交互作用介导沉积物磷的内源性释放,成为引起水体富营养化的重要原因甚至主要原因[3]。
水体-沉积物的磷循环过程复杂,涉及磷形态组成及含量变化[4]。磷形态含量可反映湖泊污染源、污染状况及生态风险等信息,因此了解湖泊沉积物磷形态特征对治理湖泊污染具有指导意义[5]11。沉积物的磷来源于生物转化或者与铝、铁、钙等金属氢氧化物及氧化物结合的共沉降[6]。沉积物中的磷包括无机磷(IP)、有机磷(OP)[7]72,其中IP可进一步分为铁铝结合态磷(Fe/Al-P)、钙结合态磷(Ca-P)。在富含有机质与黏土的湖泊河流中,沉积物OP易被微生物矿化,重新被生物转化吸收而进入生物相[8]。Fe/Al-P被铁铝氧化物和氢氧化物表面吸附或裹挟而沉积,易受pH和氧化还原电位影响而释放至水体中[9]。Ca-P是沉积物中通过生物作用沉积和固结成的颗粒磷[10]。不同磷形态彼此间可相互转化,其影响因素包括生物作用、金属含量、pH、水深、粒度、水力搅动等[7]72。这些因素通过改变微环境的酸碱度、颗粒表面吸附力等作用而改变磷与离子的结合能力,促进/抑制沉积物中的磷释放进入水体[11]。
综上,了解湖泊沉积物中磷赋存形态的分布及其调控因素有助于加深理解磷循环过程,对治理湖泊污染提供依据。目前的相关研究大多集中于人类活动干扰强烈的受污染水体环境,而鲜有针对未受或轻微受到人类活动影响的水体沉积物研究,因此对于自然条件下磷赋存形态转化过程的认知仍存不足。本研究以重庆黔江饮用水源地的小南海表层沉积物为研究对象,探究磷形态的空间分布特征及其与沉积物物理化学指标的耦合关系,以期为洁净水体的生态环境保护提供理论依据。
1 材料和方法
1.1 研究区概况
小南海(108°42′E~108°45′E、29°38′N~29°39′N)海拔约370 m,在重庆黔江区境内,距离黔江城区以北32 km处,面积约2.87 km2,总库容为7 087万m3,是1856年地震形成的高山淡水堰塞湖泊[12]。2001年,小南海被国家地震局批准为“国家地震遗址保护区和全国防震减灾科普宣传教育基地”,2009年被水利部列为国家水利风景区和国家湿地公园[5]12。小南海远离城区且农业面源污染较小,其水质状况良好[13]。但在2017年以前,小南海大力发展旅游业,一定程度影响了作为饮用水源地的小南海生境。2018年当地政府关闭小南海景区并采取了一系列整改措施,流域生态环境随后改善并恢复。
1.2 野外采样
2021年6月,于重庆黔江小南海水域布设28个采样点,利用彼得森采泥器采集表层沉积物并依次编号(其中6号采样点无沉积物)以充分了解整个湖区的磷形态分布情况,样点分布如图1所示。现场测定水深等参数,样品采集后密封收集于洁净聚乙烯封口袋内,置于放有冰袋的保温箱中带回实验室冻干,去除植物体残渣和大颗粒石粒等杂质,保存备用。

图1 小南海采样位点
1.3 室内分析测试
1.3.1 沉积物物理化学性质
沉积物加双蒸水浸提,水土比为2.5∶1.0(质量比)测定pH[14]。电导率用双蒸水浸提(水土比5∶1)后测定[15]。粒径采用Mastersize 2000激光粒度仪分析,粒度按照黏土(<2 μm)、粉砂(2~63 μm)和砂(>63 μm)进行分类[16]。表层沉积物Al、Fe、Ca经微波消解后采用电感耦合等离子体发射光谱仪测定,即称取0.25~0.50 g样品,加入硝酸、盐酸、氢氟酸混合酸混匀,微波消解后赶酸,定容后上机测试[17]。
1.3.2 沉积物磷形态分级
沉积物磷形态采用欧洲标准测试委员会制定的SMT连续提取法分级提取,该方法将磷形态分为5种(总磷(TP)、OP、IP、Fe/Al-P、Ca-P)[18],其中TP包含OP、IP及残渣态磷,IP包含Fe/Al-P、Ca-P及部分残渣态磷。各磷形态分级提取后用钼蓝分光光度法[19]测定磷含量。每个指标均进行了3次平行提取与测定。采用样品加标回收法进行质量控制,回收率为95%~105%。
TP的测定:称取0.25 g样品平铺于镍坩埚底部,滴加酒精至土样润湿,加2 g NaOH平铺并将样品覆盖,加盖后放入马弗炉,升温至400 ℃,保持15 min,继续升温至640 ℃,保持15 min,取出冷却。向坩埚中加入10 mL水加热至80 ℃,待熔块溶解后,将溶液全部转入离心管并用3 mol/L硫酸洗涤,离心取上清液定容至100 mL后测定。
OP和IP的测定:称取0.20 g样品,加20 mL 1.0 mol/L盐酸浸提16 h,取浸提液测定IP;浸提残渣放入马弗炉中450 ℃下灰化1 h,加入20 mL 1.0 mol/L盐酸浸提16 h,取浸提液测定OP。
Fe/Al-P和Ca-P的测定:称取0.20 g样品,用20 mL 1 mol/L的NaOH浸提16 h,取10 mL浸提液用4 mL 3.5 mol/L盐酸浸提16 h,离心,取上清液测定Fe/Al-P;残渣用20 mL 1.0 mol/L的盐酸浸提16 h,离心后测定Ca-P。
1.4 统计分析
在Origin 2021中绘制小南海表层沉积物的金属、磷形态数据柱状图。表层沉积物各物理化学指标之间相关性采用Spearman秩相关分析法,在SPSS 22.0中进行相关性分析。沉积物磷形态与环境因子的耦合关系采用冗余分析(RDA)的排序方法分析,数据进行lg(x+1)(x为导入数据)转化以减少极端值及数据异质性的影响,剔除方差膨胀因子>20的变量以减少变量共线性[20-21],采用前选择筛选与排序轴呈显著相关的独立解释变量(P<0.05),其中显著性采用Monte Carlo置换检验(迭代499次)和Bonferroni事后检验,在Canoco 5软件中完成。将采样点位按照RDA结果分组,对各组的磷形态含量显著性差异采用单因素方差分析。
2 结果和分析
2.1 小南海表层沉积物物理化学性质
小南海表层沉积物物理化学指标统计结果见表1。小南海表层沉积物Fe(均值为33.34 g/kg)明显高于Al(均值为1.74 g/kg)和Ca(均值为1.41 g/kg)。表层沉积物pH呈中性至弱酸性。沉积物电导率波动较大。沉积物组分以粉砂为主,其次为黏土和砂。
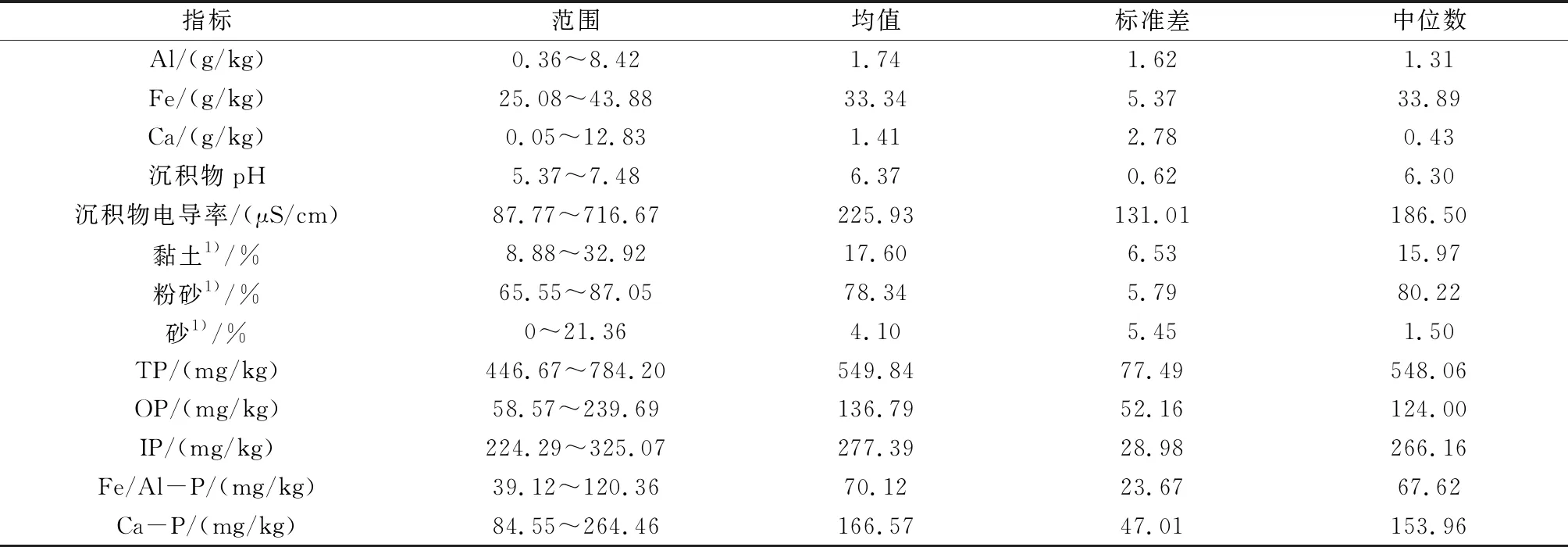
表1 小南海表层沉积物物理化学指标统计结果
小南海表层沉积物Fe、Al和Ca浓度变化(见图2)具有如下特征:(1)Fe含量明显高于Al和Ca,其中在位于小南海东北处的5~10号位点整体偏高,在靠近河口的21、23、25、28号位点偏低。(2)表层沉积物的Al浓度整体高于Ca,但在1、3、4、12、21、27号位点Ca高于Al。Al和Ca均在3号位点出现最大值,分别为8.42、12.83 g/kg。但Al的最低值出现在21号位点(0.36 g/kg),Ca的最低值出现在13、15号位点(均为0.05 g/kg),Al和Ca在18~22号位点的含量整体较低。

图2 小南海表层沉积物样品中Fe、Al和Ca质量浓度
2.2 小南海表层沉积物各形态磷特征
小南海表层沉积物TP在靠近河口的22~28号位点整体较低,在位于湖泊东北部的7、8、10、11号位点整体较高,其中最大值784.20 mg/kg出现在8号位点(见图3)。OP均低于IP,沉积物磷以IP为主。此外,OP与IP的差异在靠近河口的22~28号位点更大。Fe/Al-P均低于Ca-P(除11号位点外),表明沉积物的IP主要以Ca-P为主,且Ca-P与Fe/Al-P的差异在20~28号位点更明显。
3 讨 论
3.1 磷形态与理化因子的相关分析
OP、Fe/Al-P与TP均呈现显著正相关性(P<0.001,见表2),表明3者的空间分布特征相似。而IP与TP相关性较弱表明IP与TP的分布特征不一致。IP包含Ca-P和Fe/Al-P,其中Ca-P与IP显著正相关(P<0.05)而Fe/Al-P与IP无显著相关,这是由于Ca-P(均值为166.57 mg/kg)高于Fe/Al-P(均值为70.12 mg/kg),Ca-P是IP的主要存在形式。

表2 沉积物中磷形态与物理化学指标的相关性分析1)
3.2 黏土和水深对磷形态的影响
由于剔除了具有共线性及与排序轴非显著相关的环境因子(P>0.05),由此得出的RDA排序图(见图4)仅显示具独立解释性的显著环境变量,即黏土、水深、砂(空心箭头)。箭头长度越长,与RDA排序轴的夹角越小,则与轴的相关性越高[25]。同样,磷形态(实心箭头)与排序轴和环境变量的关系解读类似。
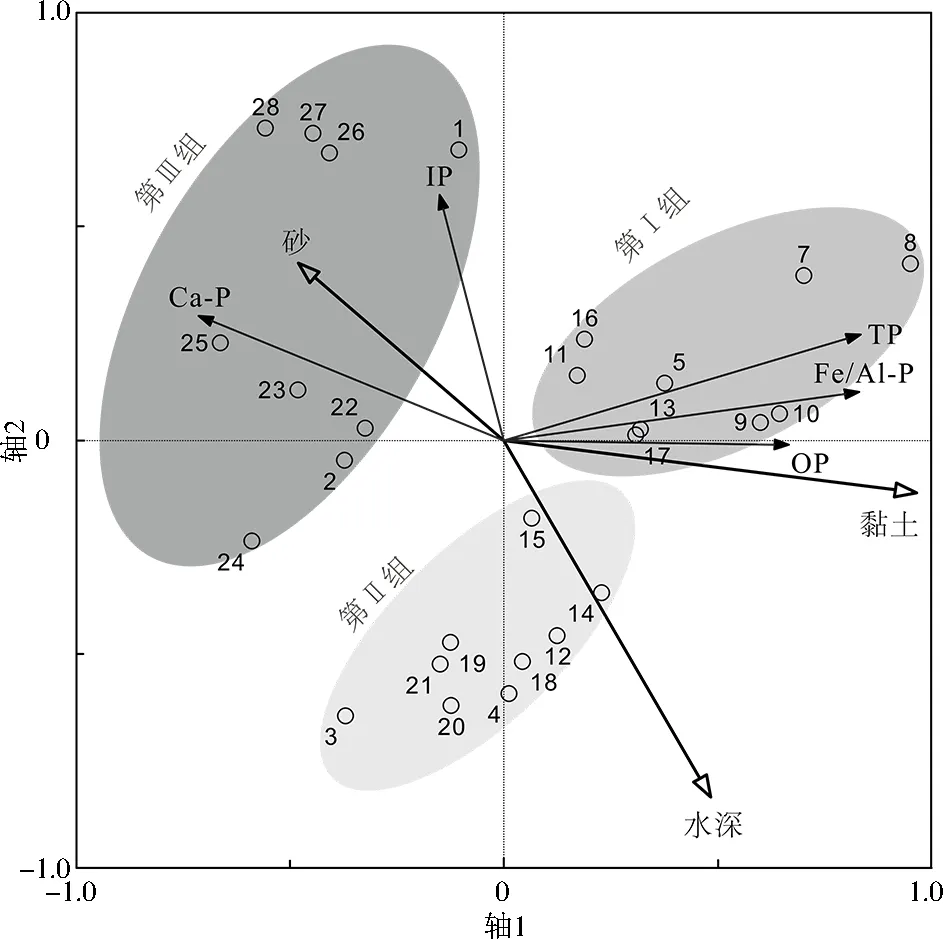
图4 沉积物中磷形态与物理化学指标的RDA
RDA表明,轴1和轴2的解释度分别为69.3%、22.0%,前两轴的累计解释度为91.3%,说明所选的理化性质能充分解释磷形态的变化数据。筛选得到的独立解释变量中,黏土、水深、砂对RDA的解释量依次为44.3%(P=0.001)、10.6%(P=0.001)、4.8%(P=0.043)。Bonferroni事后检验表明,黏土和水深作为解释变量的准确性和可靠性较高(多重假设检验矫正后P(Padj)<0.01),而砂的显著性仍存在不确定性(Padj>0.05)。综上,黏土、水深分别是影响RDA轴1、轴2的重要环境因子。
研究表明,沉积物粒径越小,比表面积越大,吸附能力越强[26],因此黏土对多种磷形态具较强的富集作用[27]。随着粒径的增加,沉积物对磷的吸附能力减弱[22]2620。黏土与沉积物电导率、Fe含量存在显著相关关系(P<0.001),因为黏土的强吸附作用导致更多的金属离子进入沉积物,尤其是Fe[28],导致电导率增加。因此,黏土和电导率对磷形态分异的影响表现出高度的协同性。此外,黏土吸附的磷酸盐被铁(氢氧化物)裹挟沉淀[29],导致黏土、Fe和Fe/Al-P彼此间呈显著正相关性(P<0.001)。
水深作为重要的湖泊形态参数,对沉积环境的影响是多方面的,既影响沉积微环境而引起内源磷的释放,又影响水动力、物质输移与沉降等过程影响外源性磷的输入。一般而言,随着水深增加,水-沉积物界面的氧化还原电位降低,Fe3+易转化为Fe2+,从沉积物进入上覆水体[30]。水深与沉积物Fe含量理论上应负相关。而本研究中Fe与水深呈显著正相关性(P<0.05),考虑到小南海是国家湿地公园、饮用水源地,根据湖泊周边的卫星影像,大致断定小南海受到人为活动干扰程度较轻,由此可推定沉积物磷形态及Fe含量受人类活动影响小,更可能是自然输入引起的。物质的自然输入受湖水水深的影响,表现为随水深和距河口距离增加,水动力减弱,砂优先沉降使深水处黏土占比增加。IP、Ca-P随粉砂和砂在入湖口沉降,与水深呈显著负相关性(P<0.05)。而Fe吸附于黏土表层,与水深显著正相关(P<0.05)。综上,水深通过影响颗粒和Fe的输移而影响磷形态空间分布。
3.3 不同沉积环境的磷形态组成
根据图4,采样点受粒度和水深的独立影响而在轴1、轴2上呈现明显的空间聚落特征,大致分为3组:第Ⅰ组样点(包括5、7、8、9、10、11、13、16、17号位点)受黏土的影响较大,为远离河口的中等水深环境;第Ⅱ组(包括3、4、12、14、15、18、19、20、21号位点)为湖心的深水环境;第Ⅲ组(其他位点)受砂影响较大,为近河口的浅水环境。3组的黏土和水深存在显著差异(P<0.01),代表3种不同沉积环境的特定指标差异明显。3组间的磷形态亦存在明显差异,具体表现在:第Ⅰ、Ⅱ、Ⅲ组的TP、OP、Fe/Al-P均依次下降(见表3),呈随离河口的距离增加而含量增加的特征,第Ⅰ组显著高于第Ⅱ、Ⅲ组,而第Ⅱ、Ⅲ组之间差异不显著;第Ⅰ、Ⅱ、Ⅲ组的IP、Ca-P整体增加,呈河口富集的特征,其中第Ⅰ、Ⅱ组和第Ⅲ组的IP差异显著,而Ca-P在湖泊不同区域均显著变化。各磷形态占比与其浓度变化趋势一致,其中变化最大的是Ca-P。第Ⅲ、Ⅱ、Ⅰ组的Ca-P占比依次为43.05%、31.82%、19.89%,即从河口浅水到远离河口处Ca-P衰减了23.16百分点。此外,第Ⅰ、Ⅱ组残渣磷占比较高,可能与高水深环境有关,生物活性低,磷的惰性组分含量高。综上,不同磷形态的空间差异表明,湖泊参数能明显影响磷形态变化,可能是引起沉积物磷变化的重要因素。

表3 基于RDA分组的统计信息
4 结 论
(1) 小南海表层沉积物TP为446.67~784.20 mg/kg,平均为549.84 mg/kg。沉积物磷以IP为主,而IP以Ca-P为主。
(2) RDA表明,轴1和轴2的解释度分别为69.3%、22.0%,其中黏土、水深分别是影响RDA轴1、轴2的重要环境因子。TP、OP、Fe/Al-P与黏土含量均呈显著性正相关(P<0.001),IP、Ca-P、Fe与水深均呈显著相关性(P<0.05)。水深通过影响颗粒和Fe的输移而影响磷形态空间分布。
(3) TP、OP、Fe/Al-P远离河口含量增加,而IP、Ca-P在河口富集。各磷形态占比与其浓度变化趋势一致,其中变化最大的是Ca-P,从河口浅水到远离河口处Ca-P衰减了23.16百分点。磷形态在远离河口、湖心深水、河口浅水的空间异质性表明湖泊参数能明显影响磷形态变化,可能是引起沉积物磷变化的重要因素。
