基于CIBERSORT算法研究腰椎间盘突出症中差异基因的免疫浸润及相关中药预测*
2023-10-24陈顺德钟小龙崔立生
陈顺德,沈 浮,钟小龙,彭 芮,崔立生
(永州市中医医院,湖南 永州 425000)
腰椎间盘突出症(lumbar disc herniation,LDH)是指椎间盘纤维环破裂,椎间盘内核状物向脊髓管或神经孔突出,压迫或刺激椎间孔出口的神经根或脊髓,引起临床症状为腰痛、下肢疼痛、感觉异常、肌力减退、膝反射异常的退行性病变,严重影响患者的日常生活和工作能力[1-3]。目前主流观点认为,LDH的发病与椎间盘组织退变、慢性过度使用、不良姿势、劳动强度过大等因素有关。我国每年LDH的发病率为5.40%~15.21%,占腰腿痛疾病的62.36%以上[4]。此外,慢性炎症、细胞因子和化学因子也被认为在LDH的发生和发展中发挥了重要的作用[5-6]。虽然病理学上存在一些共性,但LDH的发病机制仍不十分清楚。近期研究表明,免疫细胞浸润在LDH的发病和进展中扮演了关键角色[7-8]。在这个过程中,多种免疫细胞,如T细胞、B细胞、巨噬细胞和树突状细胞等会聚集在椎间盘周围,释放出一系列细胞因子和趋化因子,导致局部炎症反应和神经病理学改变。这些免疫细胞及其释放物与疼痛的诱发和加重密切相关[9-11]。目前对LDH免疫细胞浸润的研究尚处于初步阶段,但已取得一些重要的进展和发现。研究提示中医药治疗LDH疗效显著,并可改善机体的免疫紊乱[12-13]。
生物信息学作为一种新兴的交叉学科,对于研究疾病的分子机制具有重要意义。基因芯片技术是生物信息学中应用广泛的技术之一,可以高效地获取大规模的基因表达数据[14-15]。本研究利用生物信息学工具,对LDH患者和正常人在基因芯片数据库(gene expression omnibus,GEO)中的差异基因数据进行了综合分析,并运用CIBERSORT算法对LDH相关的免疫浸润进行了研究。CIBERSORT算法是一种可靠的机器学习方法,可基于线性支持向量回归算法进行细胞组成分析。其反卷积方法可通过使用线性回归模型来解决混合细胞组成问题[15]。该算法基于公开可用的参考基因表达数据,并利用贝叶斯概率理论和线性回归模型计算出各细胞类型的相对比例,进而估计未知样本中各种细胞类型的组成比例。同时该算法可用于识别人类免疫细胞表型,广泛应用于评估不同免疫细胞的相对含量和动态调节过程[16-17]。本研究旨在探讨LDH的分子机制及其与免疫浸润的相关性,并对与LDH免疫相关的中药进行预测及筛选,从而为LDH的诊断和治疗提供依据。
1 资料与方法
1.1 数据库及软件工具 本研究使用了多个数据库和数据分析软件工具。其中,GEO基因表达数据库(https://www.ncbi.nlm.nih.gov/geo/)和STRING数据库(https://string-db.org/)分别用于获取基因表达和蛋白相互作用网络信息,Coremine Medical数据库(http://www.coremine.com/)则用于获取与研究主题相关的文献信息。数据分析软件工具方面,本研究使用了Cytoscape-3.7.0(CentiScape插件)进行网络可视化分析,同时利用R语言4.2.3程序中的bioconductor、limmar、clusterProfiler、pheatmap等数据包进行数据处理、差异分析和结果展示。
1.2 LDH差异表达基因获取 从GEO数据库中使用GEO的在线搜索工具检索LDH患者的基因芯片数据,使用R语言中的“limma”软件包对基因探针进行t检验,并根据筛选条件进行差异基因分析。筛选条件为|log2FC|≥1和校正P<0.05,即仅选择在表达水平上有显著变化的基因。负数代表下调,正数代表上调。基因芯片数据中通常使用探针表示不同的基因。本研究使用GPL570平台将探针转换成基因名称,获得LDH差异表达基因的列表。
1.3 核心基因及功能注释 差异基因通过STRING数据库获取蛋白互作网络模型(protein protein interaction network,PPI network),然后将结果导入Cytoscape软件,并利用CentiScape插件计算每个靶基因的DC(度)值。通过平均度值的2倍进行核心靶基因的筛选,并进行可视化。此外,使用R语言中的“clusterProfiler”插件包,进行差异基因的基因通路富集分析(kyoto encyclopedia of genes and genomes,KEGG)。
1.4 获取免疫浸润矩阵及主成分分析 本研究基于R语言程序并链接CIBERSORT反卷积法对LDH的差异基因与22种免疫细胞(包括T细胞、原始和记忆B细胞、静止和活化NK细胞等)建立一个线性回归模型来计算其相对比例。对于每个未知样本,CIBERSORT算法将其基因表达数据映射到参考基因表达数据的特征基因上,并利用已构建的线性回归模型计算出其细胞组成比例。由于存在测量误差和噪声,算法会进行1 000次反卷积计算,对P<0.05的数据进行后续分析[17]。使用R语言进行LDH差异基因的主成分分析(principal component analysis,PCA),读取CIBERSORT计算得到的免疫细胞含量数据,然后通过PCA对样品进行降维,将高维度的数据转化为二维平面坐标系上的点。接着,利用ggplot2包绘制PCA图,将两组样品的点用不同颜色表示,并使用椭圆形表示每个样品组的免疫细胞含量的方差,以及使用文字标记样品组的平均值。
1.5 免疫细胞间相关性分析及组间差异分析 为了探究不同免疫细胞之间的相关性,本研究在CIBERSORT反演方法中筛选P<0.05的可靠样本数据,并计算不同免疫细胞间的Pearson相关系数。此外,还使用秩和检验来比较LDH患者与健康人群之间的差异。
1.6 LDH免疫浸润过程中潜在中药的筛选预测 将LDH差异核心靶基因及GO富集的与免疫浸润相关生物学过程导入Coremine Medical数据库中,筛选具有潜在效应机制的中药,P<0.05为差异有统计学意义。
2 结果
2.1 LDH差异表达基因获取结果 通过检索GEO数据库,对LDH相关的基因探针进行筛选,最终本研究将GSE150408芯片数据作为本次的研究对象。GSE150408是来自NCBI的一个公共基因表达谱数据库,该数据集包括了来自25名LDH患者(LDH组)和25名正常人(正常组)的外周血样本。经筛选后获得LDH组与正常组的差异基因588个,其中上调基因为210个,下调基因为378个。图1A为差异基因的分布情况,图1B热图展示前20个上调及下调基因的情况,红色、黑色、绿色节点分别代表基因的上调、无差异、下调。
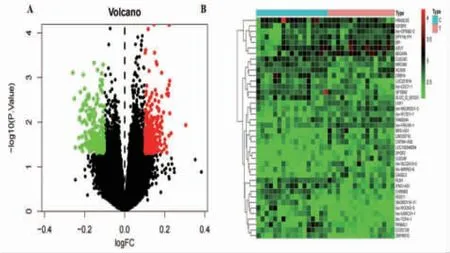
图1 LDH 相关基因探针差异表达的热图及火山图
2.2 核心靶基因获取 在PPI模型中,节点颜色越深代表该节点的度值越大,重要程度越高。筛选出15个核心基因,它们的度值大于2倍平均度值。这些核心基因为INS、PLP1、KIF1A、SH3GL2、NRCAM、MPO、DUSP26、FCGR1A、GNAI1、IGFBP3、PTPRU、CD86、GPM6B、TCF7L2、AREG。(见图2)
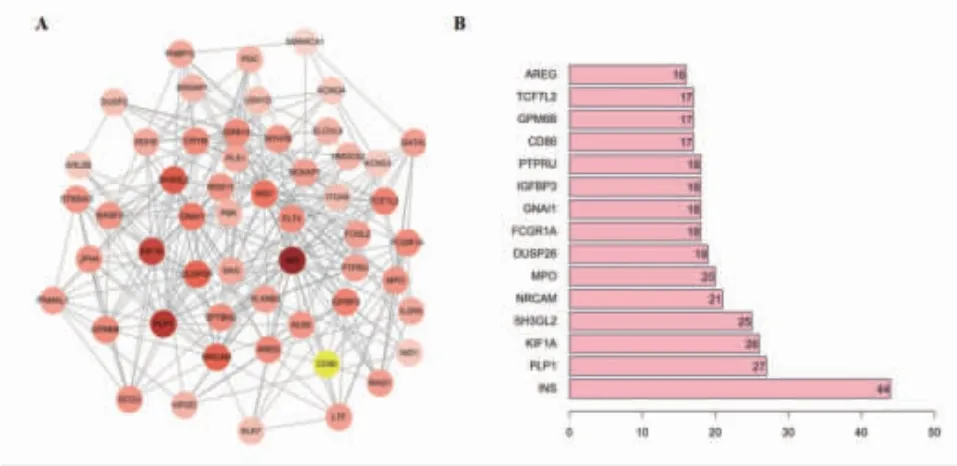
图2 LDH 差异基因的PPI 网络图及核心靶基因
2.3 LDH差异基因的KEGG富集分析结果 运用R语言程序中的“clusterProfiler”插件包对LDH差异基因进行通路富集分析,结果显示差异基因主要涉及Th17细胞分化、T细胞受体信号通路、TNF信号通路、MAPK信号通路、IL-17信号通路、NOD样受体信号通路、成骨细胞分化、Toll样受体信号通路、EGFR酪氨酸激酶抑制剂耐药性、JAK-STAT信号通路、NF-κB信号通路、VEGF等通路。(见图3)
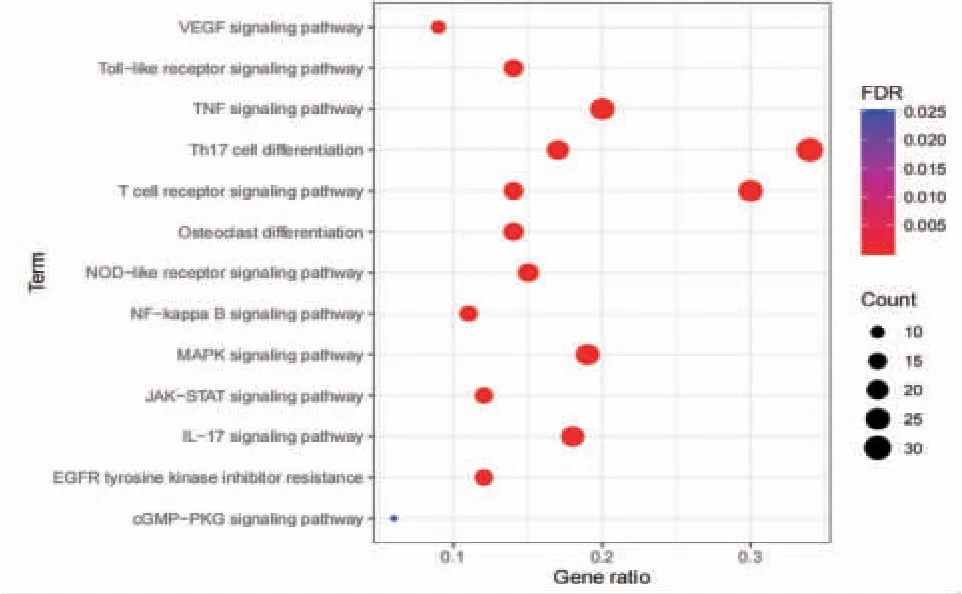
图3 LDH 差异基因的KEGG 富集分析
2.4 LDH免疫浸润的PCA主成分分析 在PCA图中,不同分组(正常组与LDH组)的样本聚集在不同的区域内,表明样本之间存在显著的差异,表明这些主成分与样本的差异有关,结果较为可信。(见图4)

图4 LDH 免疫浸润的PCA 主成分分析
2.5 免疫细胞间相关性分析 由图5可知,γδ T细胞(T cells gamma delta,γδ T cells)与滤泡辅助性T细胞(T cells follicular helper,Tfh)呈正相关关系(r=0.97),活化的CD4+T记忆细胞(T cells CD4 memory activated)与调节性T细胞(T cells regulatory,Tregs)呈正相关关系(r=0.61),中性粒细胞(neutrophils)与单核细胞(monocytes)呈负相关关系(r=-0.68),CD8+T细胞(T cells CD8)与活化NK细胞(NK cells activated)呈负相关关系(r=-0.59)。

图5 LDH 组中免疫细胞间的相关性分析
2.6 LDH组与正常组的免疫浸润差异分析 LDH组与正常组在多种免疫细胞中表现出明显差异(P<0.05),包括浆细胞(plasma cells)、CD8+T细胞、活化的CD4+T记忆细胞、滤泡辅助性T细胞、调节性T细胞、γδ T细胞、激活的自然杀伤细胞、M1型巨噬细胞(macrophages M1)、激活的肥大细胞(Mast cells activated)和中性粒细胞。(见图6)
2.7 免疫浸润相关生物途径的中药预测 通过Coremine Medical预测具有潜在治疗作用的中药,以P<0.05作为筛选标准,预测LDH核心差异靶基因及相关免疫反应生物学过程相关的中药。该网络中三七、人参、生地黄、枸杞子的度值较高,提示与LDH相关免疫浸润的关系最密切。(见图7)将导出的中药进行性、味、归经及功效分析,可知多为辛温、甘平之药,归经多为肝经、脾经、肾经,功效多与补气养血、益肝肾、补骨髓及活血化瘀相关。(见图8)
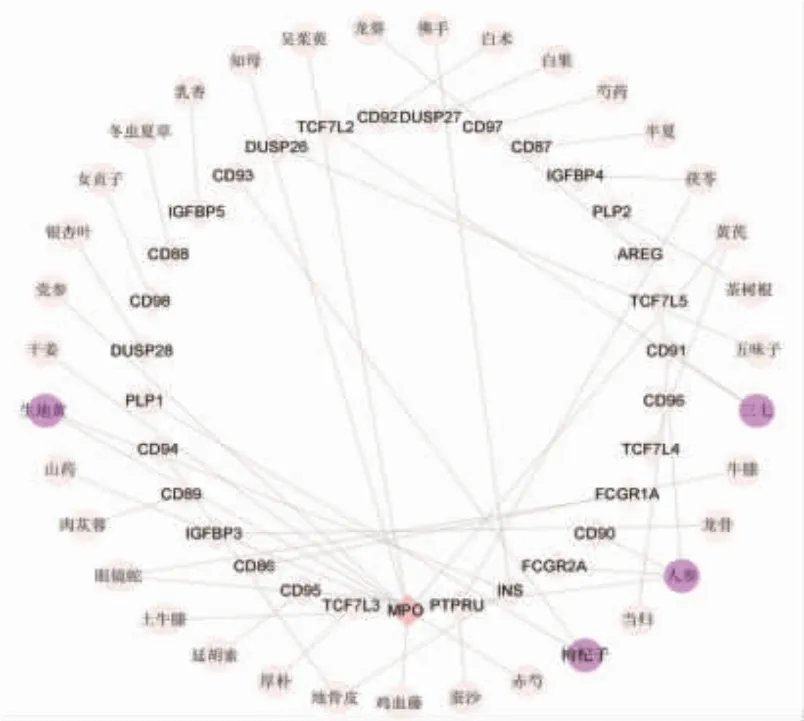
图7 LDH 免疫浸润相关的中药预测网络图

图8 LDH 免疫浸润相关的中药特征分析
3 讨论
本研究使用基因芯片分析,对LDH患者和正常人群进行差异基因筛选,通过PPI分析,确定了与LDH相关的15个核心靶基因。其中PLP1、CD86、NRCAM、FCGR1A、MPO、KIF1A等基因与LDH的髓核炎症反应和椎间盘免疫反应有关。研究显示,PLP1的表达水平与炎症反应相关的细胞因子产生和免疫细胞活化有关[18]。PLP1基因敲除小鼠的脊髓具有更高的NF-κB激活水平,而这是一个重要的炎症信号通路,表明PLP1可能对炎症反应起着调节作用[19]。另一项研究发现,PLP1缺陷会导致小鼠脊髓中B细胞数量的增加,并且这些B细胞具有增强抗原递呈的功能,可加速脊髓炎症的进展[20-21]。这些结果表明PLP1在腰椎髓核炎症反应和免疫反应中可能具有重要作用。CD86是一种重要的共刺激分子,在免疫反应中发挥重要作用。研究表明,在腰椎髓核炎症反应患者中,CD86的表达水平明显升高,并且其与炎症反应和疼痛程度密切相关[8]。NRCAM基因编码神经细胞黏附分子,可以通过调节T细胞的产生和炎症介质的释放来影响免疫反应[22]。FCGR1A在退化的椎间盘中的巨噬细胞中高度表达,并能够调节巨噬细胞的活化和炎症反应,从而参与椎间盘退变的进程[23]。MPO在免疫细胞的活化和炎症反应中亦发挥着重要的作用。研究表明,在椎间盘退变组织中MPO的表达水平明显升高[24]。MPO能够参与调节免疫细胞的活化和炎症反应,如增强TNF-α和IL-1β等炎症介质的产生,并参与氧化应激反应,导致氧化应激损伤和细胞凋亡等,进而促进椎间盘退变的发生[25]。总之,本研究筛选出的大部分核心靶基因与免疫反应和疼痛传递等方面有关,且与目前LDH相关的实验研究相符合,进一步说明本研究预测结果的可靠性,提示其可能成为未来诊断LDH的潜在靶标及生物标志物。
本研究利用GEO基因芯片对LDH患者与正常人群进行差异基因的KEGG富集分析,提示Th17细胞分化通路、T细胞受体信号通路、TNF信号通路、NF-κB信号通路可能与免疫反应密切相关。其中NF-κB通常被激活以调节炎症反应和免疫细胞的增殖和分化[26]。研究发现,在退变的椎间盘中NF-κB的活性明显增强。一些炎症介质(如IL-1β和TNF-α)被发现可以诱导NF-κB的激活,并促进椎间盘细胞的炎症反应[27]。近年来的研究表明,T细胞受体信号通路在椎间盘免疫反应中也扮演了重要角色,T细胞可以在椎间盘组织中识别并应对抗原,并通过TCR信号通路激活免疫反应[7]。椎间盘组织中存在大量的CD4+和CD8+T细胞。它们表达的TCR可以与椎间盘组织中的胶原蛋白等抗原结合,并诱导免疫反应[28]。而TNF信号通路介导的多种炎症反应,在椎间盘的免疫反应中扮演着重要的角色。TNF可通过激活NF-κB信号通路,促进IL-1β、IL-6、IL-8等炎症介质的产生,同时还可以诱导MMP的表达,从而引发椎间盘的炎症反应和破坏[29]。TNF还可以诱导炎症细胞的浸润和椎间盘细胞凋亡,加剧疾病的发展[30]。而在椎间盘组织中检测到大量的IL-17和IL-22,可以诱导椎间盘细胞产生炎症细胞因子,并且IL-17和IL-22还可以促进骨髓间充质干细胞向成骨细胞分化,从而进一步加重椎间盘的退变[31]。因此,抑制Th17细胞分化和减少IL-17和IL-22等炎症细胞因子的产生,可能成为治疗椎间盘退变的重要策略之一。
为了进一步探讨免疫细胞在LDH中的作用,本研究利用CIBERSORT反卷积法对两组外周血样本进行筛选,得出多种免疫细胞存在差异,其中部分结果已经得到验证。近些年来巨噬细胞浸润在椎间盘的退变中的作用成为了研究热点。本研究得出巨噬细胞M1在椎间盘退变中明显增加,M1巨噬细胞可以从单核细胞中分化出来。其产生的IL-1、IL-1α、IL-1β、IL-6、TNF-α等促炎性细胞因子和产物,可导致椎间盘的退化和疼痛,且M1型巨噬细胞的存在与椎间盘炎症反应和神经根疼痛的发生密切相关[32]。而在LDH中明显增加的还有肥大细胞。肥大细胞释放的组织蛋白酶、白三烯、肥大细胞介素-4等介质会诱导炎症反应,促进退变。此外,肥大细胞还可以诱导神经病理变化,如痛觉过敏和神经递质的释放。这些机制也可能参与了椎间盘退变过程中神经病理变化[33]。而Treg细胞在LDH明显减少,该结果与近期的基础研究亦相符合,Treg主要功能是调节和控制免疫反应,椎间盘疾病患者的Treg数量和功能比正常人降低,这可能导致免疫系统的失控和疾病的发生和发展。此外,Treg还可以通过抑制其他免疫细胞的活动来减轻椎间盘炎症反应,从而对椎间盘疾病的治疗有一定的潜力[34]。总的来说,Treg在椎间盘免疫反应中的作用尚需深入研究。在免疫细胞间相关性分析中,本研究对于22种免疫细胞两两之间的关系进行了相关性比较。结果显示,γδ T细胞与滤泡辅助性T细胞呈正相关关系,中性粒细胞与单核细胞呈负相关关系,侧面反映不同免疫细胞之间在LDH的病程进展中存在协同或拮抗作用。而目前对于不同类型免疫细胞之间的相关性分析的基础研究尚缺乏大规模的验证,本预测具有一定程度的参考意义。
LDH属中医学“腰痹”范畴。中医药治疗LDH的优势之一是能够调节免疫反应,减轻免疫细胞的浸润和炎症反应,从而缓解LDH的症状。中医药强调整体观念和个体化治疗,能够根据患者的具体病情和体质特点,针对性地选用中药配方,达到治疗和调节免疫反应的效果。本研究从免疫浸润的角度对LDH差异靶基因进行中药反向预测,筛选得出多为辛温、甘平之药,归经多归为肝经、脾经、肾经,功效多与补气养血、益肝肾、补骨髓及活血化瘀相关。其中三七、人参、生地黄、枸杞子具有明显相关性。三七中的主要成分三七皂苷可以减轻椎间盘细胞因子TNF-α诱导而产生的炎症反应,并抑制NFκB和MAPKs信号通路的活化,从而抑制炎症细胞因子的产生,改善椎间盘退变[35]。人参、生地黄均可以减轻椎间盘细胞的炎症反应,促进椎间盘组织的再生和修复。枸杞多糖可以降低炎症细胞浸润和减少氧化应激反应[36-38]。
本研究也存在一些限制。首先,由于本研究所使用的LDH基因芯片数据来源于有限的样本量,可能会因样本量不足而导致数据分析的偏倚。因此,进一步整合多个LDH基因芯片数据以减少误差是必要的。其次,本研究使用CIBERSORT反卷积算法对免疫细胞进行预测,但仍需进一步实验验证。
