预知子提取物对卒中后失眠模型大鼠海马PI3K/Akt信号通路的影响*
2023-10-24刘景峰宋伟伟李宝栋王雅荣白德龙赵学栋张玉曼
刘景峰,宋伟伟,李宝栋,王雅荣,白德龙,赵学栋,宋 佳,张玉曼,霍 青
(1.河北省沧州中西医结合医院,河北 沧州 061000;2.山东中医药大学附属医院,山东 济南 250011)
卒中是导致人类死亡的3大疾病之一,中国每年约有200万新发脑卒中患者[1]。卒中后引发的睡眠障碍是该病的常见并发症,临床上主要表现有失眠、嗜睡、睡眠呼吸障碍等[2]。研究发现大约有20%~40%的脑卒中患者会并发睡眠障碍;有数据显示,95%的脑血管病患者存在睡眠障碍[3]。据悉,在卒中后睡眠障碍患者中失眠最为常见。国外报道脑卒中后患者发生失眠的概率为20%~56%,脑卒中急性期甚至高达56.7%~67.7%[4]。尽管在过去几十年中卒中的治疗效果取得了很大进展,但有效的医疗或外科治疗仍有待确定。因此,找到一种有效的治疗方式,对于疾病的治疗具有重要意义。预知子(Foreknowledge)为木通科植物,别名八月札,其果实具有疏肝理气、散瘀消结等功效[5]。预知子为夜交藤预知子汤方中主药之一,目前已有研究证实,预知子提取物(FAE)具有抗抑郁功效,可有效治疗脑卒中后引发的认知功能障碍,并且与单胺类神经递质转运蛋白具有高亲和力[6],提示FAE可能作用于相关神经递质,从而导致机体神经功能的转变。PI3K/Akt是控制细胞分裂、自噬、存活和分化等多种细胞过程的重要途径之一。且参与了缺血性脑卒中的病理过程[7]。有研究发现,PI3K/Akt信号通路的激活与机体炎症反应存在密切相关性,PI3K/Akt信号通路的激活可引起肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等炎症因子表达异常,从而引起机体炎症反应[8]。但是目前关于FAE在卒中后失眠中的具体作用机制还不清楚,因此通过建立卒中后失眠大鼠模型,并采用FAE进行干预,以探讨FAE的相关作用机制。
1 材料与方法
1.1 实验动物 6周龄SPF级SD大鼠,雌雄各半,购自重庆陆军军医大学,体质量(200~220)g。动物生产许可证号:SCXK(渝)2019-0009;动物使用许可证号:SYXK(渝)2019-0069;动物合格证:20191254。本实验动物于SPF级动物房中进行饲养,饲养条件为:20~25 ℃,环境湿度:40%~60%,模拟动物光照环境(昼12 h/夜12 h),各组大鼠饮水饮食自由,本实验通过河北省沧州中西医结合医院伦理委员会审批,符合动物伦理标准。
1.2 药物与试剂 预知子提取物(南京建成生物工程研究所,纯度:99.99%,批号:20168491);艾司西酞普兰(大连美仑生物技术有限公司,纯度:99.99%,批号:202036491);TNF-α、IL-1β和IL-6酶联免疫吸附测定(ELISA)试剂盒(上海优宁维生物有限公司,批号:SA-6548,FS-9848,CS-6845);RT-qPCR试剂盒(南京建成生物有限公司,批号:961241);蛋白定量试剂盒(南京建成生物有限公司,批号:323215);PI3K、Akt、β-actin蛋白抗体(美国,abcam公司,批号:AB-6154,AB-3325,AB-0013)。
1.3 主要仪器 BX53显微镜(日本奥林巴斯公司);ZS-Morris水迷宫视频跟踪系统(北京众实科技有限公司);伯乐1681130 imark全自动酶标仪(美国伯乐公司);伯乐Mini-PRO TEAN电泳仪(美国伯乐公司);JD-CW96荧光定量PCR仪(山东竞道光电科技有限公司);LAS 4000成像系统(美国贝克曼库尔特公司)。
1.4 造模与分组 选取健康SD大鼠60只,适应性喂养7 d后,根据随机数字表法将大鼠随机分成假手术组、模型组、阳性对照组(艾司西酞普兰,10 mg/kg),以及预知子提取物低(25 mg/kg)、中(50 mg/kg)、高(100 mg/kg)剂量组,其中预知子提取物各剂量组药物均以预知子提取物质量计算,每组10只[9]。大鼠禁食、禁水12 h后,腹腔注射1%戊巴比妥钠(0.1 mL/kg)麻醉,消毒大鼠颈部皮肤,手术刀沿颈部正中线切开皮肤,暴露大鼠颈总动脉,假手术组直接缝合伤口,其余各组夹闭颈总动脉近心端,实现大脑动脉阻塞,造成卒中模型,然后缝合创口,并注射青霉素预防大鼠感染死亡,建模24 h后采用改良神经功能缺损严重程度(mNSS)量表对大鼠进行评分,mNSS评分≥2分即表示建模成功[10]。
1.5 实验给药 建模成功后,预知子各剂量组和阳性对照组大鼠分别灌胃相应的药物,模型组和假手术组灌胃相同体积的生理盐水,持续21 d。
1.6 观察指标
1.6.1 Morris水迷宫实验 实验前准备一个2 m×2 m的水池,将水池分成4个象限,并放置一个平台,随机将本实验的大鼠放在水池内,记录每只大鼠游到平台上的用时,若用时大于60 s,则直接将这只大鼠放置在平台上10 s。本实验连续进行5 d,每天进行两次,取平均值为当日大鼠的逃逸时间。
1.6.2 大鼠脑组织病理结构观察 实验末期,采用1%戊巴比妥钠腹腔注射麻醉大鼠,麻醉后取大鼠脑组织,将其中一半放入福尔马林溶液中浸泡48 h,浸泡后制作组织蜡块并切片,最后应用HE染色法进行染色,显微镜下观察。
1.6.3 大鼠血清TNF-α、IL-1β和IL-6水平检测 实验末期,采用1%戊巴比妥钠腹腔注射麻醉大鼠,采用非抗凝管取大鼠全血3 mL,4 ℃,2 500 r/min离心15 min(离心半径10 cm),取上清液于一支新的离心管中,置于-80 ℃保存,备用。采用ELISA法检测血清中TNF-α、IL-1β和IL-6的水平,根据ELISA试剂盒说明书,对血清样本进行处理后,采用全自动酶标仪在450 nm波长处检测样本吸光度,并根据标准曲线来计算样品中TNF-α、IL-1β和IL-6的浓度。
1.6.4 总RNA提取及RT-qPCR 根据RNA提取试剂盒提取海马组织总RNA,然后反转录生成cDNA并在-80 ℃冰箱保存备用。配置体系:引物2.25 μL,cDNA3.0 μL,SYBR Green qPCR SuperMix 17.25 μL,去酶水7.5 μL,每个样品设置6各复孔。PCR条件:94 ℃,12 min;96 ℃,12 s;62 ℃,25 s;72 ℃,40 s;共35个循环。采用2-ΔΔct法进行计算,并分析mRNA表达。引物序列,PI3K:5’-ATGCACCGCGACTGATAGTCGC-3’,5’-TTCGCGTAGTGC TGATGCA-3’;Akt:5’-GCGGCTAGTGCTGATGTGCTGTA-3’,5’-CGTGATGTAGCTATGCTAGG-3’;GAPDH:5’-ATGCGTTT GAGAGCTCAGG-3’,5’-TTCAGCTGCATCGACGAT-3’。计算各组大鼠海马组织PI3K mRNA、Akt mRNA相对表达量。
1.6.5 大鼠PI3K、Akt蛋白水平检测 处死大鼠步骤同上,取一侧大鼠海马组织放入玻璃研磨器中,配置蛋白酶K溶液(1 mL PBS加入100 μL蛋白酶K),加入1 mL蛋白酶K溶液充分研磨,3 000 r/min 4℃条件下离心20min(离心半径10 cm),上清转移至1.5mL EP管,采用蛋白检测试剂盒进行蛋白定量,并使每管蛋白浓度为3 μg/mL后进行电泳,经SDS-PAGE电泳分离、转模和封闭后用特异性抗体PI3K、Akt和β-actin(抗体稀释浓度1∶5000)在4 ℃条件下孵育12 h,孵育后的条带清洗3次(1%吐温),加入二抗(山羊抗兔,稀释浓度1∶1 000)孵育2 h,LAS 4 000成像并观察结果。
1.7 统计学方法 实验数据采用SPSS 22.0软件进行分析,计量资料符合正态分布以“均数±标准差”()表示,多组比较采用单因素方差分析,并采用LSD-t法进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 预知子提取物对大鼠Morris水迷宫实验结果的影响 与假手术组比较,模型组大鼠逃逸时间显著增加(P<0.05);在给予预知子提取物和艾司西酞普兰干预后,与模型组比较,阳性对照组和预知子提取物各剂量组大鼠逃逸时间显著降低(P<0.05),且预知子提取物各剂量组具有剂量依赖性(P<0.05);预知子提取物高剂量组大鼠逃逸时间与阳性对照组比较,差异无统计学意义(P>0.05)。(见表1)
表1 各组大鼠逃逸时间比较 (,s)

表1 各组大鼠逃逸时间比较 (,s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05;与预知子提取物低剂量组比较,dP<0.05;与预知子提取物中剂量组比较,eP<0.05。
?
2.2 大鼠脑组织病理结果 假手术组大鼠脑组织未见明显异常,模型组大鼠脑组织伴有大量炎症细胞浸润,细胞变形,边界不清,镜下发现部分区域有出血点,在给予大鼠预知子提取物和艾司西酞普兰干预后,以上病理状态均有所缓解,其中阳性对照组和预知子提取物高剂量组最为明显。(见图1)

图1 各组大鼠脑组织病理切片图 (HE,×200)

图2 各组大鼠PI3K、Akt 蛋白表达Western blotting 图
2.3 预知子提取物对大鼠血清炎症因子的影响 与假手术组比较,模型组大鼠血清TNF-α、IL-1β和IL-6均显著升高(P<0.05);与模型组比较,阳性对照组和预知子提取物各剂量组大鼠血清TNF-α、IL-1β和IL-6均显著降低(P<0.05),且预知子提取物各剂量组具有剂量依赖性;预知子提取物高剂量组大鼠血清TNF-α、IL-1β和IL-6与阳性对照组比较,差异均无统计学意义(P>0.05)。(见表2)
表2 各组大鼠血清TNF-α、IL-1β和IL-6比较(,pg/mL)
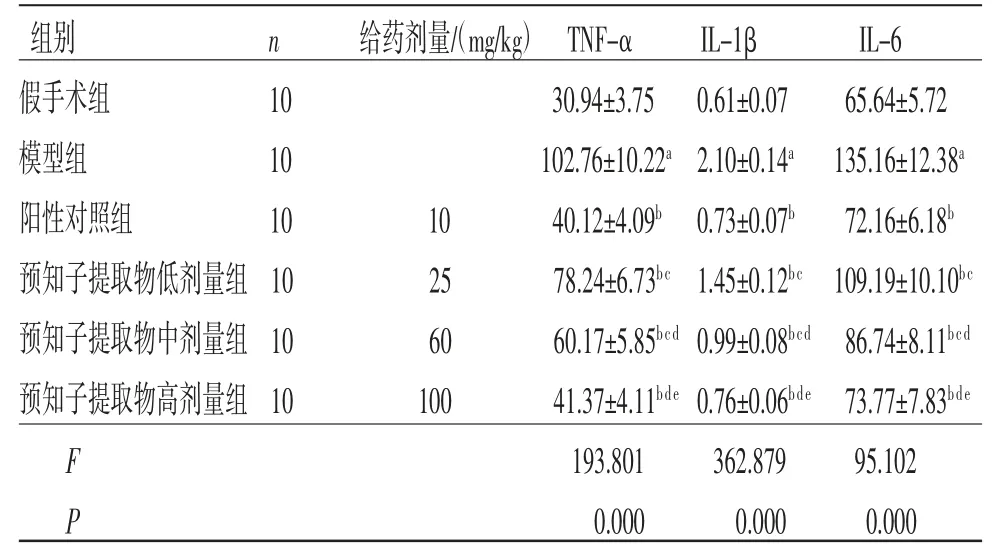
表2 各组大鼠血清TNF-α、IL-1β和IL-6比较(,pg/mL)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05;与预知子提取物低剂量组比较,dP<0.05;与预知子提取物中剂量组比较,eP<0.05。
?
2.4 预知子提取物对大鼠PI3K mRNA、Akt mRNA表达的影响 与假手术组比较,模型组大鼠PI3K mRNA、Akt mRNA均显著升高(P<0.05);与模型组比较,阳性对照组和预知子提取物各剂量组大鼠PI3K mRNA、Akt mRNA均显著降低(P<0.05),且预知子提取物各剂量组具有剂量依赖性;预知子提取物高剂量组大鼠PI3K mRNA、Akt mRNA与阳性对照组比较,差异均无统计学意义(P>0.05)。(见表3)
表3 各组大鼠PI3K mRNA、Akt mRNA表达水平比较(,2-ΔΔCT)
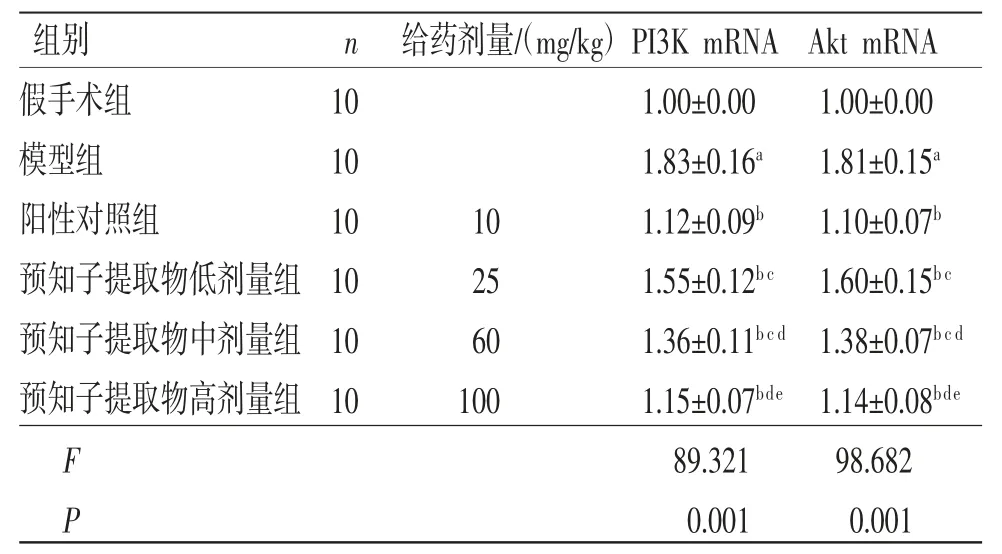
表3 各组大鼠PI3K mRNA、Akt mRNA表达水平比较(,2-ΔΔCT)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05;与预知子提取物低剂量组比较,dP<0.05;与预知子提取物中剂量组比较,eP<0.05。
?
2.4 预知子提取物对大鼠PI3K、Akt蛋白表达的影响 与假手术组比较,模型组大鼠PI3K、Akt蛋白表达均显著升高(P<0.05);与模型组比较,阳性对照组和预知子提取物各剂量组大鼠PI3K、Akt蛋白表达均显著降低(P<0.05),且预知子提取物各剂量组具有剂量依赖性;预知子提取物高剂量组大鼠PI3K、Akt蛋白表达与阳性对照组比较,差异均无统计学意义(P>0.05)。(见表4)
表4 各组大鼠PI3K、Akt 蛋白表达水平比较 (,2-ΔΔCT)

表4 各组大鼠PI3K、Akt 蛋白表达水平比较 (,2-ΔΔCT)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05;与预知子提取物低剂量组比较,dP<0.05;与预知子提取物中剂量组比较,eP<0.05。
?
3 讨论
卒中的部位、性质、患者年龄、性别、机体健康状况、家庭等均是卒中后失眠发生的重要影响因素[11]。目前对卒中后失眠的患者的研究调查普遍认为神经内分泌系统紊乱会导致卒中患者失眠的风险增加[12]。而炎症反应的发生可能是引起机体神经内分泌系统紊乱的重要因素之一[13]。先前的研究[14]表明,中药治疗可以抑制机体炎症反应,降低炎症因子表达水平,如TNF-α、IL-1β和IL-6,逆转了海马线粒体功能障碍并抑制了炎症反应发生。此外,中药治疗可减少卒中大鼠海马区的凋亡细胞数量,从而缓解卒中引起的神经功能损伤,有利于疾病的恢复[15]。本研究中笔者基于预知子提取物的神经调节作用,采用其作为卒中后失眠大鼠的干预药物,结果显示,在构建卒中后失眠大鼠模型后,通过mNSS评分发现大鼠出现了神经功能损伤,同时通过水迷宫实验结果发现大鼠的学习和记忆功能均受到了一定程度的损伤。在给予大鼠预知子提取物治疗后,可显著改善大鼠神经功能受损情况,同时大鼠学习和记忆能力也得到了大幅改善,提示预知子提取物对于卒中后失眠大鼠神经功能具有较好的治疗作用,同时可有效提高其学习记忆能力,这可能与预知子提取物能有效提高神经递质蛋白亲和力,改善神经系统功能有关。
炎症反应是大多数疾病的主要影响因素,因此本研究检测了各组大鼠血清的炎症因子TNF-α、IL-1β和IL-6。TNF-α是体内一种重要的促炎性细胞因子,在多种生理反应中起着至关重要的作用,如炎症介质的合成和释放、中性粒细胞在肺部的积聚和补体激活[16]。IL-6是免疫调节重要的影响因子。研究表明,IL-6的表达水平可反映机体炎症反应程度,具有催化和放大炎症反应的作用,因此临床常作为急慢性炎症诊断指标[17]。IL-1β是一种重要的炎症因子,可诱导产生和释放多种炎症因子[18]。本研究结果显示,当大鼠发生卒中后,其血清TNF-α、IL-1β和IL-6均显著升高,提示此时大鼠炎症反应加剧,在给予预知子提取物治疗后,血清TNF-α、IL-1β和IL-6均显著降低,同时结合各组大鼠病理结果,发现预知子提取物各剂量组大鼠脑组织炎症细胞浸润明显减少,表明预知子提取物可通过降低机体血清TNF-α、IL-1β和IL-6表达水平,减缓炎症反应,从而达到恢复大鼠神经功能的功效。
众所周知,PI3K/Akt通路在包括细胞增殖、迁移和凋亡等生物学过程中具有重要作用[19]。此外,它还与许多人类炎症疾病有关,PI3K/Akt通路的激活,可引起炎症基因转录上调,从而导致大量炎症细胞因子的产生,如TNF-α、IL-1β和IL-6,提示PI3K/Akt通路在机体炎症发展中具有重要作用[20]。本研究构建了卒中后失眠大鼠模型,根据PCR和蛋白免疫印迹结果发现PI3K/Akt信号通路被激活,而预知子提取物的治疗抑制了PI3K/Akt信号通路,同时机体炎症反应减弱,提示预知子提取物可能通过抑制PI3K/Akt信号通路蛋白相关表达,降低机体炎症反应,达到治疗效果。
综上所述,预知子提取物可有效改善卒中后失眠模型大鼠的神经功能损伤,其机制可能与抑制PI3K/Akt信号通路,下调炎症因子表达,减弱机体炎症反应有关。
