昆虫Kr-h1基因的生物信息学分析
2023-10-21陈煜民张微微邓建玲
王 欢,陈煜民,李 凯,张微微*,邓建玲*
(1.上海农林职业技术学院植物科学技术系,上海 201699;2.东华大学生物与医学工程学院,上海 201620)
Kr-h1(Krüppel-homolog 1)是一种含有C2H2 锌指结构的转录因子[1],协同Met 基因与E93 基因,由这三者作为关键因子共同组成了MEKRE93 通路,并控制着变态[2]。Met 基因协同保幼激素通过结合Kr-h1基因上游应答原件来激活Kr-h1[3],Broad 复合体作为蜕皮激素信号通路的重要节点,E93 转录因子作为触发成虫特征出现的关键因子,均受到Kr-h1 基因的调控[4]。Kr-h1 作为昆虫变态发育重要因子,主要参与保幼激素对于昆虫变态发育的调控[5],在昆虫翅型分化[6]、社会化分工[7]、神经系统形成[8]与卵巢发育[9,10]等生理过程中都发挥着重要的作用,是近年来研究昆虫变态发育与害虫生物防治的重要靶标分子。
鉴于Kr-h1 在昆虫变态发育过程中的重要性,无论是Kr-h1 抑或C2H2 锌指结构均已发现在昆虫中相当保守[11],而Kr-h1 本身的磷酸化位点及其激素调控[12],也已证明在昆虫中是进化保守的。但对Kr-h1 进化的研究尚不充分,其在不同昆虫中表达模式的共性尚未明确,因此,全面分析Kr-h1 在不同目昆虫中的蛋白结构特点与基因表达模式及其进化特征,或可用于限制Kr-h1 在昆虫化蛹或者蛹期变态时的表达、阻断保幼激素代谢通路,进而起到阻碍有害昆虫正常变态发育的目的,这可能成为菜粉蝶等农业害虫生物防治的新策略。
本研究基于菜粉蝶Kr-h1 基因与NCBI 序列数据,解析了昆虫Kr-h1 基因结构、序列比对、保守结构域、二级结构、三级结构与表达模式分析,并重构系统发育树。以期从基因结构、蛋白特性、系统进化和表达模式四个角度对不同昆虫Kr-h1 基因进行分析,进一步揭示该基因保守结构特征及表达模式,为研究Kr-h1 在昆虫变态发育过程中发挥的生物学功能与害虫的生物防治提供新思路。
1 材料与方法
1.1 数据来源
菜粉蝶1 龄幼虫、3 龄幼虫、5 龄幼虫、蛹期与成虫期5 个不同生长发育时期Kr-h1 的转录组数据与成虫基因组数据为本实验室前期测序拼接而成。本研究中涉及到的其他昆虫的相关Kr-h1 序列均下载自NCBI数据库(表1)。使用课题组提供的菜粉蝶Kr-h1 基因序列以及在NCBI 网站上检索并下载目前已确定的昆虫Kr-h1 序列及其注释文件。利用GSDS 在线工具(http://gsds.gao-lab.org/)绘制基因结构图,分析基因结构,明确Kr-h1 基因在不同昆虫中外显子和内含子的数量与位置。

表1 NCBI 下载的昆虫Kr-h1 蛋白序列Table 1 Insect Kr-h1 sequences downloaded from NCBI
1.2 昆虫Kr-h1 蛋白的理化性质与结构分析
利用ExPASy-ProtParam tool(https://web.expasy.org/protparam/)得到Kr-h1 蛋白理化性质和氨基酸组成。利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)预测Kr-h1 蛋白的二级结构元件组成;使用SWISS-MODEL 在线网站(https://swissmodel.expasy.org/),预测Kr-h1 蛋白的三级结构;利用NetPhos-3.1Server(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)预测磷酸化位点;通过CBS 网站( http:∥www.cbs.dtu.dk/) 预测糖基化位点。使用SMART 在线软件(http://smart.emblheidelberg.de/)对不同昆虫的Kr-h1 蛋白结构域进行预测。利用MEME(https://prosite.expasy.org/scanprosite/)在线工具分析不同目昆虫Kr-h1 蛋白的保守基序将MEME 预测得到的文件储存为XML 格式,导入Tbtool软件中,绘制保守基序图。
1.3 昆虫Kr-h1 蛋白的系统进化分析
使用MEGAX 软件(http://www.megasoftware.net/)进行系统发育分析,并分析其保守结构域氨基酸位点的特征。使用MEGAX 软件,构建昆虫Kr-h1 蛋白的系统进化树并分析昆虫Kr-h1 的进化特征。
1.4 昆虫Kr-h1 基因的表达模式分析
本实验室前期获得的菜粉蝶1 龄幼虫、3 龄幼虫、5 龄幼虫、蛹期及成虫期的转录组数据,并根据文献筛选出本次研究相关的Kr-h1 蛋白基因的表达量数据[13-19]。通过相对蛹期或最后幼虫期作归一化处理,并构建热图。
2 结果与分析
2.1 昆虫Kr-h1 的基因结构
Kr-h1 基因包含2~4 个外显子,以2 个外显子组成为主。故种间内含子数目差异较小,但种间内含子距离相差较大,范围涵盖100 bp 至4 kb。断裂最明显的是蚤目的猫蚤与双翅目的黑腹果蝇,其Kr-h1 基因由4个外显子与3 个内含子构成。通过序列观察可知,昆虫Kr-h1 基因内含子剪切位点满足GT-AG 规则(图1)。
2.2 昆虫Kr-h1 蛋白氨基酸组成分析
序列相似性分析结果显示,菜粉蝶Kr-h1 蛋白与除了与同为鳞翅目的家蚕相似度较高外,与其他目昆虫的相似度都在60%上下(表2)。多序列比对发现,昆虫Kr-h1 蛋白均含8 个保守的C2H2 锌指结构,且所有锌指结构携有共同序列:赖氨酸-X2~4-赖氨酸-X8~9-亮氨酸-X2-组氨酸-X3-组氨酸(图2),提示该基因在进化中功能保守性较好。
Kr-h1 蛋白在不同目昆虫中差异较大,分子量在39 K~91 K,等电点PI 在9.15~6.84。Kr-h1 中含量最丰富的氨基酸都是丝氨酸,其次为脯氨酸,通过对保守结构域的分析发现这可能与其锌指结构组成有关。
2.3 二级结构与三级结构
Kr-h1 蛋白二级结构进行预测结果表明:多数昆虫Kr-h1 约20%为α-螺旋,无规卷曲占约60%,延伸链约15%。菜粉蝶α-螺旋占比只有9.63%,同时无规卷曲的占比却高达72.24%,表现出与其他昆虫不同的结构特性(表3)。
昆虫Kr-h1 蛋白三级结构表明,昆虫Kr-h1 蛋白都具有8 个锌指结构,而每个锌指结构又由一个α-螺旋与一个β-折叠构成(图3),使得Kr-h1 蛋白二级结构元件组成相对稳定。通过图中可以看出,虽然菜粉蝶Kr-h1 蛋白具有较多的无规卷曲比例,其Kr-h1 蛋白与其他昆虫在保守结构上无明显差异。
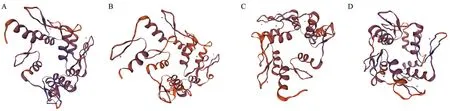
图3 四种昆虫Kr-h1 蛋白三维结构预测Fig.3 Tertiary structure prediction of four insect Kr-h1 protein
2.4 保守基序与结构域
昆虫中的Kr-h1 蛋白大部分含有相同的基序构成(图4)。Motif 1~8 为所有Kr-h1 蛋白的共有结构域,但是其中motif 1~6 共同构成Kr-h18 个保守的锌指结构(图5),motif 9 与motif 10 保守性较差,结合进化树分析(图6)发现,motif 9 仅存在于进化树的下半部分,motif 10 只在鳞翅目的菜粉蝶、家蚕、草地贪夜蛾和玉带凤蝶中存在,与之类似的Motif15 同样只存在于鞘翅目昆虫中,体现出在长期进化过程中鳞翅目昆虫与鞘翅目昆虫独特的进化选择。
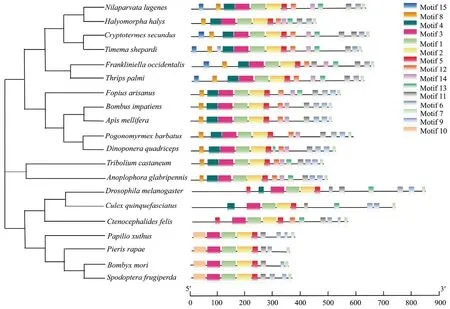
图4 昆虫Kr-h1 蛋白保守基序分析Fig.4 Conserved motifs in insect Kr-h1 protein
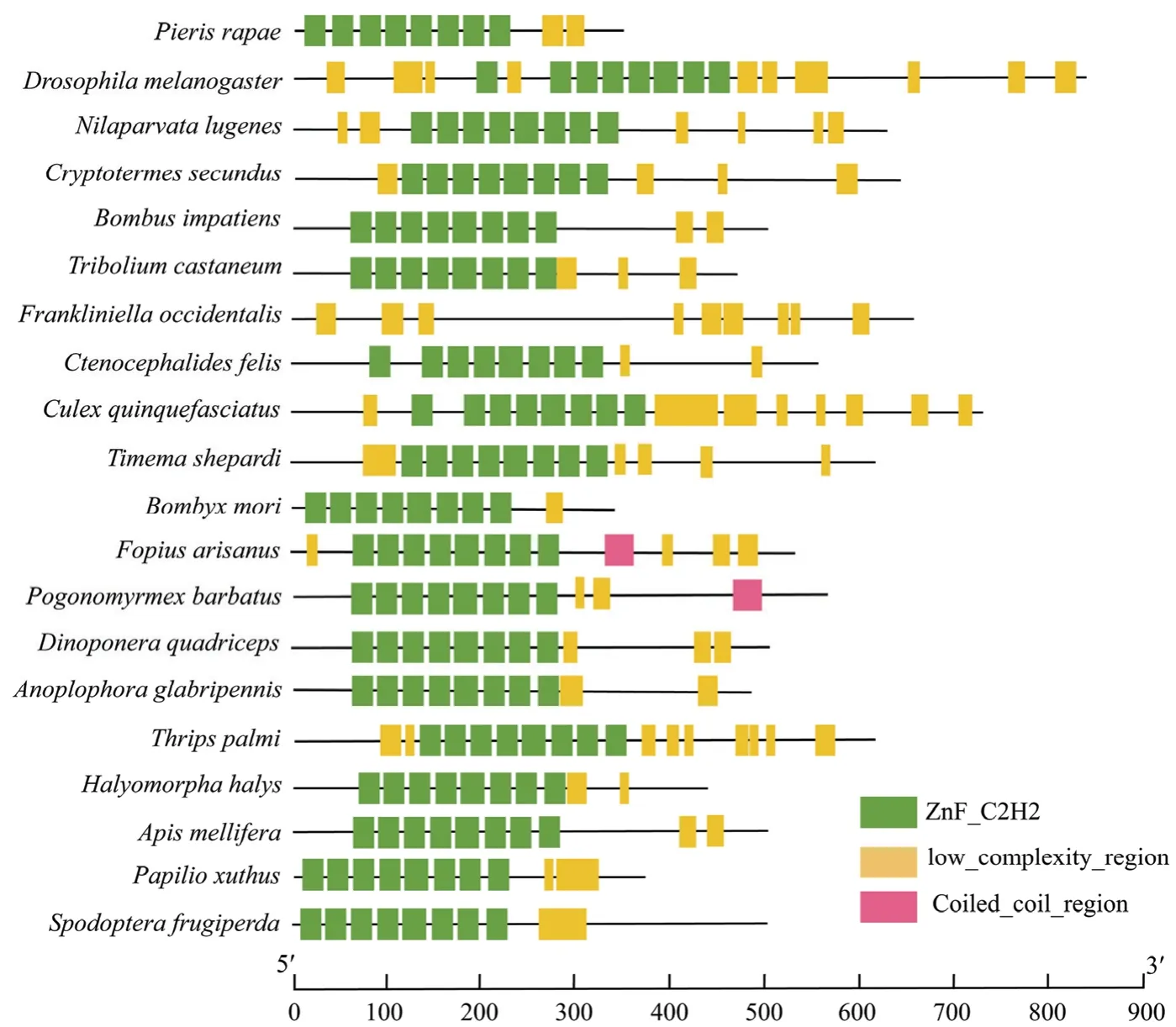
图5 昆虫Kr-h1 蛋白结构域预测Fig.5 Conserved domain prediction of insect Kr-h1 protein
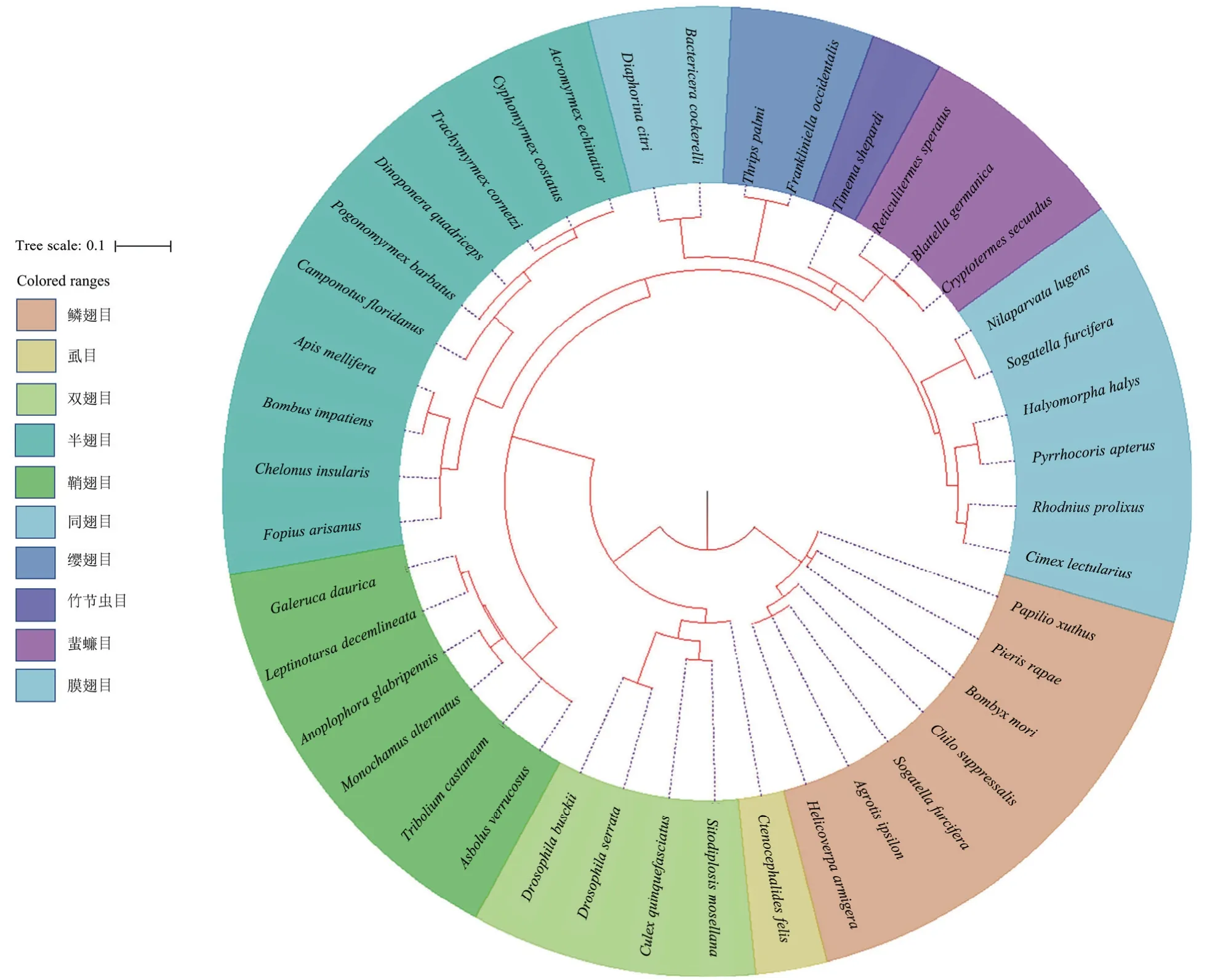
图6 昆虫Kr-h1 蛋白的系统进化树Fig.6 Phylogenetic tree based on insect Kr-h1 protein
2.5 系统发育进化分析
昆虫纲9 个目计40 种昆虫的系统发育分析结果如图6 所示,Kr-h1 蛋白在进化树分支上存在明显种属特征,同目昆虫多为单系群存在,表明Kr-h1 蛋白为直系同源,分化晚于目分化,如菜粉蝶Kr-h1 与同目的家蚕Kr-h1 最为接近。但半翅目为非单系群,有待进一步研究。
分别重构Zn1~Zn8 的锌指蛋白基因进化树图。结果如图7 所示,Zn1-8,不同昆虫的亲缘关系远近不一,表明不同锌指结构基因进化存在差异。Zn1 与Zn8 进化树中不同昆虫间较为分散,相互之间遗传距离较远,序列差异度大,即Zn1 与Zn8 保守性不足(图7A,图7H)。在Zn2 中可明显发现部分昆虫序列差异较小,这说明在昆虫长期进化过程中Zn2 的保守性较好(图7B),其余锌指结构亦呈现类似Zn2 特征。
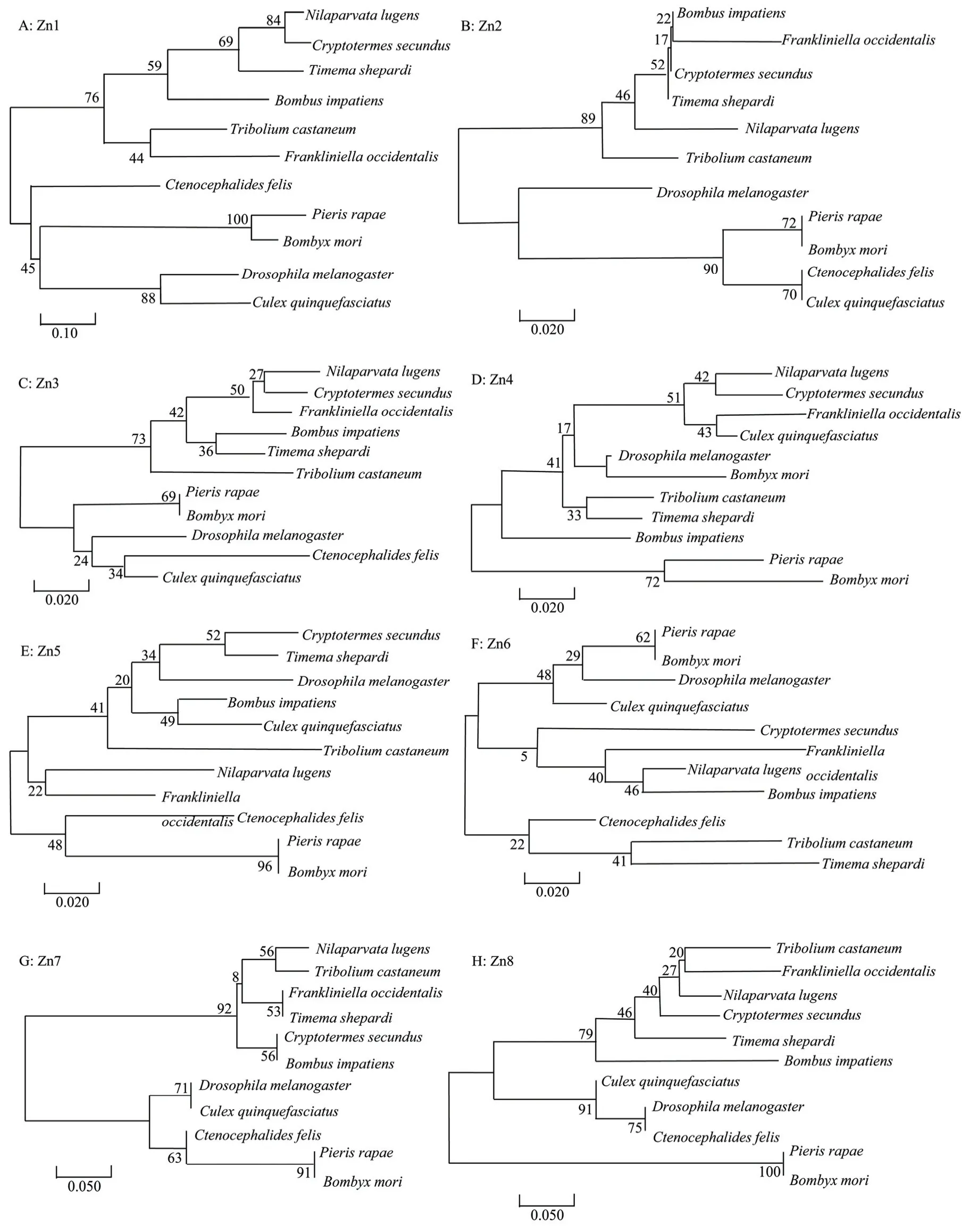
图7 昆虫Kr-h1 蛋白Zn1~Zn8 的系统发育分析Fig.7 Phylogenetic analysis based on Zn1―Zn8 of insect Kr-h1 protein
2.6 昆虫Kr-h1 基因的表达模式分析
从图8 中可知,Kr-h1 在幼虫阶段的表达明显高于蛹期。在幼虫早期阶段Kr-h1 的明显高表达,特别是果蝇中幼虫早期阶段的表达量数据达到了蛹期表达量的4 倍以上,在鳞翅目梨小食心虫中也有着相似的表达趋势。发育中期大部分昆虫Kr-h1 的表达量都有所回落,其中属于鳞翅目的梨小食心虫与鞘翅目的赤拟谷盗中这一趋势较为明显,提示与迅速生长与频繁蜕皮有关。在黑腹果蝇与梨小食心虫中,幼虫末期Kr-h1 的表达量与蛹期差距不大,但是在赤拟谷盗与桔小实蝇中却出现明显差距。在成虫阶段可见Kr-h1的表达有部分回升,例如黑腹果蝇与梨小食心虫。
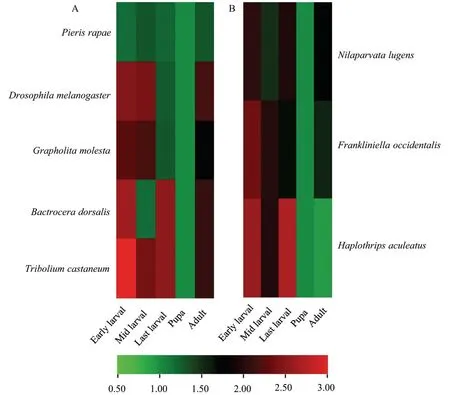
图8 昆虫Kr-h1 基因表达模式Fig.8 Insect Kr-h1 gene express pattern
在不完全变态昆虫中,同样体现出了与完全变态昆虫类似的表达模式,都与昆虫的发育阶段高度相关。例如在幼虫早期中高表达,幼虫中期表达下降,幼虫后期有所回升。由于不完全变态昆虫并没有蛹期,最后一个幼虫期Kr-h1 同样会出现低表达,这与完全变态昆虫中Kr-h1 在蛹期的表达趋势一致,体现出Kr-h1在完全变态昆虫或者不完全变态昆虫中表达模式高度相似。
3 讨论
本研究结果表明,Kr-h1 外显子数量保守,内含子长度变异较大。Kr-h1 蛋白二维与三维结构的保守性与8 个锌指结构的保守性,共同促进了Kr-h1 蛋白功能的稳定性。系统发育分析昆虫Kr-h1 为直系同源,亲缘关系与物种进化相吻合,基于锌指结构的系统发育则表现Kr-h1 不同模块进化中的差异。
基因结构分析结果表明在长期进化过程中Kr-h1 基因较为保守,断裂程度不高,由此推测其编码蛋白在不同昆虫中的结构变化不大且作用相似。结合进化树发现Kr-h1 基因结构的变化与昆虫的生活习性呈现一定关联性,在进化树中同属于一个单系群,同时基因结构也更为相似,这暗示着Kr-h1 的基因结构进化伴随着昆虫生活习性演化。此外,可变剪切如在果蝇体内存在着Kr-h1 的三种剪切亚型α、β与λ[16],亦有可能是进化的形式。
通过对于Kr-h1 蛋白理化性质与结构分析发现,Kr-h1 蛋白在不同昆虫中理化性质并没有体现出明显规律,但在大多数昆虫中都具有明显的丝氨酸偏好性,进一步通过磷酸化位点预测分析发现,这种丝氨酸偏好性与丝氨酸磷酸化调控Kr-h1 生物学活性有关[20]。二级结构元件组成分析发现Kr-h1 蛋白在不同昆虫中各二级结构比例较为稳定。三维结构预测、保守结构域及氨基酸序列分析显示,Kr-h1 蛋白在不同昆虫中具有8 个保守的锌指结构,其共有序列特征为:赖氨酸-X2~4-赖氨酸-X8~9-亮氨酸-X2-组氨酸-X3-组氨酸。进一步系统进化分析发现,这8 个锌指的保守性存在差异,处于首尾位置的Zn1 和Zn8 保守性较低,Zn2~Zn7 的保守性较高。推测这与不同物种间Kr-h1 的功能差异有关。同时,在少数昆虫中,亦发现可能存在Zn1 确实的情况[21],其具体机制有待进一步研究。
在表达模式分析中发现,Kr-h1 表达水平显示出了与发育阶段高度的相关性。在在幼虫早期高表达,不同物种幼虫期高低各异,但总体上幼虫中后期有所回落,蛹期(完全变态)或末龄若虫阶段(不完全变态)维持低水平表达,在成虫期又出现明显回升。成虫期Kr-h1 表达量的回升,考虑到Kr-h1 有着调控生殖行为,影响果蝇产卵的作用,推测昆虫在Kr-h1 在成虫阶段参与调控昆虫繁殖过程调控。同时,卵巢成熟与Kr-h1 蛋白表达的相关性,进一步提示Kr-h1 作为药物靶点的可行性[22]。此外不同组织内Kr-h1 的表达变化还有待探索,后续可以探索使用多种昆虫原始测序数据,进一步探究Kr-h1 的功能表达特征。
正如Gilbert[23]所述,昆虫发育的研究对于防治具有无可估量的价值,通过挖掘发育中的关键基因,既可直接采用RNA 干扰等措施直接防治,亦可为害虫防控策略的探索提供重要参考。因此,从发育分子生物学视角挖掘昆虫变态分子机制,可为菜青虫等害虫生物防治提供更多的防治策略与手段。通过菜粉蝶Kr-h1 基因及其编码蛋白的鉴定、相关保守结构域的进化分析和不同昆虫的表达模式分析,丰富了我们对昆虫Kr-h1 蛋白的认识,但是对于昆虫Kr-h1 蛋白功能方面的研究尚未完全清晰,而上述研究也为今后进一步研究昆虫Kr-h1 的功能以及其在昆虫变态发育过程中调控机制奠定了基础。Kr-h1 蛋白在昆虫变态发育过程中起到的作用不言而喻,因此上述对昆虫Kr-h1 基因及其编码蛋白的研究为寻找新型生物农药靶点提供了有利参考,为菜粉蝶等农业害虫的防治策略开辟了新思路,其实践意义重大。
