温度响应的黄曲霉毒素B1纳米抗体重组表达、复性及生物活性
2023-10-21张乐平李燕萍3李小江帅文苑何庆华3
张乐平,涂 追*,李燕萍3,李小江,帅文苑,张 航,何庆华3
(1.南昌大学 食品科学与资源挖掘全国重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
类弹性蛋白多肽(elastin-like polypeptide,ELP)是一种利用基因工程方法人工合成的蛋白质聚合物,具有良好的生物相容性[1-2]。ELP由n个重复氨基酸序列“V-PG-X-G”组成,其中残基“X”可以是除脯氨酸以外的任意氨基酸。当温度高于相变温度时,ELP具有从可溶状态向沉淀状态转变的能力[3-4]。除温度外,一定浓度的盐离子、pH值也可以诱发ELP的相变[5]。当温度降低、盐离子浓度降低或在其他刺激作用存在时,ELP的相变可逆[6]。在过去的20年里,已有使用ELP标签纯化蛋白质的各种方法。早在1999年,Meyer等[7]就将ELP与蛋白质融合,利用可逆相变循环(inverse transition cycling,ITC)使其从复杂混合物中分离出来,再利用蛋白酶将ELP标签切除掉。Shi Changhua等[8]开发了一种基于内含子剪接与双ELP标签的新型蛋白质纯化平台,纯化得到了4 种不同分子质量大小的目的蛋白。Coolbaugh等[9]将自切割内含子与ELP标签结合,于微滴定孔板中纯化了绿色荧光蛋白与半乳糖苷酶,开发了高通量纯化蛋白的亲和沉淀法。Fan Yamin等[10]使用分裂内含子与ELP标签,实现了目的蛋白与纯化标签间的受控切割。除此以外,利用亲和配体与ELP融合表达,可用于捕获和沉淀所需要的产物,避开随后从产物中切割ELP标签的步骤。Swartz等[11]将蛋白A的Z结构域与ELP标签融合表达,用于纯化单克隆抗体。Kostal等[12]利用细菌金属调节蛋白对DNA的特异亲和性以及ELP蛋白的相变特性实现了质粒DNA纯化。然而,ELP作为融合标签在蛋白纯化方面的应用广泛,却鲜少见于小分子的纯化处理。
真菌毒素是食品中常见的小分子污染物,其种类繁多、毒性强、不易降解,对人体健康存在着极大威胁。日常生活中的食品种类极多、成分复杂,真菌毒素含量通常又极低,使用分析仪器直接定量检测很难实现,对食品样品进行前处理以实现对目标检测物的富集纯化有助于提高检测灵敏度[13]。目前,各类食品中真菌毒素样品前处理的方法主要有液相萃取法[14]、固相萃取法[15]、磁颗粒辅助提取法[16]、超声辅助提取法[17]、QuEChERS(quick, easy, cheap, effective, rugged and safe)法[18]、免疫亲和柱法[19]等。其中,免疫亲和柱法虽然具有操作简便、灵敏度高、特异性强等优点,也是国家标准中规定的黄曲霉毒素提取方法,却存在制作工艺复杂、成本高昂、污染环境等问题。
为了解决免疫亲和柱制备过程中抗体偶联的不可控性,降低成本,建立环境友好型的黄曲霉毒素B1(aflatoxin B1,AFB1)纯化新方法,本研究构建纳米抗体与不同长度ELP融合表达的重组载体,将转化大肠杆菌表达后的4 种蛋白分别以稀释复性、ITC纯化、透析复性、柱上复性的方式进行复性。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析4 种复性方式得到4 种蛋白纯度与含量,间接竞争酶联免疫吸附实验(enzymelinked immunosorbent assay,ELISA)测定其IC50差异,相对浊度分析测定其相变温度,圆二色谱分析其二级结构组成。旨在为后续建立以纳米抗体作为识别单元的可控相变生物纯化介质,用于AFB1检测样品前处理提供基础。
1 材料与方法
1.1 材料与试剂
宿主菌大肠杆菌DH5α和BL21(DE3)、表达载体pET30a-G8-GFP由本实验室保存;载体pUC57-ELP10由生工生物工程(上海)股份有限公司合成。
限制性内切酶(EcoRI、DraIII、BglI)、T4-DNA连接酶 纽英伦生物技术(北京)公司;限制性内切酶(SfiI、NotI)、rTaqDNA聚合酶、dNTP 宝日医生物技术(北京)有限公司;尿素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、还原型谷胱甘肽、氧化型谷胱甘肽、精氨酸、3,3’,5,5’-四甲基联苯胺单组分显色液 索莱宝生物科技有限公司。
1.2 仪器与设备
Nanodrop1000微量分光光度计、多功能读数仪、低温高速离心机 赛默飞世尔上海(仪器)有限公司;SDS-PAGE电泳仪、聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像系统 美国Bio-Rad公司;CT62A全自动灭菌锅 驰通仪器(上海)有限公司;JY92-IIDN超声破碎仪 宁波新艺超声设备有限公司。
1.3 方法
1.3.1 G8-ELP20、G8-ELP40、G8-ELP60、G8-ELP80融合表达载体的构建
退火寡核苷酸单链引物H1-F和H1-R见表1,退火条件设定为:95 ℃变性2 min;95 ℃降温到25 ℃,每8 s降低0.1 ℃,共设置700 个循环;4 ℃冷却10 min;以SfiI和NotI双酶切pET30a-G8-GFP载体,与退火寡核苷酸片段进行连接,得到改造后的重组载体pET30a-G8(R)。
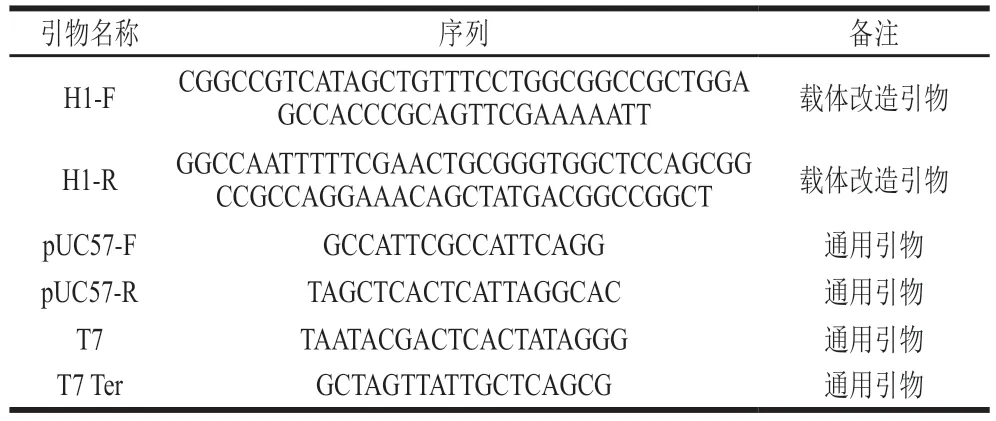
表1 载体构建相关引物序列Table 1 Primer sequences used for vector construction
ELP重复片段的连接通过递归定向连接法[20]实现,实验原理如图1所示。以EcoRI和DraIII双酶切pUC57-ELP10载体,回收较长片段,同时以EcoRI和BglI双酶切pUC57-ELP10载体,回收较短片段,16 ℃过夜连接得到重组载体pUC57-ELP20;以EcoRI和DraIII双酶切pUC57-ELP20载体,回收较长片段,同时以EcoRI和BglI双酶切pUC57-ELP20载体,回收较短片段,连接后得到重组载体pUC57-ELP40;以EcoRI和DraIII双酶切pUC57-ELP40载体,回收较长片段,同时以EcoRI和BglI双酶切pUC57-ELP20载体,回收较短片段,连接后得到重组载体pUC57-ELP60;以EcoRI和DraIII双酶切pUC57-ELP40载体,回收较长片段,同时以EcoRI和BglI双酶切pUC57-ELP40载体,回收较短片段,连接后得到重组载体pUC57-ELP80。将上述载体转化后挑取单菌落提取质粒进行PCR验证插入片段大小是否正确,并以pUC57-F/pUC57-R引物(表1)测序确认核苷酸序列的正确性。

图1 递归定向连接得到多重复序列Fig.1 Cloning of ELP of different lengths by RDL
以SfiI和NotI双酶切pET30a-G8(R),回收较长载体片段,以SfiI和NotI双酶切pUC57-ELP20、pUC57-ELP40、pUC57-ELP60、pUC57-ELP80重组载体,回收较短目的片段,连接后得到重组表达载体pET30a-G8-ELP20、pET30a-G8-ELP40、pET30a-G8-ELP60、pET30a-G8-ELP80,转化后挑取单菌落提取质粒进行XbaI和NotI双酶切验证插入片段大小是否正确,并以T7-F/T7 Ter-R引物(表1)测序确认核苷酸序列的正确性。
1.3.2 重组蛋白G8-ELP20、G8-ELP40、G8-ELP60、G8-ELP80的表达
将携带重组载体的大肠杆菌BL21(DE3)菌株接种于含50 µg/mL卡那霉素的5 mL LB(Luria-Bertani)培养基中,37 ℃、220 r/min振荡培养12 h后,以1%接种量转接至含50 µg/mL卡那霉素的800 mL LB培养基中,于两只2 L摇瓶中37 ℃、220 r/min扩大培养至OD600nm为0.6~0.8,加入IPTG至终浓度为0.5 mmol/L,30 ℃过夜诱导表达,菌液离心后收集菌体沉淀,用80 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.0)重悬,分装后于超声破碎仪中破碎,破碎条件设置为超声4 s,间歇6 s,总破碎时间8 min,功率200 W。6 500 r/min离心15 min收集破碎沉淀,80 mL洗涤缓冲液洗涤两次后,以16 mL含8 mol/L尿素的变性缓冲液4 ℃过夜溶解,变性溶解液6 500 r/min离心15 min,弃沉淀,上清液等体积分成4 份,分别采取不同的复性方式进行复性。
1.3.3 融合蛋白包涵体的不同复性方式
稀释复性:取4 mL融合蛋白变性溶解液,每隔2 h加入等体积的复性缓冲液,倍比稀释直至尿素终浓度为2 mol/L,将稀释复性后得到的16 mL蛋白溶解液过镍柱纯化,以含2 mol/L尿素的20、50、80 mmol/L咪唑溶液洗杂,含2 mol/L尿素的100 mmol/L咪唑溶液洗脱,将得到的蛋白洗脱液置于透析袋中,于含2 mol/L尿素的PBS中透析12 h,Bradford法测定蛋白浓度。
透析复性:取4 mL融合蛋白变性溶解液过镍柱纯化,以含8 mol/L尿素的20、50、80 mmol/L咪唑溶液洗杂,含8 mol/L尿素的100 mmol/L咪唑溶液洗脱,将得到的蛋白洗脱液置于透析袋中,每隔12 h换一次透析液,直至将蛋白溶解液替换为含2 mol/L尿素的PBS,Bradford法测定蛋白浓度。
柱上复性:取4 mL融合蛋白变性溶解液过镍柱,以含6、4、2 mol/L尿素的复性缓冲液依次缓慢冲洗5~10 个柱体积,最后以含2 mol/L尿素的20、50、80 mmol/L咪唑溶液洗杂,含2 mol/L尿素的100 mmol/L咪唑溶液洗脱,将得到的蛋白洗脱液置于透析袋中,于含2 mol/L尿素的PBS中透析12 h,Bradford法测定蛋白浓度。
ITC纯化:取4 mL融合蛋白变性溶解液,每隔2 h加入等体积的复性缓冲液,倍比稀释直至尿素终浓度为2 mol/L,向稀释复性后得到的16 mL蛋白溶解液中加入终浓度为2 mol/L的NaCl,37 ℃孵育30 min,12 000 r/min离心5 min,弃上清液,沉淀以含2 mol/L尿素的PBS重悬,Bradford法测定蛋白浓度。
复性后的蛋白得率由下式计算得出:
1.3.4 间接竞争ELISA测定重组蛋白结合活性
棋盘滴定确定间接竞争ELISA的最佳包被抗原抗体浓度。4 ℃过夜包被最佳浓度的人工抗原AFB1-牛血清蛋白,含吐温的PBS(PBST)洗板3 次;4%脱脂乳37 ℃封闭2 h,PBST洗板3 次;以终质量浓度100 ng/mL为AFB1标准品最大竞争浓度,倍比稀释16 个梯度,每个梯度设置3 个平行,与人工抗原竞争孔中加入的不同长度、不同复性方式获得的纳米抗体融合蛋白,37 ℃孵育1 h,PBST洗板3 次;加入HRP标记抗His标签的二抗,37 ℃孵育1 h,PBST洗板3 次;显色终止后测定孔中OD450nm,计算每种蛋白的IC50。
1.3.5 融合蛋白相变温度测定
取以稀释复性方式纯化得到的4 种长度融合蛋白储液,将其浓度均一为15 μmol/L,各加入浓度为5 mol/L的氯化钠200 μL,使氯化钠的终浓度为1 mol/L,每种蛋白取200 μL于酶标孔中,并设置3 个平行,在温度由16 ℃升至52 ℃的过程中,每升温2 ℃记录一次OD350nm,以温度为横坐标、相对浊度为纵坐标作图,斜率最大处即为该融合蛋白的相变温度。
1.3.6 融合蛋白二级结构测定
取以稀释复性方式纯化得到的4 种融合蛋白储液,将其质量浓度均一为0.3 mg/mL,取800 µL置于圆二色谱仪样品检测瓶中,设定二级结构测定程序,同时检测空白背景值,将减去空白背景值后的数据导入在线拟合网站Dichroweb进行拟合[21],得到4 种融合蛋白的峰图与二级结构计算表。
1.4 数据处理
重组蛋白灵敏度数据使用Origin 2021软件进行处理;蛋白质二级结构数据由在线网站Dichroweb获得;电泳图使用Quantity one进行分析。
2 结果与分析
2.1 表达载体构建
表达载体构建过程中重复序列的延长是以递归定向连接方式实现。如图2A所示,分别得到了ELP20、ELP40、ELP60、ELP80序列。以SfiI和NotI分别双酶切不同长度的ELP序列,克隆到SfiI和NotI双酶切过的pET30a载体上,如图2B所示,分别得到了不同长度的重组表达载体。
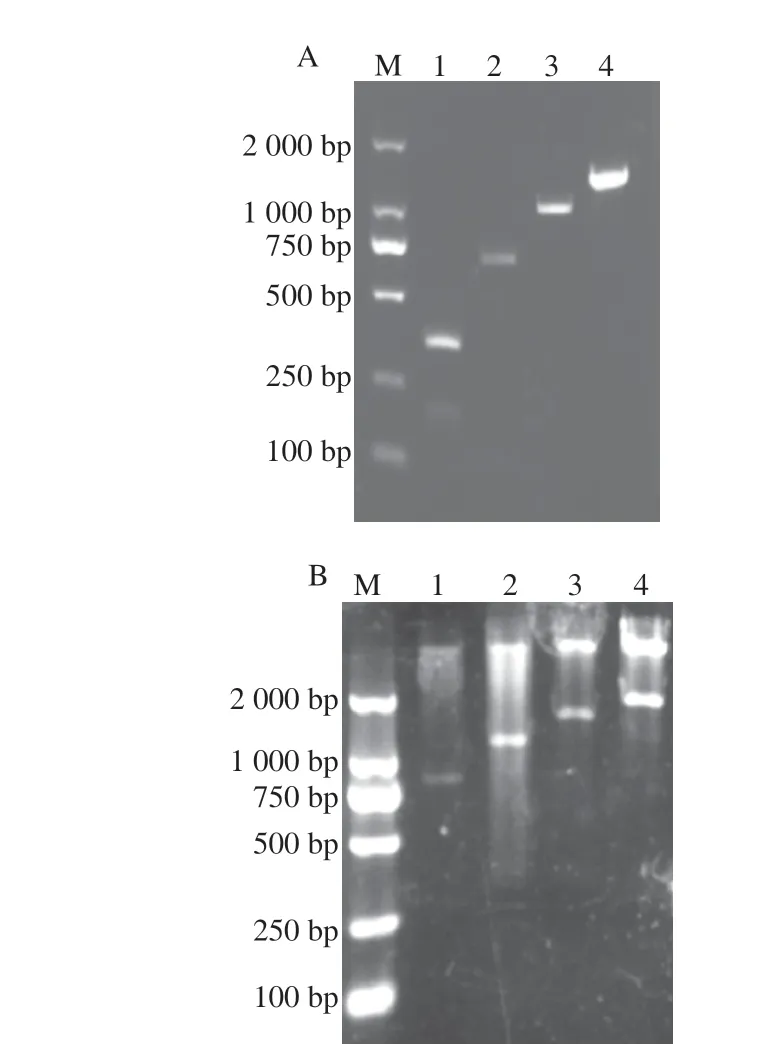
图2 不同长度ELP片段及表达载体双酶切验证Fig.2 Verification of ELP of different lengths and expression vectors by double enzyme digestion
2.2 蛋白表达与复性结果
4 种融合蛋白的理论分子质量大小分别为26.53、34.87、43.22、51.56 kDa。SDS-PAGE结果显示,诱导后的融合蛋白大小与预期一致(图3)。4 种融合蛋白诱导表达破碎上清液中目标蛋白含量极少,绝大部分以包涵体形式存在于超声破碎沉淀中(图4)。将4 种融合蛋白的包涵体分别用4 种复性方法进行了复性,SDS-PAGE及Quantity one软件分析结果显示,4 种融合蛋白包涵体变性溶解液中目的蛋白含量均在50%以上(图5,泳道1),4 种复性方式所得的融合蛋白纯度差异不显著(图5,泳道2~5);结合上样浓度与收获体积计算蛋白得率,4 种复性方式中,ITC纯化得率最高(表2)。

图3 融合蛋白结构示意图与诱导前后SDS-PAGE分析Fig.3 Structural diagrams of and SDS-PAGE patterns of fusion proteins before and aft.er induction

图4 破碎上清液与破碎沉淀Fig.4 SDS-PAGE patterns of proteins in supernatant and precipitate from disrupted cells


图5 4 种复性方式得到4 种不同长度的蛋白Fig.5 SDS-PAGE patterns of four of proteins of different lengths obtained by four refolding methods
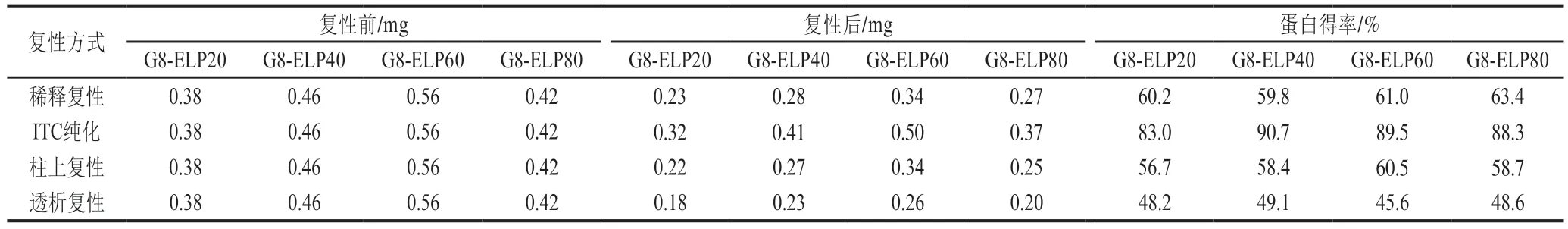
表2 不同复性方式所得重组蛋白得率Table 2 Yield of recombinant proteins obtained by different refolding methods
2.3 纳米抗体灵敏度测定
间接竞争ELISA测定不同复性方式得到不同长度融合蛋白的IC50。图6结果显示,4 种复性方式中,稀释复性的IC50为4 种复性方式中最低,4 种蛋白IC50分别为6.24、5.99、5.88、4.35 ng/mL,提示稀释复性的方法更有利于重组蛋白重新折叠;4 种融合蛋白中,G8-ELP80的IC50最低,表明G8-ELP80灵敏度最高。

图6 4 种蛋白的灵敏度测定Fig.6 Sensitivity of four proteins
2.4 融合蛋白相变温度测定
当溶液中半数蛋白发生聚集时的温度为该ELP标记蛋白的相变温度,在以温度为横坐标、相对浊度为纵坐标的图中表现为斜率变化最剧烈处所对应的横坐标温度值。融合蛋白的相变温度与多种因素有关,如蛋白浓度、盐离子种类、盐离子浓度等[22]。将4 种融合蛋白稀释至终浓度为15 μmol/L,在NaCl浓度为1 mol/L时,G8-ELP20、G8-ELP40、G8-ELP60、G8-ELP80的相变温度分别为45、38、32、28 ℃(图7),符合ELP重复数越多相变温度越低的相变规律,与预估结果一致。
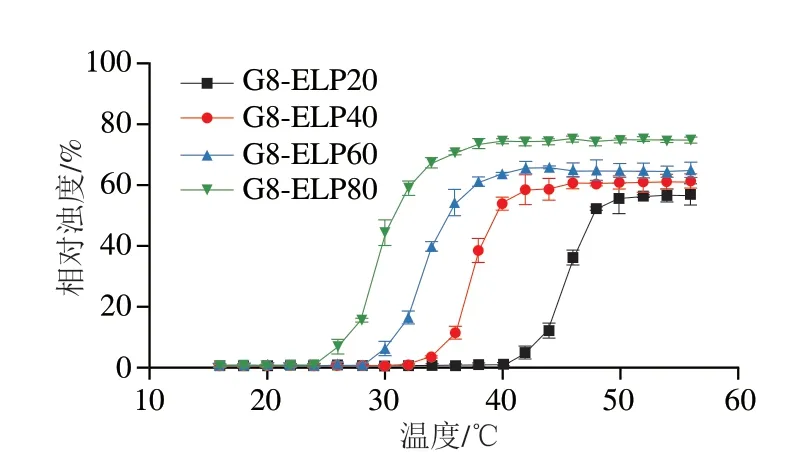
图7 融合蛋白相变温度Fig.7 Phase transition temperatures of fusion proteins
2.5 圆二色谱结果分析
纳米抗体的结构是由9 个反向平行的β-折叠片层(A-B-C-D-E-F-G-H-I)组成,它们之间通过二硫键和链间氢键连接在一起[23];ELP中含有大量重复序列VPGXG,当环境温度低于相变温度时,重复序列中的Pro-Gly是β-转角结构[24]。结果显示,4 种长度融合蛋白二级结构中,α-螺旋所占比例极低,β-结构是融合蛋白主要二级结构,与理论预估结果一致(表3);随着重复序列数的升高,α-螺旋、β-折叠、β-转角比例均有所升高,无规卷曲结构比例则有所降低,且序列数越多此规律越不显著;值得注意的是,G8-ELP80中α-螺旋的比例较G8-ELP20相对升高了75%,提示一定范围内α-螺旋结构的升高可能与纳米抗体的灵敏度相关。
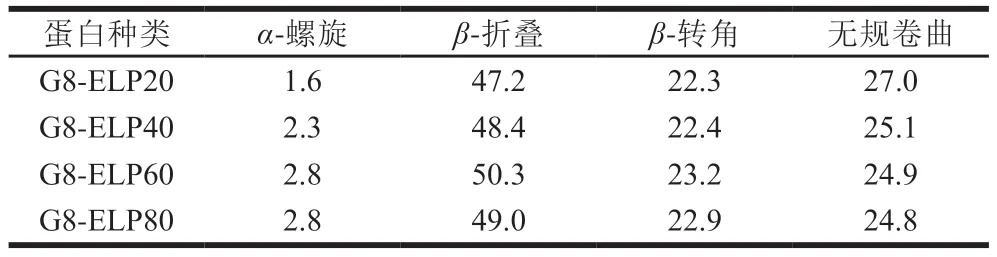
表3 不同长度融合蛋白二级结构含量Table 3 Secondary structure contents of fusion proteins of different lengths%
3 讨 论
当重组蛋白在大肠杆菌细胞中高度表达时,会形成高密度、不溶性的蛋白聚集体,由于错误折叠而不具备生物活性。包涵体中,重组蛋白的含量约为50%,其他成分为杂蛋白、脂多糖、质粒DNA等[25]。当重组蛋白在细胞中以包涵体形式表达时,虽然纯化步骤较可溶性表达繁琐,但也存在一定优点,大肠杆菌内部的蛋白酶未必能降解结构致密的包涵体,可实现重组蛋白的高表达,获得质量可观的重组蛋白[26];包涵体中的重组蛋白纯度较高,便于纯化分离;对于一些在天然构象下对细胞存在毒害作用的蛋白质,包涵体表达是一种可行的方法[27]。包涵体变性溶解后的复性方法主要有稀释复性、透析复性、超滤复性、柱上复性等。
以ELP作为纯化标签为目的蛋白的纯化提供了一种非色谱分离的方法。相较于传统的离子交换层析、疏水层析、亲和层析,ELP标签赋予融合蛋白相变特征,通过简单的ITC即可实现目的蛋白的分离纯化,具有经济、操作方便、损耗低等优点[28]。以往研究表明,在大肠杆菌中外源蛋白与ELP标签融合蛋白表达时多数为可溶性表达,利用ELP标签的ITC,已成功纯化出绿色荧光蛋白(green fluorescent protein,GFP)、硫氧还蛋白、氯霉素乙酰转移酶等[29]重组蛋白,但由于ELP标签相变性质受浓度影响较大,当融合蛋白的表达浓度低于1 μmol/L时,目的蛋白的分离纯化效率极低[30]。
本研究中,18 ℃低温过夜诱导后可溶性表达量依然较低,无法使用ITC进行纯化,使用镍柱虽然可以纯化到有活性的目的蛋白,但是浓度却极低,不能满足后续捕获AFB1后整体相变的要求。将存在于菌体沉淀中的重组蛋白包涵体变性溶解后,尝试了不同的复性方式对其进行复性,实验过程中,透析或超滤将尿素浓度降至2 mol/L以下时,出现蛋白溶液浑浊的现象,提示蛋白发生聚集,在PBS(pH 7.0)中不能稳定存在。已有研究报道,纳米抗体在严酷的条件下具有很强的耐受性,并能抵抗化学和热变性[31],故而将其溶解在含2 mol/L尿素的PBS中测定其蛋白特性并计算复性比例。4 种复性方式中,稀释复性得到的重组蛋白灵敏度最高;4 种重组蛋白中,G8-ELP80的灵敏度最高,IC50仅为4.35 ng/mL;相变温度最低,在体系中氯化钠浓度为1 mol/L、重组蛋白浓度为15 µmol/L时其相变温度仅为28 ℃,表明在37 ℃条件下即可以先后进行AFB1的捕获和聚集,避免了因温度变化而导致回收率降低。
4 结 论
本研究成功获得了4 种具有温度刺激响应性和抗原识别特异性的纳米抗体,并对4 种纳米抗体的结合活性、复性方法、相变温度、蛋白质二级结构等性质进行了系统研究,为易形成包涵体的融合蛋白复性时变性处理剂的去除程度提供新思路。后续将以此为基础,建立以纳米抗体为核心的全生物合成纯化介质,用于AFB1样品前处理,研究结果可为纳米抗体的进一步功能化巩固基础。同时,已有借助ELP标签的单克隆抗体相分离免疫检测[32-33],ELP标签功能化的纳米抗体或可依靠其在均相检测体系中的优势在快速检测领域取得突破,如改进荧光共振能量转移、开发生物传感器等。
