婴儿配方乳粉中食源性致病菌双重ERA快速检测方法的建立
2023-10-21林志伟王迎春吴占文李红娜杨艳歌
林志伟,王 帅,王迎春,吴占文,李 涛,李红娜,杨艳歌,*,袁 飞,*
(1.黑龙江八一农垦大学农学院,黑龙江 大庆 163000;2.中国检验检疫科学研究院,国家市场监管重点实验室(食品质量与安全),北京 100176;3.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163000)
婴儿食品安全关乎下一代健康成长,千万家庭的幸福和国家民族的未来。研究显示,0~6 个月婴幼儿的肠道菌群尚处于发育阶段,肠道中双歧杆菌等有益菌尚未占据优势[1]。一旦误食了含有食源性致病菌的婴儿配方乳粉,极易导致结肠炎、菌血症等疾病的发生,危害婴儿的生命安全。乳粉中常见的食源性致病菌主要有克罗诺杆菌、沙门氏菌、单核细胞增生李斯特菌及金黄色葡萄球菌等。克罗诺杆菌旧称阪崎肠杆菌,对各年龄段人群均具有感染性,尤其是免疫功能低下或不健全的老年人和婴儿[2]。婴儿感染后常出现脑膜炎、菌血症及坏死性小肠结肠炎等症状[3],且致死率高达40%~80%[4-5]。沙门氏菌是一类在环境中广泛存在且能够引发食物中毒的革兰氏阴性杆菌[6],据报道,全球每年大约有9 000多万 例的沙门氏菌感染事件发生[7]。单核细胞增生李斯特菌及金黄色葡萄球菌是两类会导致食物中毒的革兰氏阳性菌[8],误食污染这2 类细菌的乳粉会导致婴儿出现单核细胞增多、脑膜炎、败血症等症状[9],严重威胁婴儿的生命安全。
目前微生物检测采用的标准方法是微生物培养法[10],该方法虽然易于推广、结果准确,但耗时较长,结果易受操作人员的技术和经验影响[11]。为了弥补传统培养法的不足,研究者们开发了多种新型检测手段。如王仲敏等[12]根据产酸克雷伯氏菌半乳糖醛酸酶基因建立了实时荧光聚合酶链式反应(polymerase chain reaction,PCR)法,检测时间相较于传统培养法缩短了一半。Asgari等[13]将表面增强拉曼光谱与免疫探针技术结合,开发了一种能够同时分离检测沙门氏菌和大肠杆菌O157:H7的快速检测方法,该方法从样品制备到出具检测结果只需2 h。Yan Wenjing等[14]基于基质辅助激光解吸/电离飞行时间质谱技术结合主成分分析,开发了一种能够同时检测6 种食源性致病菌的快速检测方法,具有速度快、精度高的特点。这些方法虽然提高了检测的灵敏度、缩短了检测时间,但均需要光谱仪和质谱仪等大型仪器设备,不便用于现场快速检测。因此,急需开发能够摆脱大型仪器依赖的新型检测手段。
酶促重组等温扩增(enzymatic recombinase amplification,ERA)技术是近些年新研发的一种等温扩增技术[15-16]。该技术能够在常温环境下,依靠体系中的重组酶等组分,完成目标核酸片段的指数级扩增。相对于传统的PCR技术,该技术操作简单、反应速度快、灵敏度高,且对仪器设备要求低,可在非实验室环境条件下进行操作。该技术现已应用于临床诊断、腐败菌检测、动物病毒检测等诸多方面[16-18],但应用于食源性致病菌检测的研究较少,且多针对单一检测对象。本研究针对婴儿配方乳粉中易污染的克罗诺杆菌、沙门氏菌、单核细胞增生李斯特菌及金黄色葡萄球菌4 种食源性致病菌,建立双重ERA快速检测方法,以期为婴儿配方乳粉中致病菌的筛查提供快速检测手段,同时也为其他食源性病原菌的检测提供新思路。
1 材料与方法
1.1 材料与试剂
实验用菌分别来源于美国菌种保藏中心(American Type Culture Collection,ATCC)、中国医学细菌菌种保藏管理中心(National Center for Medical Culture Collections,CMCC)、德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen,DSMZ)、英国典型菌种保藏中心(National Collection of Type Cultures,NCTC)和中国检验检疫微生物菌种保藏管理中心(Inspection and Quarantine Culture Collection,IQCC),以上所有菌均保藏于IQCC。信息详见表1。市售婴儿配方乳粉样品采购于北京超市和电商。
脑心浸液肉汤(brain heart infusion broth,BHIB)培养基、脑心浸液琼脂(brain heart infusion agar,BHIA)培养基、LB肉汤(LBB)培养基 英国Oxoid公司;PrepManTMUltra样品制备试剂 美国Thermo Fisher公司;荧光型核酸扩增试剂盒(ERA法) 苏州先达基因科技有限公司。
1.2 仪器与设备
Pico 17离心机 美国Thermo Fisher Scientific公司;D1008E掌上离心机 美国Scilogex公司;BioSpec-nano紫外-可见光分光光度仪 日本岛津公司;VORTEX 3涡旋混合器 德国IKA公司;3850V高压灭菌锅 以色列Tuttnauer公司;DH-420电热恒温培养箱 美国Memmert公司;HH-2水浴锅 金坛市白塔新宝仪器厂;mq-3164便携式迷你qPCR仪 上海翊辉生物科技有限公司。
1.3 方法
1.3.1 引物来源
从G e n B a n k 数据库中提取阪崎克罗诺杆菌(C.sakazakii)、丙二酸盐克罗诺杆菌(C.malonaticus)、苏黎世克罗诺杆菌(C.turicensis)、莫金斯克罗诺杆菌(C.m u y t j e n s i i)、康帝蒙提克罗诺杆菌(C.c o n d i m e n t i)、尤尼沃斯克罗诺杆菌(C.universalis)和都柏林克罗诺杆菌(C.dublinensis)以及其他近源食源性致病菌的外膜蛋白X(outer membrane protein X,ompX)基因序列,利用Clustal X软件进行序列比对。以阪崎克罗诺杆菌ompX基因(登录号:NZ_CP027107.1)为靶序列,在属间保守区域和属间差异性区域设计克罗诺杆菌ERA引物探针。沙门氏菌、单核细胞增生李斯特菌及金黄色葡萄球的引物探针引自文献[19-21]报道,此时探针的荧光标记统一为FAM,通过比较扩增效果进行筛选。对筛选的探针序列进行不同荧光标记,序列及来源信息详见表2,均由北京六合华大基因科技有限公司合成。
1.3.2 菌分离培养及基因组DNA提取
蘸取菌液在BHIA培养基表面划线培养,37 ℃培养18 h,挑取单菌落加入到5 mL的BHIB培养基中培养12 h。取1 mL菌液置于1.5 mL离心管中16 000×g离心2 min,弃上清液后加入100 μL PrepManTMUltra进行DNA提取,涡旋振荡混匀,100 ℃加热5 min,16 000×g离心2 min,取50 μL上清液即为DNA模板,测其浓度后于-20 ℃保存[23]。
1.3.3 反应体系与检测程序
ERA荧光法反应体系参照荧光型核酸扩增试剂盒(ERA法)使用说明书制备预混液,取混匀后的预混液47 μL至ERA酶粉反应管,模板量均为1 μL,向管盖滴加2 μL激活剂,盖紧后涡旋瞬时离心,放入便携式迷你qPCR仪进行ERA反应。反应程序为第1阶段39 ℃、1 s;第2阶段39 ℃、14 s,共40 个循环,第2阶段进行荧光信号收集。FAM荧光通道检测对象为克罗诺杆菌、HEX荧光通道检测对象为沙门氏菌、ROX荧光通道检测对象为金黄色葡萄球菌、Cy5荧光通道检测对象为单核细胞增生李斯特菌。
1.3.4 引物探针筛选
分别以表1所列的克罗诺杆菌属细菌、沙门氏菌属细菌、单核细胞增生李斯特菌以及金黄色葡萄球菌的基因组DNA为模板,分析相关文献中[20-27]引物探针的扩增效率和属内覆盖度,确定最优引物探针。然后对筛选的引物探针进行特异性分析,分别以阪崎克罗诺杆菌ATCC29544、单核细胞增生李斯特菌ATCC15313、肠炎沙门氏菌ATCC10708、金黄色葡萄球菌CMCC26003的基因组DNA为阳性对照,以非靶标菌基因组DNA为阴性对照,以无菌ddH2O为空白对照进行ERA反应。所有样品的基因组DNA质量浓度统一为10 ng/μL,每次实验2 个平行,重复实验3 次。
1.3.5 双重ERA检测方法的建立
分别将克罗诺杆菌和单核细胞增生李斯特菌、沙门氏菌和金黄色葡萄球菌的引物探针两两组合,混合加入同一反应体系,基因组DNA模板加量为10 ng/μL,以无菌ddH2O为阴性对照,分析引物探针的交叉反应性,确定双重反应的最优组合方式。
1.3.6 双重ERA检测方法反应体系优化
1)引物浓度优化:将ERA反应预混液中每种引物(浓度均为10 μmol/L)的体积分别调整为1.5、2、2.5、3、3.5、4 μL,分别以阪崎克罗诺杆菌ATCC29544和单核细胞增生李斯特菌ATCC15313、肠炎沙门氏菌ATCC10708和金黄色葡萄球菌CMCC26003的基因组DNA为模板进行ERA反应,每种菌基因组DNA质量浓度统一为10 ng/μL,根据扩增曲线荧光强度确定双重ERA检测反应的最佳引物浓度。实验过程中以无菌ddH2O为空白对照,每次实验2 个平行,重复实验3 次。
2)探针浓度优化:引物体积按照上述的优化结果,将探针(浓度均为10 μmol/L)体积分别调整为0.4、0.5、0.6、0.7、0.8、0.9 μL,分别以阪崎克罗诺杆菌ATCC29544和单核细胞增生李斯特菌ATCC15313、肠炎沙门氏菌ATCC10708和金黄色葡萄球菌CMCC26003的基因组DNA为模板进行ERA反应,基因组DNA质量浓度统一为10 ng/μL,根据扩增曲线荧光强度确定双重ERA检测反应最佳的探针浓度。实验过程中以无菌ddH2O为空白对照,每次实验2 个平行,重复实验3 次。
1.3.7 双重ERA检测方法灵敏度检测
为进一步分析建立的双重ERA检测方法的灵敏度,将模板DNA浓度分别稀释为101、100、10-1、10-2ng/μL,采用1.3.6节确定的ERA反应体系进行实验,分析双重ERA检测的灵敏度。实验过程中以无菌ddH2O为空白对照,每次实验2 个平行,重复实验3 次。
1.3.8 双重ERA检测方法人工污染样品
取单菌落加入至10 mL离心管中,37 ℃培养48 h使细菌生长达到稳定期,作为后续实验用的种子液。将种子液以1%接种量接入LBB培养基,37 ℃增菌培养12 h,梯度稀释后通过平板计数法对生长量进行测算,确定4 种细菌在这一培养条件下的生长量。按上述操作重新培养菌液12 h,根据生长量计算,使用无菌水稀释至100 CFU/mL。
称取25 g婴儿配方乳粉为基质,加入225 mL LBB培养基制成均质液。向均质液中分别添加2.25 mL上述100 CFU/mL的阪崎克罗诺杆菌ATCC29544和单核细胞增生李斯特菌ATCC15313、肠炎沙门氏菌ATCC10708和金黄色葡萄球菌CMCC26003菌液,即每种菌的污染量为1 CFU/mL,37 ℃增菌培养2、4、6 h后按1.3.7节方法提取基因组DNA。分析人工污染样品的检出限。实验过程中以无菌ddH2O为空白对照,重复实验3 次。
1.3.9 市售样品检测
购买的17 份婴儿配方乳粉,按1.3.8节方法取样均质后增菌培养12 h,采用1.3.2节方法进行基因组DNA提取。分别以中华人民共和国出入境检验检疫行业标准SN/T 1870—2016《出口食品中食源性致病菌检测方法 实时荧光PCR法》[28]、SN/T 1059.7—2010《进出口食品中沙门氏菌检测方法 实时荧光PCR法》[29]和SN/T 5224—2019《出口食品中单核细胞增生李斯特菌检验方法 实时荧光PCR内标法》[30]规定的实时荧光PCR法和双重ERA法进行检测,通过检测结果分析建立的双重ERA法的检测效果,实验过程中以无菌ddH2O为空白对照,重复实验3 次。
2 结果与分析
2.1 4 种病原菌ERA检测引物探针筛选
根据文献[16]报道,重组酶介导等温核酸扩增技术(recombinase aided amplification,RAA)、重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)和ERA在原理上有一定的相似性,通过检索发现沙门氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌有RAA或RPA检测引物探针。因此对文献中已报道的4 组沙门氏菌、4 组单核细胞增生李斯特菌、1 组金黄色葡萄球菌以及本研究设计的3 组克罗诺杆菌引物探针进行ERA检测效果分析。结果显示,本研究设计的AF2-1/AR2-1/AP2引物探针组合对克罗诺杆菌具有良好的扩增效率,且对属内菌株:阪崎克罗诺杆菌ATCC29544、莫金斯克罗诺杆菌ATCC51329、丙二酸盐阳性克罗诺杆菌DSM18702、都柏林克罗诺杆菌DSM18705、尤尼沃斯克罗诺杆菌NCTC9529的覆盖性良好(图1A)。文献[20-22]报道的引物探针分别对沙门氏菌、单核细胞增生李斯特菌、金黄色葡萄球菌具有良好的扩增效率,扩增曲线均为光滑明显的S型曲线,空白对照无扩增,且对属内菌株的覆盖性良好(图1B~D)。优选的引物探针详细信息见表2。
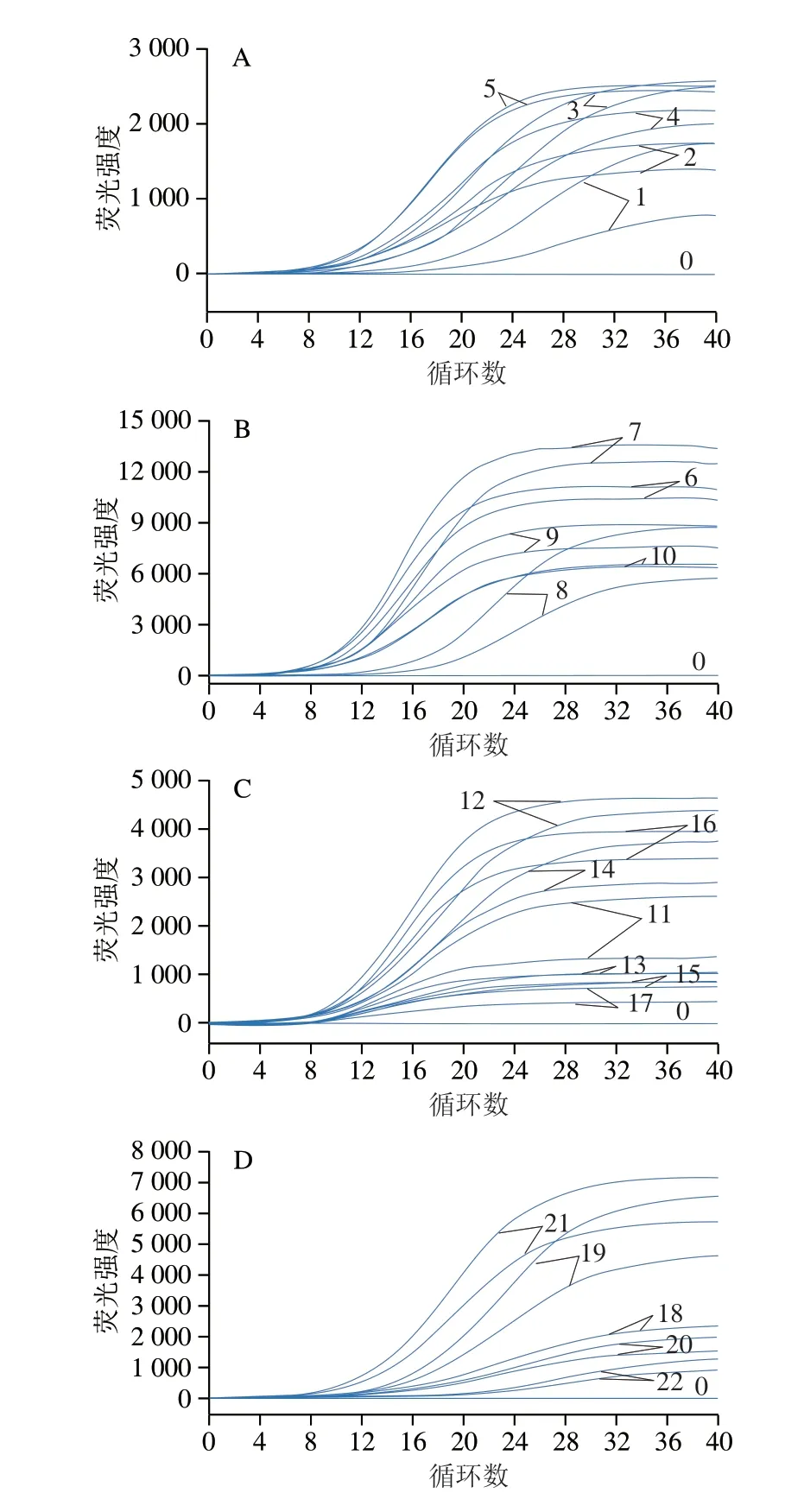
图1 4 种菌ERA引物探针筛选结果Fig.1 Results of screening of ERA probes for four pathogenic bacteria
2.2 4 种病原菌ERA引物探针特异性分析
为进一步分析筛选的4 种病原菌的引物探针特异性,分别对其进行ERA检测分析,结果如图2所示,4 种引物探针组合均只对特定的阳性靶标菌有良好的扩增,对枯草芽孢杆菌、大肠杆菌等13 种其他菌株(表1编号23~35)均无扩增,同时在4 种食源性致病菌之间均未出现交叉扩增,证明本研究选用的4 种引物探针组合特异性良好,可以用于沙门氏菌、单核细胞增生李斯特菌、金黄色葡萄球菌和克罗诺杆菌的ERA快速检测。

图2 4 种菌ERA引物探针特异性检测结果Fig.2 Specificity of ERA probes for four pathogenic bacteria
2.3 双重ERA检测体系优化
对4 种菌引物探针互相组合的双重ERA检测结果分析,最后选定克罗诺杆菌与单核细胞增生李斯特菌、沙门氏菌与金黄色葡萄球菌两套双重ERA检测体系。进一步对上述两套双重ERA检测体系进行优化。如图3所示,克罗诺杆菌和单核细胞增生李斯特菌双重ERA检测体系中每种引物的最佳用量为1.5 μL、每种探针的最佳用量为0.5 μL(图3A、C);在沙门氏菌和金黄色葡萄球菌双重ERA检测体系中,金黄色葡萄球菌的最佳引物探针用量分别为3.5 μL和0.6 μL,而沙门氏菌的最佳引物与探针用量为4 μL和0.8 μL。由于沙门氏菌的荧光信号强度不如金黄色葡萄球菌高,因此,选择沙门氏菌的最佳引物与探针用量作为该双重ERA检测体系的引物探针用量(图3B、D)。
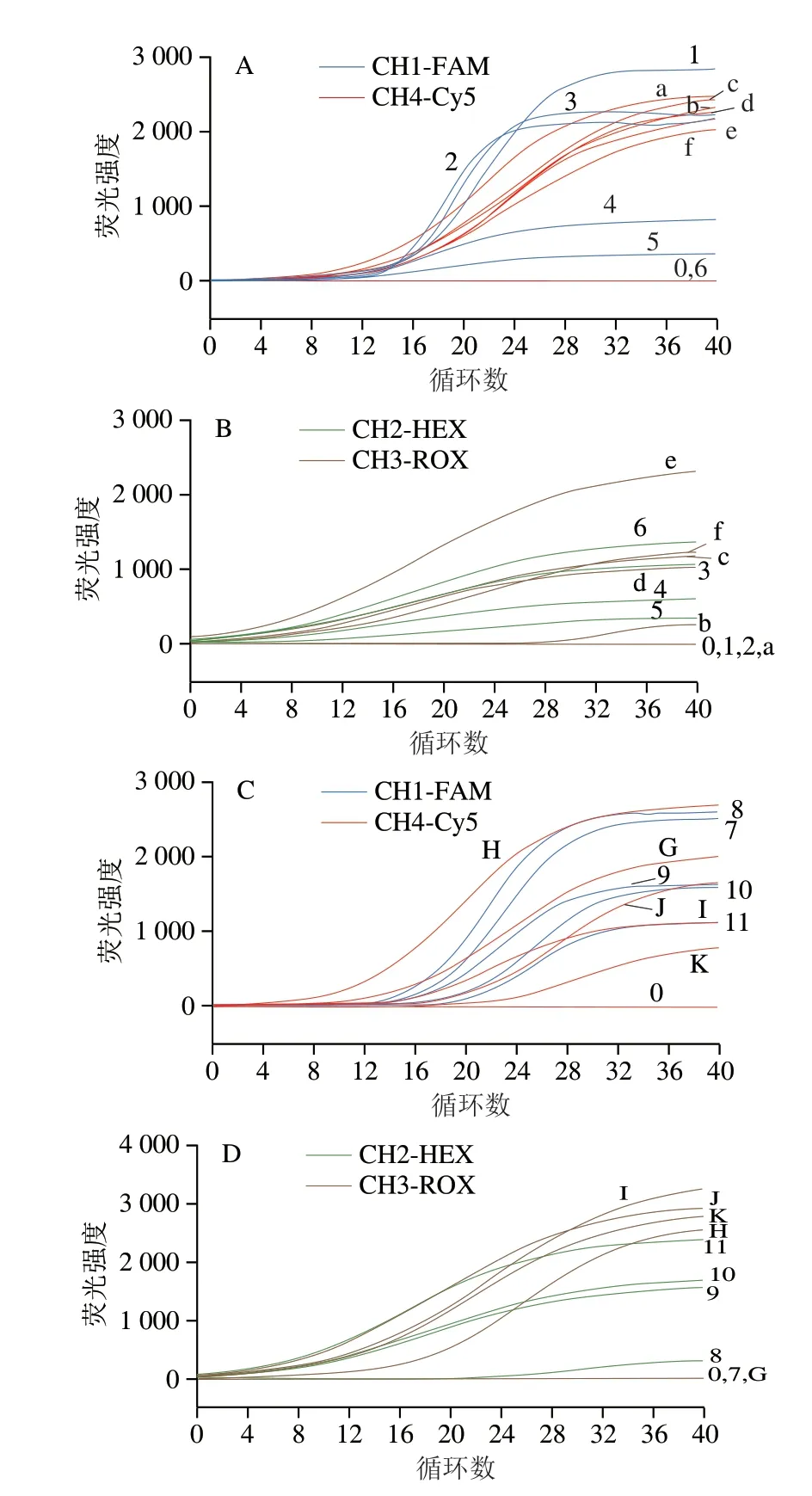
图3 双重ERA检测体系优化Fig.3 Results of optimization of dual-ERA systems
2.4 双重ERA检测方法灵敏度分析
对提取的DNA质量浓度进行检测,C.sakazakiiATCC29544为208.56 ng/μL、S.entericaATCC10708为512.7 ng/μL、L.monocytogenesATCC15313为145.24 ng/μL、S.aureusCMCC26003为239.9 ng/μL。在此基础上,将克罗诺杆菌和单核细胞增生李斯特菌、沙门氏菌和金黄色葡萄球菌的DNA两两混合,使体系中每种菌DNA质量浓度分别为101、100、10-1、10-2ng/μL。采用优化的双重ERA检测体系,进一步分析对4 种致病菌检测的灵敏度。结果显示,本研究建立的双重ERA检测方法对沙门氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌的灵敏度较高,DNA质量浓度为10-2ng/μL时仍能检出;对克罗诺杆菌检测的灵敏度相对较低,最低检出质量浓度为1 ng/μL(图4)。
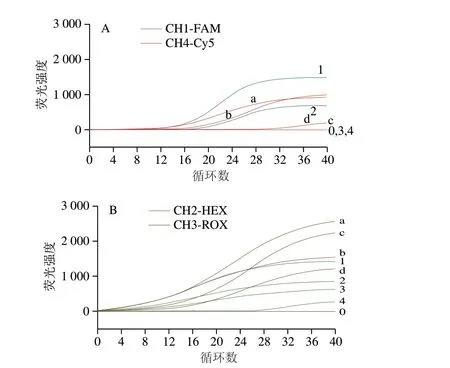
图4 双重ERA检测方法灵敏度分析结果Fig.4 Sensitivity of dual-ERA method
2.5 人工污染实验
对人工污染的婴儿配方乳粉样品进行增菌处理并提取基因组DNA,采用本研究建立的双重ERA方法进行检测。表3显示,增菌培养6 h后,最低可检出污染量为1 CFU/mL的4 种菌。

表3 人工污染样品检测结果Table 3 Results of detection of artificially contaminated samples
2.6 市售样品检测
采用本研究建立的双重ERA检测方法对市售的17 份婴儿配方乳粉样品进行检测,并以标准[29-31]规定的4 种食源性致病菌的实时荧光PCR方法进行结果比对。结果显示,17 种乳粉样品均未检测出克罗诺杆菌、沙门氏菌、单核细胞增生李斯特菌;婴儿配方牛乳粉和婴儿配方羊乳粉各有一个样品检测出金黄色葡萄球菌,检出率为11.76%,且双重ERA检测方法与标准规定的实时荧光PCR法检测结果一致(表4)。证实了本研究建立的克罗诺杆菌、沙门氏菌、单核李斯特菌和金黄色葡萄球菌双重ERA检测方法具有准确性和实用性。
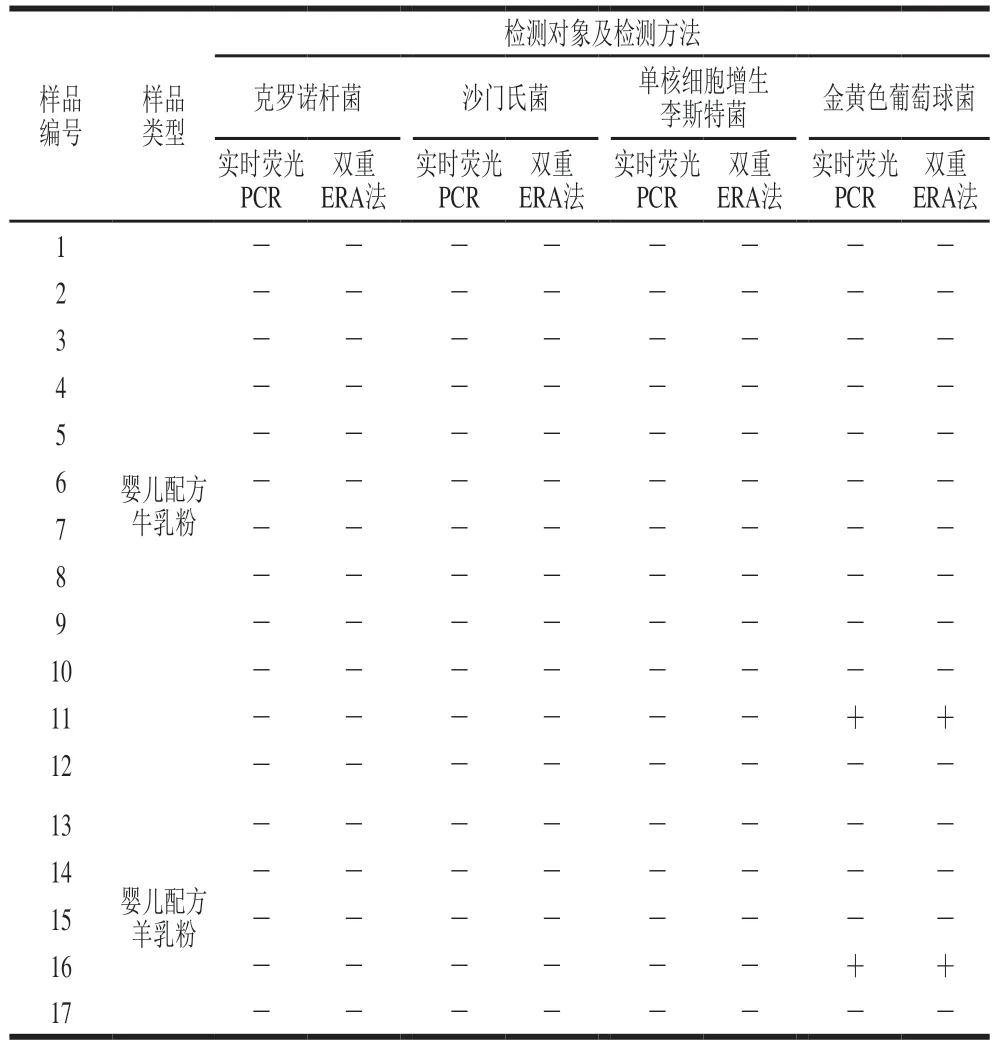
表4 实际样品检测结果Table 4 Results of detection of actual samples
3 讨 论
乳粉污染食源性致病菌的案例在国内外仍时有发生。然而,现有的检测方法存在一些不足,如培养周期过长、需要丰富的检测经验、对大型仪器设备依赖度高等。因此,开发耗时短、易操作、不依赖大型仪器的婴儿配方乳粉中食源性致病菌快速检测方法是十分必要的。ERA技术是近些年研发的一种等温扩增技术,在无需变温扩增设备的基础上,可进一步缩短反应时间和检测灵敏度。目前,国内外还没有利用ERA技术进行食源性病原菌检测的报道。克罗诺杆菌是国标规定的婴儿配方食品、特殊医学用途婴儿配方食品严格不能检出的病原菌[31],因此本研究以克罗诺杆菌ompX基因为靶点设计了ERA引物和探针。OmpX是存在于革兰氏阴性菌外膜上的一类蛋白质,是介导克罗诺杆菌黏附在小肠绒毛细胞表面的关键蛋白[32],但目前作为PCR检测靶点的研究较少。本研究以克罗诺杆菌ompX基因靶点建立了ERA可视化快速检测方法。并创新性地将RAA和RPA检测体系平移到ERA检测体系中,通过比较文献报道的沙门氏菌、金黄色葡萄球菌和单核细胞增生李斯特菌RPA/RAA引物探针在ERA检测体系中的检测效果,确定了这3 种菌在ERA检测体系中最优的引物探针。并与本研究筛选的克罗诺杆菌ERA引物和探针结合,构建了克罗诺杆菌-单核细胞增生李斯特菌、沙门氏菌-金黄色葡萄球菌两套双重ERA快速检测方法,从而提高了检测通量,减少了扩增时间,也节省了检测成本。
同时,结合课题组前期已开发的用自发热包提取病原菌基因组DNA的方法,依托合作研发的4通道便携式迷你qPCR仪(仅一个平板电脑大小,4 种荧光通道),可在20 min左右完成样品DNA提取、ERA检测和出具检测报告,从而在不依赖实验室条件下实现食品中致病菌现场快速筛查的目的。且本研究最低可前增菌6 h,即可实现1 CFU/mL的检出限,与采用前增菌18~22 h的其他方法一致,说明该方法的灵敏度较高。本研究对这4 种食源性致病菌双重ERA检测只是一个概念验证项目,只需替换引物探针序列就可以实现其他靶标的检测。为食品、临床、环境等其他领域的研究提供了新的检测思路。
4 结 论
本研究基于ERA技术,针对婴儿配方乳粉中易污染的4 种食源性致病菌,建立了克罗诺杆菌-单核细胞增生李斯特菌、沙门氏菌-金黄色葡萄球菌两套双重ERA检测方法,实现了DNA提取+检测结果+出具报告仅需20 min左右即可完成4 种致病菌快速检测的目的。且对沙门氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌纯培养物的检出限为10-2ng/μL,对克罗诺杆菌纯培养物的检出限为1 ng/μL,前增菌6 h,样品中致病菌检出限可达1 CFU/mL,具有特异性好、灵敏度高、检测时间短、操作简单、无需变温设备等优势,可用于婴儿配方乳粉中食源性致病菌的现场快速筛查。
