提取pH值对猪皮明胶凝胶性能和特征性多肽鉴定的影响
2023-10-21沙小梅晏侬洋陈文美谢作桦
沙小梅,晏侬洋,陈文美,谢作桦,芦 玲
(1.江西师范大学生命科学学院,国家淡水鱼加工技术研发专业中心,江西 南昌 330022;2.江西德上制药股份有限公司,江西 宜春 331208)
明胶是一种从动物的皮肤、骨骼和结缔组织中提取的天然亲水胶体高分子材料[1],主要来源于哺乳动物猪和牛,其中,在欧洲约80%的食用明胶是以猪皮为原材料制备而来[2]。明胶具有热可逆凝胶性、乳化性、起泡性、成膜性等多种性质,可作为增稠剂、稳定剂、固化剂、澄清剂、保水剂和黏合剂应用于食品、药品和保健产品中。
随着口蹄疫等疫情的爆发,猪明胶的安全引起了公众的关注[3]。此外,在一些特定的商业食品包装上,需明确标明不含猪源性成分[4]。因此,有必要开发一种能够准确鉴别明胶物种来源的分析方法[5]。近年来,酶联免疫吸附实验(enzyme-linked immune sorbent assay,ELISA)和聚合酶链式反应(polymerase chain reaction,PCR)因其相对快速和简单的特性,被频繁用于哺乳动物明胶来源的检测[6-7]。但是,ELISA容易与基质发生交叉反应,导致假阳性和假阴性结果[8]。同时,因明胶提取常需用强酸、强碱、高温等条件处理,易破化原有的DNA样本,导致PCR检测结果准确度降低[9]。因此,上述技术难以确保明胶鉴定的准确性。高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)技术可检测明胶酶解后的特征性多肽,是一种准确鉴别明胶来源的方法[10]。同时,研究结果表明,HPLC-MS/MS在明胶鉴定方面比ELISA和PCR更准确[5]。
提取条件会显著影响明胶的理化性质,生产过程中可通过控制明胶的提取参数以提高其品质[11]。其中,提取pH值是决定明胶性质的主要因素之一[12]。用酸、碱或二者结合对原料进行预处理会影响明胶的蛋白组成[13],可能会影响明胶的鉴定。本课题组前期研究发现,提取pH值会影响鱼明胶的胶融温度、凝胶温度和黏度等特性[14],但是不同提取pH值对猪皮明胶凝胶特性和特征性多肽鉴定的影响有待进一步研究。
鉴于商业生产的猪皮明胶是通过酸处理而获得的A型明胶[15],为细化明胶的提取pH值,本实验在pH 1、3、5、7条件下分别提取猪皮明胶。应用质构仪和流变仪测定凝胶强度、胶融温度和凝胶温度等猪皮明胶的凝胶特性,探究不同提取pH值条件对猪皮明胶凝胶特性产生的影响,为高品质猪皮明胶的制备提供参考。同时,应用HPLC-MS/MS研究不同提取pH值对猪皮明胶鉴定效果的影响,探寻不随pH值变化的猪皮明胶特征性多肽,并将其与本课题组前期研究中发现的猪皮明胶共有特征性多肽进行比对,进一步探究稳定存在于多种提取条件中的特征性多肽,为猪皮明胶精准鉴定提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
新鲜猪皮 正邦集团;胰蛋白酶(酶活力19 385 U/mg)美国Promega公司;蛋白分子质量Marker(分子质量范围10~245 kDa) 美国Thermo Scientific公司;盐酸、异丙醇、无水乙醇、NaOH 西陇科学股份有限公司;Tris-HCl缓冲液(pH 6.8和8.8)、考马斯亮蓝R-250 北京索莱宝科技有限公司;SDS 天津市大茂化学试剂厂;其他所用试剂均属于分析纯或以上。
1.2 仪器与设备
TA-XT plus质构分析仪 英国Stable Micro System公司;FA1104N型电子分析天平 上海丙林电子科技有限公司;Seven Compact台式pH计 梅特勒-托利多仪器(上海)有限公司;BIO-RAD型电泳仪 美国Bio-Rad公司;Q Exactive型质谱仪 美国Thermo Fisher Scientific公司;LGJ-1型冷冻干燥机 北京亚泰科隆仪器有限公司;MCR 302型剪切应力控制流变仪 奥地利Anton Paar公司。
1.3 方法
1.3.1 猪皮明胶样品制备
参照Nagarajan等[16]的方法并进行改进。鲜猪皮切去油脂等肥腻部分,洗净后切成1 cm×1 cm小块,加入异丙醇浸泡脱脂过夜。将浸泡过夜后的猪皮使用清水冲洗,而后用无水乙醇按照料液比1∶3(g/mL)浸泡猪皮10 min除去其中残存的异丙醇,再用清水洗净猪皮直至无异味。将猪皮按照料液比1∶10(g/mL)浸泡于0.1 mol/L NaOH溶液中,在15~20 ℃条件下磁力搅拌2 h,每40 min更换一次稀碱溶液。将处理后的猪皮洗至中性,按照料液比1∶10(g/mL)加入0.1 mol/L盐酸,在15~20 ℃条件下搅拌2 h,每隔1 h更换酸液,浸泡完冲洗猪皮至中性。将处理后的猪皮按照料液比1∶3(g/mL)加入到超纯水中,将pH值分别调至1、3、5、7,置于55 ℃水浴锅中加热12 h。提胶完成后调节pH值至中性,抽滤除去猪皮残渣,将所得滤液进行收集,冻干,保存备用。
1.3.2 凝胶强度测试
参照Tu Zongcai等[17]的方法测量,并适当修改。配制6.67 mg/mL的明胶溶液,取15 mL倒入25 mL的小烧杯中(胶体为33 mm×22 mm),每个样品设置3 组平行,置于4 ℃冷藏18 h,取出使用质构分析仪测定胶体的凝胶强度。设定参数如下:探头P/0.5R,测试速率1 mm/s,凝胶强度即为探头下压明胶4 mm所承受的最大压力。
1.3.3 流变学测试
参考Tu Zongcai等[17]的方法,使用流变仪测量明胶的凝胶-融胶转变温度,将溶液先从45 ℃降温至5 ℃,再从5 ℃升温至45 ℃,加热/冷却速率为0.5 ℃/min,测量在0.5%应变和1 Hz频率下进行。
1.3.4 猪皮明胶酶解
参考课题组前期的实验方法对猪皮明胶进行酶解[18-19]。将约3 mg的猪皮明胶溶解在SDT缓冲液(含4%SDS、1 mmol/L二硫苏糖醇(dithiothreitol,DTT)、150 mmol/L Tris-HCl,pH 8.0)中,煮沸3 min后在冰上进行超声波匀浆处理。粗提物25 ℃、16 000×g离心10 min,取250 μg上清液与200 μL尿素缓冲液(含8 mol/L尿素和150 mmol/L Tris-HCl,pH 8.0)混合,通过超滤以去除DTT等低分子质量组分。收集浓缩液后,再重复一次上述混合和离心操作。用尿素缓冲液配制50 mmol/L的碘乙酰胺(iodoacetamide,IAA)并取100 μL与浓缩液混合,室温避光20 min,离心15 min。之后向浓缩液中加100 μL尿素缓冲液离心,重复3 次。然后,将浓缩液与100 μL 25 mmol/L NH4HCO3混合,再次离心浓缩,重复这个操作2 次。混合最终得到的浓缩物与40 μL 25 mmol/L含3 μg胰蛋白酶的NH4HCO3,在37 ℃孵育过夜,以滤液的形式收集肽。
1.3.5 HPLC-MS/MS检测
将酶解后的肽段用Easy nLC-Orbitrap Fusion质谱仪进行检测,液相色谱流动相:A为0.1%的甲酸水溶液,B为84%乙腈溶液(含0.1%甲酸)。样品由自动进样器上样到C18反相色谱柱,以250 nL/min的流速经色谱柱分离,样品洗脱60 min,流动相A线性梯度变化为流动相B。在数据依赖采集模式下采集丰度最高的10 个母离子,获得其一级质谱数据,通过高能碰撞诱导解离(high-energy collision-induced dissociation,HCD)获得二级质谱数据。
1.4 数据分析
将数据库设置为猪胶原蛋白数据库,采用MASCOT软件(Matrix Science,London,UK;version 2.2)与所获得的质谱图进行匹配分析。检索参数包括:氧化(K、M、P)为可变修饰;半胱氨酸碘乙酰胺化(C)为固定修饰;最大漏切位点数为2;一级质谱错误率为±0.02‰;二级质谱错误率为±0.1 Da。当Mascot分数大于40时,多肽峰被认定为阳性鉴定或准确度极高(P<0.05)[20]。
2 结果与分析
2.1 提取pH值对猪皮明胶分子质量分布的影响
哺乳动物明胶的分子质量分布较宽且具有典型的明胶分子质量分布图,包括清晰的α链条带(α1和α2)、β链条带(即α链二聚体)和高分子质量聚合物(high molecular weight polymers,HMWP)条带[21]。提取pH值对猪皮明胶分子质量分布的影响结果如图1A所示,当pH值为3、5、7时,猪皮明胶呈现了典型的明胶分子质量分布图,即保留了α1链、α2链、β链和HMWP条带,且提取pH 5时条带最为清晰,提取pH值为1时未出现明显的上述典型条带且蛋白组分集中分布在低分子质量条带区域。在pH 3、5和7时,提取的猪皮明胶在α1链和β链之间具有连续分布的轻微降解带,在α2链条带下方存在低分子质量条带(<α2链)。相较于pH 5时提取的猪皮明胶,pH 3样品的低分子质量条带含量更多,这可能是因为提取pH值下降,加剧了猪胶原蛋白的解聚,从而低分子质量组分增加。当明胶提取pH值为7时,观察到另一蛋白降解条带(~135 kDa),可能是处于中性环境中提取明胶时胶原蛋白水解程度降低产生的。结果表明,pH值在控制所提取的猪皮明胶的分子质量分布方面起关键作用。并且前人研究结果表明,明胶的分子质量分布会在一定程度上影响其凝胶特性[14,22],可能也会对明胶的溯源产生影响,这将会在后续实验进行详细的分析。
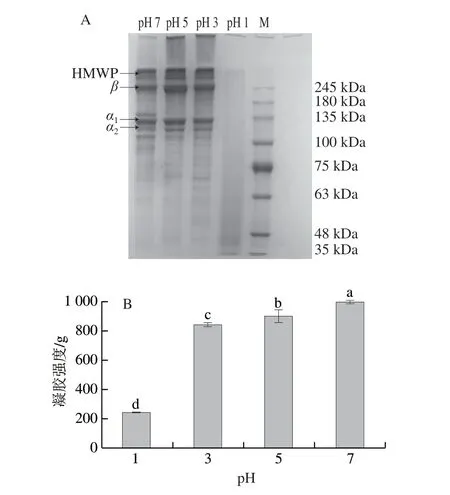
图1 提取pH值对猪皮明胶分子质量分布(A)、凝胶强度(B)的影响Fig.1 Effect of extraction pH on molecular mass distribution (A) and gelling strength (B) of porcine skin gelatin
2.2 提取pH值对猪皮明胶凝胶强度的影响
凝胶强度是考量明胶性能的重要指标,显著影响其实际应用[23]。如图1B所示,当提取pH值为1、3、5、7时,猪皮明胶凝胶强度分别为242.78、850.13、901.43、997.51 g。课题组前期研究结果显示,当提取温度为55~75 ℃,猪皮明胶凝胶强度在717.36~183.55 g之间,其数值与提取温度有关[24]。此外,Hu Zizi等[25]报道显示罗非鱼明胶的凝胶强度高于600 g,商业猪皮明胶凝胶强度为779.77 g。对比上述研究可知,当提取pH值在3~7之间,猪皮明胶具有良好的凝胶强度,可在工业生产中进行应用。
提取pH值能显著影响猪皮明胶凝胶强度(图1B),即凝胶强度随着提取pH值的升高而升高。本实验的变化趋势与Cho等[26]的研究结果类似。猪皮明胶的凝胶强度可能与其分子质量变化情况相关,明胶分子链越长,凝胶网络结构越强,凝胶强度则会越大[27]。并且,提取过程中使用强酸条件处理会过度水解胶原分子[22],使得形成凝胶所需的作用力降低,最终导致凝胶强度降低,所以pH值为1时提取的猪皮明胶凝胶强度显著低于其余猪皮明胶的凝胶强度。
课题组前期研究结果表明分子质量分布对鳙鱼鱼鳞明胶凝胶强度有重要影响[14],本实验结果亦表明猪皮明胶的分子质量分布和凝胶强度之间存在一定的相关性。除提取pH 1以外,其他pH值提取的猪皮明胶均有明显的α链、β链和HMWP条带,且pH 5提取的猪皮明胶条带最为清晰。α链、β链和高分子质量组分有利于凝胶网络的形成,进而使明胶的凝胶强度增强[14]。值得说明的是,提取pH值为7时的猪皮明胶凝胶强度最高,可能是因为此时提取pH值接近猪明胶的等电点(7~9.3)[28],明胶聚合物更接近中性电荷,因此形成了更紧凑、更坚硬的凝胶,Cho等[26]也验证了在等电点附近产生的明胶具有较高的凝胶强度。
2.3 提取pH值对猪皮明胶凝胶-融胶转变温度的影响
如图2所示,所有的猪皮明胶样品在凝胶和融胶过程中储能模量(G’)和损耗模量(G”)均随着温度升高而降低,随着温度降低而升高。在降温模式中,猪皮明胶在初始温度(45 ℃)下,G’和G’的值较低,且G”>G’,表明此时明胶分子呈单链排列,样品呈现溶液状态;当温度下降到5 ℃时,G’和G”均急剧增加至保持稳定不变,此时G”<G’,G’的增加是由三螺旋形成引起,表明了凝胶的形成。在升温模式中,所有猪皮明胶都显示出热可逆行为,随着温度的升高,猪皮明胶的三螺旋结构逐渐解聚形成单链,其状态则由凝胶态逐渐融化为液态。
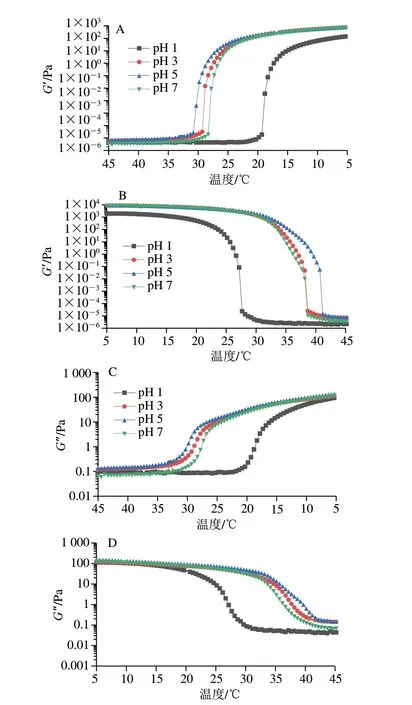
图2 提取pH值对猪皮明胶凝胶-融胶转变温度的影响Fig.2 Effect of extraction pH on gel-sol transition temperature of pigskin gelatin
在冷却和加热过程中,分别有一个G’和G”处于平衡的几何点,冷却和加热曲线上的G’和G”交叉点分别定义为凝胶点和胶融点[29],分别对应明胶的凝胶温度和胶融温度[30]。本实验中pH 1、3、5、7提取的猪皮明胶凝胶温度分别为17.81、27.81、29.06、27.06 ℃,胶融温度分别为26.17、36.18、39.18、35.93 ℃。随着提取pH值酸性逐渐减弱,猪皮明胶凝胶温度和胶融温度先增高后降低,这与Derkach等[12]的研究结果趋势一致。随着提取环境中的酸度增加,胶原蛋白的降解加剧,产生的小分子组分相互作用减弱,导致提取pH值为1、3的猪皮明胶凝胶温度和胶融温度均低于提取pH 5的明胶样品。而pH值为7时提取的猪皮明胶凝胶温度和胶融温度低于提取pH 5时的猪皮明胶,与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(dodecyl sodium sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)中提取pH 7的猪皮明胶分子质量条带比提取pH 5的猪皮明胶更浅的结果一致,说明猪皮明胶的分子质量分布情况对胶融温度、凝胶温度会产生影响。
2.4 提取pH值对猪皮明胶特征性多肽鉴定的影响
2.4.1 不同pH值提取的猪皮明胶特征性多肽总体分析
在工业生产中,针对不同的产品需要不同性质(如凝胶强度、胶融温度等)的明胶,控制提取pH值可以获得性能不同的明胶[31]。然而,提取pH值的变化可能会产生不同的特征性多肽,本研究利用HPLC-MS/MS鉴定不同pH值条件下提取的猪皮明胶特征性多肽,采用Venn图分析不同猪皮明胶样品间的相同和差异之处,结果如图3A所示。在提取pH值为1、3、5、7的猪皮明胶中分别检测到62、71、79、76 条特征性多肽。随着提取环境酸性的减弱,猪皮明胶样品的特征性多肽先增多后减少。其中有37 条特征性多肽同时出现在不同pH值提取的所有明胶样品中,这些多肽被称为共有特征性多肽。相应地,只在1、2 种或3 种提取pH值情况下检测到的多肽称为非共有特征性多肽,提取pH值为1、3、5、7的猪皮明胶分别有25、34、42、39 条非共有特征性多肽。明胶中含有丰富的氨基酸修饰,包括脯氨酸残基的羟基化等情况[2]。为研究提取pH值对原始氨基酸序列裂解差异的影响,通过去除猪皮明胶的氨基酸修饰,以序列中氨基酸位置为横坐标,比较不同pH值提取的猪皮明胶特征性多肽分布情况。如图3B、C所示,在所有猪皮明胶中,α2链均比α1链拥有更多的断裂片段。本课题组之前的研究表明,猪和牛胶原蛋白中α1和α2链肽的相似度分别为95.9%和95.3%[32]。此外,Zhang Guifeng等[3]也报道了猪与牛胶原蛋白之间α1链的同源性高于α2链。因此,相似性阈值的差异可能有助于鉴定出更多猪皮明胶α2链中的特征性多肽。同时,当提取环境由中性向酸性变化,两条链的断裂片段数目整体上趋势是先增加后减少,说明提取环境酸性程度增强会导致猪明胶的α1和α2链出现不同程度的降解或出现新的序列片段。极端的酸性环境可能会加剧明胶水解导致更多低分子质量肽的片段出现或完全水解碎片分子至其失去特征性,例如可以观察到在pH 1条件下提取的猪皮明胶的断裂片段明显少于前3 组样品且片段多以为短片段为主。
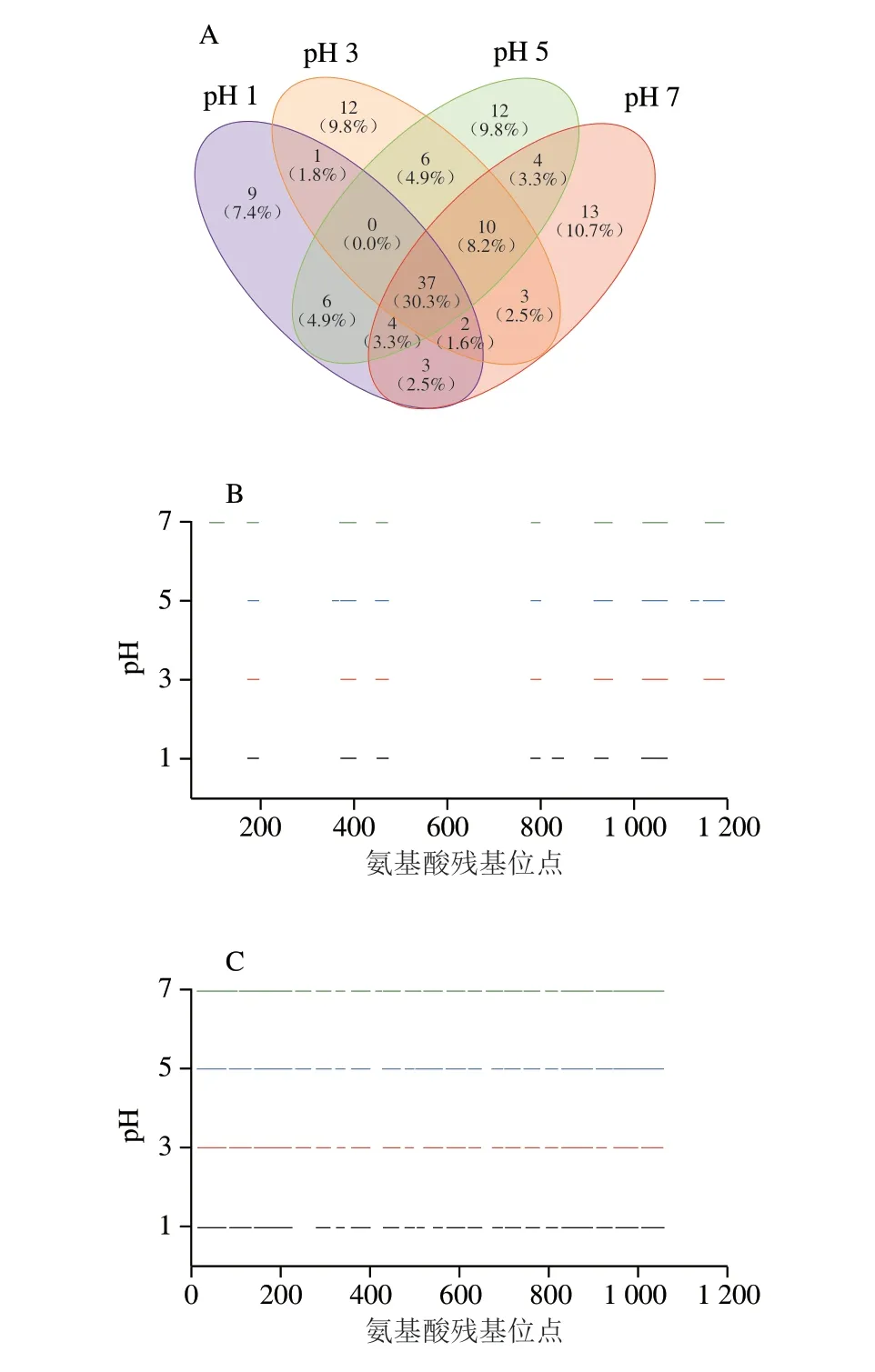
图3 不同pH值条件下提取的猪皮明胶特征性多肽的Venn分析及片段分布Fig.3 Venn analysis and fragment distribution of characteristic peptides of porcine skin gelatin extracted under different pH conditions
2.4.2 不同pH值提取的猪皮明胶非共有特征性多肽分析
正如预期的那样,在猪皮明胶样品中观察到许多非共有特征性多肽(图3A)。在提取pH值为1、3、5、7的猪皮明胶样品中,分别检测到26、34、42、39 条非共有特征性多肽。其中,分别有9、12、12、13 条特征性多肽仅单独存在于pH值为1、3、5、7的猪皮明胶中。同时存在于两种pH值提取的猪皮明胶非共有特征性多肽情况有6 种,包括提取pH 1 & pH 3、p H 1 & p H 5、p H 1 & p H 7、p H 3 & p H 5、pH 3 & pH 7、pH 5 & pH 7,它们分别共同拥有1、6、3、6、3、4 条特征性多肽。其中,pH 5提取的明胶与其他3 组明胶样品拥有的共同特征性多肽较多,可能因为pH 5适合用于猪皮明胶的提取,该条件下检测到的明胶特征性多肽最多导致Venn图重叠率较高。与此同时,在3 种提取pH值中同时存在的特征性多肽有4 种情况,其中pH 1 & pH 3 & pH 7、pH 1 & pH 5 & pH 7、pH 3 & pH 5 & pH 7的共同特征性多肽数分别为2、4、10 条,在提取pH 1 & pH 3 & pH 5时没有共同的特征性多肽。分析3 种pH值提取明胶的共有特征性多肽时,不难发现,共有条件中包含提取pH值为1会导致共同拥有的特征性多肽数锐减,可能是pH值为1时提取明胶环境较为极端,导致胶原蛋白水解程度加剧,形成了更多的短肽,因而与其他的温和环境下提取的样品特征性多肽差异性较大。非共有特征性多肽会随着提取pH值的变化而变化,即它的存在具有不稳定性,因此不可以作为鉴定的识别肽段。
2.4.3 不同pH值提取的猪皮明胶共有特征性多肽分析
如前所述,在所有提取的样品中,37 条共有特征性多肽被准确检测,其中16 条特征性多肽来自α1链,21 条特征性多肽来自α2链(表1)。上述共有特征性多肽出现在不同pH值提取的猪皮明胶样品中,不随提取pH值的变化而变化,在猪皮明胶溯源鉴定中具有重要的参考价值。

表1 pH值为1、3、5、7时提取的猪皮明胶的共有特征性多肽Table 1 Common characteristic peptides of porcine skin gelatin extracted at pH 1, 3, 5, and 7
这些共有特征性多肽可以被分为两类,第1类是未修饰的特征性多肽,在3 7 条共有特征性多肽中,观察到6 个未经修饰的特征性多肽,其中3 条来自α1链,3 条来自α2链。α1链未修饰的共有特征性多肽分别为174SAGISVPGPMGPSGPR189、784G E T G P S G P A G P T G A R798、1052GETGPAGPAGPVGPVGAR1069,α2链中未修饰的共有特征性多肽分别是85GVGAGPGPMGLMGPR99、676G A P G A V G A P G P A G A N G D R693、831TGETGASGPPGFAGEK846。由于这些未修饰的共有特征性多肽易于识别和匹配碎片离子,因此在猪皮明胶的鉴定中具有重要的应用前景。第2类是包含修饰情况的共有特征性多肽,共鉴定出31 个含脯氨酸羟基化修饰的共同特征性多肽,其中13 条来自α1链、18 条来自α2链。值得说明的是,在各类修饰情况中,存在序列相同但修饰程度不同的特征性多肽片段,又可分为不同数量的羟基化修饰位点和相同修饰数量但不同修饰位置2 种类型,这些复杂修饰加剧了准确识别肽段序列的困难。例如,从1022GESGPAGPPGAPGAPGAPGPVGPAGK1047中准确地找到了4 个质谱峰,分别具有1、2、3、4 个脯氨酸羟基化修饰位点,本实验选取拥有脯氨酸羟基化位点最多(含4 个脯氨酸羟基化修饰位点)的1022GESGPAG*PPG A*PGA*PGA*PGPVGPAGK1047肽段进行举例说明,此条特征性多肽的实际相对分子质量与理论相对分子质量(2 170.029 1)匹配良好,误差仅为0.003 83‰。如图4A所示,HCD碎裂产生的y和b系列离子准确地证明了此特征性多肽的序列和修饰,Pro1029、Pro1033、Pro1036和Pro1039的羟基化位点可分别被y18-y17、y15-y14、y12-y11和y9-y8离子证明。复杂的氨基酸残基修饰将会显著增加明胶鉴定的难度,Zhang Guifeng等[3]指出,由脯氨酸羟基化引起的质量转移可能与一些氨基酸残基的质量差异相混淆,如羟脯氨酸和亮氨酸残基。而高分辨率质谱可以较好地克服以上问题,并显著提高识别特征性多肽的准确性。例如,Kleinnijenhuis等[9]研究显示,Orbitrap分析仪可以提供高分辨率,轻松识别羟脯氨酸和亮氨酸残基之间的细微差别。Orbitrap质量分析器能够使得一级质谱峰m/z200分辨率达到70 000,HCD二级质谱图中m/z200分辨率达到17 500,这种高分辨率的测量结果使猪皮明胶特征性多肽的鉴定具有很高的准确性。
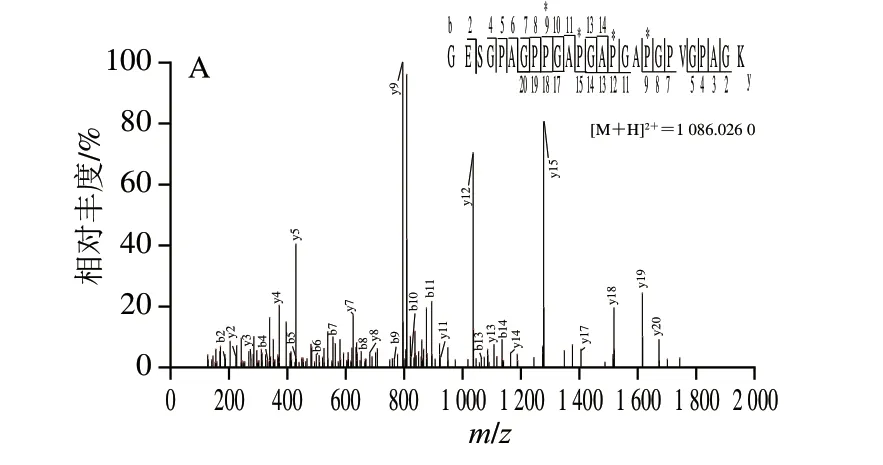
图4 猪皮明胶特征性多肽的二级质谱图Fig.4 Secondary mass spectra of characteristic peptides of porcine skin gelatin
2.5 猪皮明胶共有特征性多肽的对比分析
本课题组前期研究表明,提取温度、时间以及提取批次会对猪皮明胶特征性多肽的鉴定产生显著影响,并且确定了不随提取次数、温度、时间变化的共有特征性多肽[2,24,33]。为进一步探究不随提取条件变化而改变的稳定共有特征性多肽,对不同pH值、温度、时间和多阶段提取过程下制备的猪皮明胶特征性多肽进行了对比分析,以建立更准确的猪皮明胶特征性多肽数据库。
如表2所示,通过比较4 种不同条件提取的猪明胶特征性多肽,共得到17 条共有特征性多肽,包括7 条α1链肽和10 条α2链肽。这些共有特征性多肽稳定存在于不同提取条件(如提取温度、pH值、次数)得到的猪皮明胶酶解物中,说明它们具有良好的稳定性。因此,这些特征性多肽可以为猪明胶的鉴定提供重要的数据支撑。以往的文献也报道了一些猪明胶的特征性多肽,例如,Kleinnijenhuis等[9]鉴定出了特征性多肽574GI*PGEFGL*PGPAGPR588(*P表示脯氨酸羟基化),本研究也检测到了该特征性多肽(表2)。此外,Grundy等[5]从猪明胶中发现了5 种特征性多肽。其中,有4 条特征性多肽出现在最终的共有特征性多肽表中,包括920GS*PGADGPAGA*PGTPGPQGIAGQR943(α1)、1052G E T G PA G PA G P V G P V G A R1069(α1)、592G*PPGESGAAGPAGPIGSR609(α2)、979GEPGPAGSVGPAGAVGPR996(α2)(没有展示脯氨酸羟基化的修饰)。同样,Cheng Xianlong等[34]检测到了m/z为925.432 612+的片段451GEPGPTGVQGPPGPAGEEGK470(α1),该片段在不同提取pH值处理中被保留(表2),但在不同提取温度处理中不稳定[24],这可能是由于两种方法的提取条件不同造成的。因此,为了提高猪明胶鉴定的准确性,需要对质谱结果进行逐一匹配,尽可能多地探索共有特征性多肽。
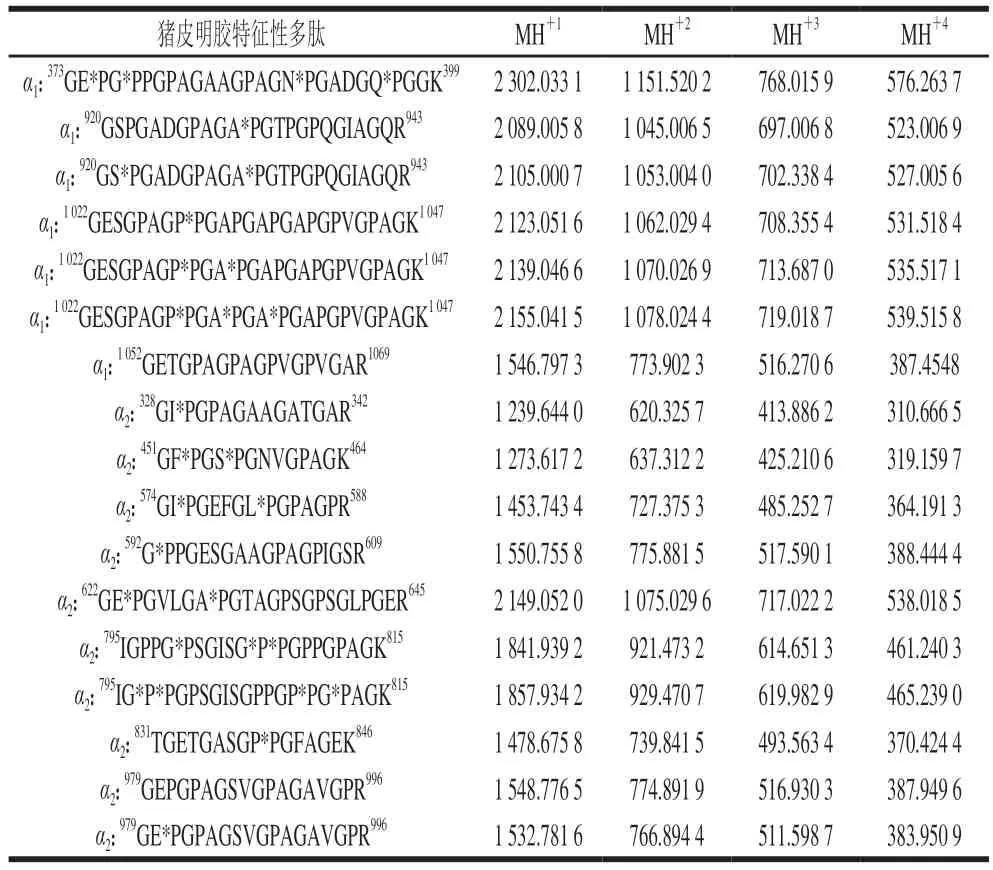
表2 不同条件提取的猪皮明胶的共有特征性多肽Table 2 Common characteristic peptides of porcine skin gelatin extracted under different conditions
在1 7 条共有特征性多肽中, 未经修饰的共有特征性多肽有2 条, 分别是来自α1链的1052G E T G PA G PA G P V G P V G A R1069和来自α2链的979GEPGPAGSVGPAGAVGPR996,图4B、C中MS/MS产生的一系列y离子和b离子证实了上述多肽序列的正确性。这些未经修饰的特征性多肽易识别、干扰少,对猪皮明胶的实际鉴定具有十分重要的意义。此外,为了方便起见,表2中列出了共有特征性多肽价态为+1、+2、+3、+4时对应的理论m/z值,以帮助后续实际应用过程中特异性多肽的快速识别。
3 结 论
提取pH值显著影响猪皮明胶的分子质量分布、凝胶性能和鉴定效果。当提取pH值由7降低到1时,凝胶强度从997.51 g降低到242.78 g,胶融温度由35.93 ℃降低到26.17 ℃,凝胶温度也从27.06 ℃显著降低到17.81 ℃。同时,SDS-PAGE结果表明,α链、β链和高分子质量组分的含量在酸作用下略有下降,提取pH 5时猪皮明胶条带最为清晰,pH 1时猪皮明胶没有出现上述典型条带。HPLC-MS/MS结果显示从提取pH值为1、3、5、7的猪皮明胶中分别鉴定出62、71、79、76 条特征性多肽,其中有37 条共有特征性多肽。此外,进一步与其他提取条件(温度、时间、提取次数)下猪皮明胶的特征性多肽进行对比,获得了17 条共有特征性多肽,它们在不同条件下提取的猪皮明胶中均可被鉴定出,具有良好的可重复性和稳定性,可作为猪皮明胶溯源的重要依据。后续可进一步探究这些特征性多肽在食品加工过程中的稳定性,以提高猪皮明胶溯源鉴定结果的准确性。
