疏水壳聚糖气凝胶的制备和负载姜黄素及缓释性能
2023-10-21许丁予焦思宇姚先超陈丽芬林日辉
许丁予,焦思宇,姚先超,刘 鑫,陈丽芬,林日辉*
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室/协同创新中心,广西 南宁 530006)
姜黄素来源于一些姜科、天南星科植物,其本身具有良好的缓解炎症和抗肿瘤等特性[1]。早在1870年,姜黄素从姜黄(Curcuma longaL.)中首次分离出来[2]。姜黄素为橙黄色结晶粉末,味苦,水溶性较差,溶于乙醇。齐莉莉等[3]研究表明,姜黄素单体在pH 2~4的酸性环境下不稳定,而口服姜黄素是常见的用药方式之一,这导致姜黄素在肠胃内吸收利用的效率受限于其自身的稳定性。因此需要制备新型药物载体提高药物的利用率。目前负载姜黄素的新型载体主要有蛋白质或者低聚糖复合纳米颗粒、脂质体和水凝胶等材料,受限于原材料的反应位点,其制备过程较为繁琐。
壳聚糖是一种来源于海洋的天然生物多糖[4],它是甲壳素脱乙酰化后的产物。壳聚糖自身安全无毒,具有良好的生物降解性、生物相容性。同时还有抑菌、抗癌、降脂、增强免疫等多种生理功能,广泛应用于食品添加剂[5]、人造组织材料[6]、药物缓释材料[7]、基因转导载体[8]以及药物开发等各种领域。关于壳聚糖的研究多种多样,其中将壳聚糖作为基质制备药物载体一直以来都是研究热点。例如,Shen等[9]设计了一种三聚磷酸盐-壳聚糖交联四环素海绵,用于四环素的缓释;Alagha等[10]开发了多孔黏膜黏附生物海绵作为释放地塞米松的载体,用于治疗口腔黏膜炎。
由于壳聚糖自身的胺基基团较为活泼,在酸性条件下壳聚糖胺基发生质子化,从而携带正电荷,再利用三聚磷酸盐的静电交联作用制备得到轻质气凝胶。但壳聚糖气凝胶表面光滑,容易破碎,亲水性强[11]。因此为了开发一种安全的脂溶性药物载体,对壳聚糖气凝胶进行疏水改性。在现有的气凝胶疏水改性研究中,Ganonyan等[12]采用三甲基氯硅烷作为交联改性剂,使气凝胶具备了超疏水性能,表面水滴接触角测试达到150°。但多数研究所采用的交联改性剂大多为有毒的有机试剂,不利于作为药物载体。因此本研究从食品添加剂中得到了启发,使用甜瓜醛作为交联改性剂。
甜瓜醛作为一种常见的食品用香料,常温下呈无色透明液体,能提供一种强烈的绿色甜瓜和黄瓜香气,可添加于任何类型的香精配方中。因为其具备链式的分子结构,同时分子末端还存在一碳碳双键。若在壳聚糖分子间插入,不仅利于交联反应[13],而且还能接枝额外基团,以改善其理化性能。
本研究以壳聚糖为基质,加入三聚磷酸钠(sodium tripolyphosphate,TPP)作为离子交联剂,采用离子交联法[14]制备了TPP交联壳聚糖气凝胶(tripolyphosphate chitosan,TCS)。再通过甜瓜醛和正十八硫醇对壳聚糖气凝胶进行交联和改性,制备得到疏水壳聚糖气凝胶(octadecyl mercaptan melonal tripolyphosphate chitosan,OMTCS)。并对脂溶性药物姜黄素进行负载和体外模拟缓释研究。
1 材料与方法
1.1 材料与试剂
壳聚糖(分析纯,脱乙酰度≥95%)、甜瓜醛(色谱纯)、正十八硫醇(97%)、TPP(分析纯)、姜黄素(98%)上海麦克林生化有限公司;胃蛋白酶(1∶10 000)、胰蛋白酶(1∶2 5 0) 北京索莱宝科技有限公司;无水乙醇(分析纯) 成都科隆化学品有限公司;冰乙酸(分析纯) 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
DF-101S恒温水浴锅 巩义市予华仪器有限责任公司;JY92-IIN超声细胞粉碎机 宁波新芝生物科技股份有限公司;FD-1A-50+冷冻干燥机 博医康仪器有限公司;MQL-61R立式振荡培养箱 上海旻泉仪器有限公司;UV-2600紫外分光光度计 日本岛津公司;SUPRA55 Sapphire场发射扫描电子显微镜 德国卡尔蔡司公司;MAGNA-1R 550傅里叶变换红外光谱仪、K-Alpha X射线光电子能谱仪 美国赛默飞世尔科技公司;MiniFlex600 X射线衍射仪 日本理学公司;NETZSCH STA2500热重分析仪 德国耐驰仪器制造有限公司;SDS-350接触角测量仪 东莞市晟鼎精密仪器有限公司。
1.3 方法
1.3.1 TCS的制备
取1.2 g壳聚糖溶解在60 mL 1%的冰醋酸溶液中,置于恒温水浴锅中加热1 h,待溶解完全后逐滴加入6 mL的5 mg/mL TPP溶液[15],然后超声分散溶液10~15 min。静置溶液,待其冷却后置于-30 ℃冰柜中冷冻24 h,并在冷冻干燥机中冷冻干燥72 h后取出。制备得到白色的壳聚糖气凝胶。
1.3.2 甜瓜醛交联壳聚糖气凝胶(m e l o n a l tripolyphosphate chitosan,MTCS)的制备
配制400 mL,1%的甜瓜醛乙醇溶液,将TCS置于溶液中70 ℃反应6 h。反应完成后室温下干燥。得到具有甜瓜香味的壳聚糖气凝胶。
1.3.3 OMTCS的制备
参考Su Chunping等[15]的方法,配制300~400 mL,10 mmol/L的正十八硫醇乙醇溶液,将MTCS置于溶液中反应30 min,反应完成后用无水乙醇洗涤3 次,在烘箱中60 ℃烘干得到柔软的OMTCS。
1.3.4 样品表征
除用于扫描电子显微镜的样品外,其余样品用液氮冷冻后粉碎处理。
场发射扫描电子显微镜扫描:从OMTCS表面取下小块黏在导电胶片上,然后将导电胶片粘贴于样品台上并用真空镀膜仪喷镀铂金层,制得样品。在扫描电子显微镜下观测OMTCS的表面构造,采用SE2探测器,工作距离为5.9 mm,加速电压为1.5 kV。
傅里叶变换红外光谱分析:采用KBr压片法制备样品,首先将KBr粉末和样品粉末干燥,然后以样品与KBr质量比为1∶50置于玛瑙研钵中充分研磨,转移到模具中在压机上压成半透明薄片。用傅里叶变换红外光谱仪测试分析,背景和样品扫描次数同为32,扫描波数范围400~4 000 cm-1,动镜速率0.632 9 mm/s。
X射线光电子能谱扫描:取适量样品粉末压片后,贴于样品盘上,将样品放进X射线光电子能谱仪器样品室中。使用Al Kα射线(hv=1 486.68 eV)激发样品表面发射光电子,利用能量分析器测量光电子动能,进而得到激发电子的结合能。工作电压12 kV,工作电流6 mA。全谱扫描下,10 次循环信号累加,通能为150 eV,步长1 eV;窄谱扫描下,5 次循环信号累加,通能为50 eV,步长0.1 eV。
X射线衍射仪分析:将样品粉末放置在玻璃样品槽上轻压至平整,将样品槽转移到样品箱中测试分析,扫描范围2θ设为5°~80°,步宽为0.02°,扫描速率为8 °/min,电压和电流分别设为40 kV和15 mA。
热重分析仪分析:将样品粉末置于热重分析仪天平室中,在N2气氛下进行测试。升温区间为30~800 ℃,升温速率20 K/min。
接触角测量仪测试:平整取出小块OMTCS样品,稳定放置在载玻片上,在采样时间10 ms、总数200帧下,对其分别进行表面接触油滴和水滴测试。接触角使用采样软件进行计算。
1.3.5 标准曲线的绘制
1.3.5.1 姜黄素在无水乙醇中的标准曲线
参考高凤苑等[16]的方法,准确称取125 mg姜黄素粉末,加入到盛有100 mL无水乙醇的烧杯中超声振荡溶解。将溶液转移至250 mL容量瓶中定容后得到质量浓度为500 mg/L的姜黄素-乙醇溶液,避光储存。将制备好的姜黄素-乙醇溶液分别稀释到0.5、1.5、2.5、3.5、4.5、5 mg/L五个质量浓度梯度,用紫外分光光度计在姜黄素最大吸收波长425 nm处测得其吸光度。以姜黄素含量(mg/g)为横坐标(x),以吸光度为纵坐标y,绘制得到姜黄素的标准曲线为y=0.153x-0.001 8,R2=0.999 8。
1.3.5.2 姜黄素在胃液中的标准曲线
根据《中国药典》[17]配制pH 1.6的胃液,以胃液为溶剂配制得到1、2、3、4、5 mg/L五个质量浓度梯度的姜黄素胃溶液。在紫外分光光度计下进行光谱扫描,发现其最大吸收波长为430 nm,然后在波长430 nm处分别测得其吸光度。以姜黄素含量(mg/g)为横坐标(x),以吸光度为纵坐标(y),绘制得到姜黄素的标准曲线为y=0.040 9x+0.002 9,R2=0.999。
1.3.5.3 姜黄素在肠液中的标准曲线
根据《中国药典》配制pH 6.8的肠液,方法同1.3.5.2节,测得姜黄素肠溶液最大吸收波长为371.5 nm。绘制得到姜黄素的标准曲线为y=0.032 9x+0.002 6,R2=0.999 1。
1.3.6 OMTCS负载姜黄素测试
配制500 mg/L的姜黄素-乙醇溶液。取数个25 mL锥形瓶,加入20 mL配制好的姜黄素-乙醇溶液和30 mg的OMTCS,放置在立式振荡培养箱中。分别设置17、27、37 ℃三个温度梯度进行负载测试。取样时间点为20、40、60、100、1 440 min,每次取样100 μL。稀释100 倍后,利用紫外分光光度计在姜黄素最大吸收波长425 nm处测其吸光度。负载量按式(1)计算:
式中:q为药物负载量/(mg/g);C1为吸附前姜黄素的质量浓度/(mg/mL);C2为吸附后姜黄素的质量浓度/(mg/mL);V为吸附的溶液体积/mL;m为吸附材料OMTCS的用量/mg。
1.3.7 姜黄素的体外模拟缓释实验
缓释实验以《中国药典》中“缓释、控释和迟释制剂指导原则”为依据。取250 mL烧杯,分别加入100 mL的模拟胃液和模拟肠液,同时加入10 mg的OMTCS-姜黄素(载药量为51.5 mg/g)。将烧杯放置在立式振荡培养箱中固定,转速设为160 r/min,温度设为37 ℃,模拟体外缓释。取样时间点为10、30、60、100、150、240、420、690、1 050、1 440 min。每次取样5 mL,样品溶液用有机膜过滤后在紫外分光光度计下检测其吸光度。累计缓释率按式(2)计算:
式中:Mt为药物累计缓释率/%;Ci为第i次置换时释放液中的姜黄素质量浓度/(mg/mL);D为药物的负载量/(mg/g);m为载药后材料的质量/g;n为介质的置换次数;Ve为释放介质置换体积/mL;V0为起始释放液体积/mL。
1.3.8 1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)抗氧化性实验
DPPH是一种很稳定的氮中心的自由基,当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量呈定量关系[18]。参考焦思宇等[19]的方法,首先配制50 μg/L的DPPH自由基溶液,取数个10 mL离心管,实验组时间梯度设为10、20、40、60、120、720、1 440、2 880 min,分别加入10 mL的DPPH自由基溶液和10 mg的OMTCS-姜黄素(载药量为66 mg/g)。对照组加入0.66 mg的姜黄素粉末,时间梯度设为10、20、40、60、120 min。反应完成时,及时取出上清液,使用紫外分光光度计在DPPH最大吸收波长515 nm处测得其吸光度。DPPH自由基清除率按式(3)计算:
式中:D为DPPH自由基清除率/%;A0为DPPH自由基初始溶液的吸光度;A1为加入载药材料后DPPH自由基溶液的吸光度;AD为载药材料在同体积无水乙醇中的吸光度。
1.4 数据处理
所有实验均设有3 组平行实验组,使用WPS Office软件进行实验数据统计,使用Origin 2018软件对实验数据进行绘图。
2 结果与分析
2.1 扫描电子显微镜分析
如图1所示,OMTCS表面呈现出三维多孔结构,孔道分布深,其内壁多层疏松。此结构归功于甜瓜醛与壳聚糖的交联反应,使OMTCS分子间不仅存在TPP与壳聚糖的静电作用力,还有新共价键的生成,而硫醇的加入使共价键进一步饱和。让OMTCS自身超轻质量的同时还具有良好的机械强度,经过多次挤压还能够恢复形貌。

图1 OMTCS表面扫描电镜图Fig.1 SEM images of OMTCS surface
2.2 傅里叶变换红外光谱仪分析
如图2 所示,甜瓜醛红外谱图呈现出明显的醛类化合物特征,1 726 cm-1(s)处为R—CHO的特征峰,2 918 cm-1(m)和2 858 cm-1(m)处为甜瓜醛上—CH3的不对称与对称伸缩振动峰,2 928 cm-1(m)处为C—CH2—C不对称伸缩振动峰。2 812 cm-1(w)和2 705 cm-1(w)处谱带是—CHO的Fermi共振带,这是由于醛基中C—H伸缩振动和C—H弯曲振动(1 377 cm-1)的倍频之间Fermi共振的贡献。

图2 傅里叶变换红外色谱分析和反应示意图Fig.2 FTIR spectra and reaction routes
对比TCS、MTCS两条谱带,TCS谱带3 450 cm-1(s)处为伯胺的N—H伸缩振动峰[20],而MTCS谱带上此峰已经不明显或不存在,这是由于甜瓜醛的醛基与壳聚糖上的胺基发生了席夫碱反应,生成了新的化学键。同时醛基还与壳聚糖上的羟基发生缩醛反应,减少了3 350 cm-1附近O—H缩振动的干扰,因此MTCS谱带在3 275(s)、3 191 cm-1(s)处出现了双峰,判断为伯酰胺吸收峰。
对比MTCS和OMTCS两条谱带,MTCS谱带在1 654 cm-1(s)处为C=C键的伸缩振动峰,而OMTCS谱带在此范围处的1 669 cm-1(w)峰为酰胺I带C=O键的吸收峰[21]。在壳聚糖活泼胺基的存在下,可以说明硫醇的巯基与MTCS上的碳碳和碳氮双键发生了Micheal加成反应[22-23],生成了新的化学键。并且OMTCS谱带上2 920 cm-1(m)处的C—CH2—C不对称伸缩振动峰也可证明甜瓜醛或硫醇成功接枝到壳聚糖上。
2.3 X射线光电子能谱分析
如图3所示,在OMTCS全谱中看到,峰位284.4 eV处是C 1s轨道的电子束缚能[24],碳元素占比为70.86%,相较于TCS全谱图中的碳元素占比60.18%,增加了10.7%,表明有甜瓜醛或正十八硫醇接枝到了OMTCS上。而峰位162.79 eV处是S 2p轨道的电子束缚能,硫元素占比为1.17%,证明了OMTCS上硫元素的存在。通过进一步分析OMTCS的精细S谱图发现了劈裂峰的存在,2 个峰位分别为163.18、164.28 eV,分别是2p3/2和2p1/2轨道的电子束缚能,164.28 eV为R—SH键的结合能,163.18 eV为R—S—R键的结合能。而同一类型的硫也会以劈裂峰的形式存在[25],因此判断此劈裂峰为硫醚键的结合能,证明了正十八硫醇在壳聚糖气凝胶上成功接枝。
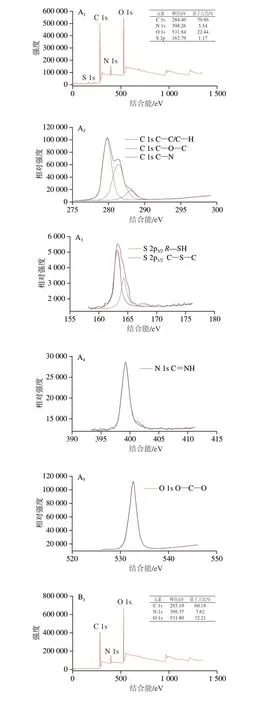
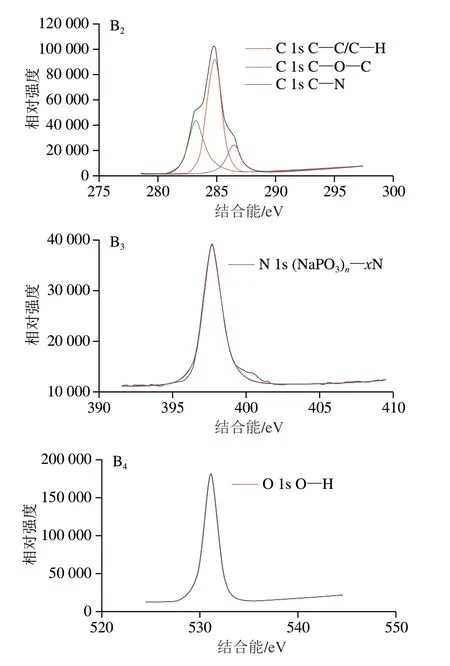
图3 TCS和OMTCS X射线光电子能谱分析Fig.3 XPS analysis of TCS and OMTCS
比较OMTCS和TCS的精细C谱图,峰位284.8 eV同为C—C键的结合能,OMTCS谱图中峰位286.36 eV与TCS谱图中峰位286.46 eV同为壳聚糖C—O—C键的结合能[26]。而OMTCS谱图中的峰位288.07 eV为C=N键的结合能,这是由于甜瓜醛的—CHO与壳聚糖的—NH2发生席夫碱反应生成了C=N键,进一步说明甜瓜醛接枝到了壳聚糖气凝胶上。
比较OMTCS和TCS的精细N谱图,OMTCS谱图中的峰位是399.25 eV,查阅相关资料发现峰位400 eV是C—NH2键的结合能,由此可以判断是—NH2得质子后,H+引起了峰位偏离[27]。而TCS谱图中的峰位397.77 eV为钠磷氧氮化物[(NaPO3)n—xN]的结合能[28],这是TPP的P3与壳聚糖的—N发生离子交联的结果。
2.4 X射线衍射仪分析
如图4所示,对比OMTCS和TCS两个谱图,双峰处在同一位置,但是OMTCS谱图的双峰明显更窄。使用软件MDI Jade 6计算其结晶度,除去半峰宽5°以上的峰。OMTCS的结晶度为12.45%,TCS的结晶度仅为0.05%。因为壳聚糖气凝胶从TCS转变为OMTCS后,部分离子键破裂,新的共价键生成,甜瓜醛直链分子与壳聚糖分子交错,导致壳聚糖气凝胶分子排列更为紧密,提高了壳聚糖气凝胶的结晶度[29]。

图4 TCS和OMTCS X射线衍射谱分析Fig.4 XRD analysis of TCS and OMTCS
2.5 热重分析
如图5所示,对比OMTCS和TCS两条图谱可以看到,前者在81.9 ℃时质量损失速率达到第1个峰值-2.15%/min,后者在85.5 ℃时质量损失速率达到第1个峰值-2.72%/min,可以推断在此范围是结合水质量的损失[30]。OMTCS在284.7 ℃时质量损失速率达到第2个峰值-8.97%/min,而TCS质量损失速率的第2个峰值在305.6 ℃时,最大质量损失速率为-9.04%/min。两者都在206~330 ℃范围内质量损失速率进一步增加,这是由于升温引起壳聚糖C—O—C等化学键的断裂。热稳定性与化学键的能量有关,而OMTCS质量更容易损失是因为交联后生成的共价键较TCS的离子键结合能低,加热使分子结构更容易被破坏,导致质量损失速率更高。加热到798.8 ℃时,OMTCS共损失94.07%的质量,TCS损失了71.82%的质量。结果表明,OMTCS热稳定性较TCS有所下降。

图5 TCS和OMTCS热重分析Fig.5 TGA of TCS and OMTCS
2.6 接触角测量仪测试
图6A1为油滴下落后100 ms时的变化,此时油滴几乎已经渗进其表面,接触角为29.7°,在190 ms时(图6A2)油滴已经完全渗进OMTCS的表面,油滴接触角为0°。表明OMTCS表面对油滴具有超强的亲和力。壳聚糖原本为亲水物质,但是经改性制备得到的OMTCS在水滴测试下,水滴几乎以完整的球状附着在OMTCS表面,其接触角为126°(图6B),呈现出良好的疏水性[30]。结果证明了改性后的壳聚糖气凝胶具备亲脂的特性。

图6 油滴和水滴在OMTCS表面的接触角测试图Fig.6 Contact angle test of oil and water droplets on OMTCS surface
2.7 OMTCS负载姜黄素
姜黄素作为一种脂溶性药物,对于OMTCS有着良好的亲和力。如图7所示,温度在17 ℃时,在60 min达到最大负载量66.2 mg/g。温度27 ℃时,在40 min达到最大负载量70.5 mg/g。而温度37 ℃时的最大负载量为62.9 mg/g,时间为40 min。由于温度较低时分子热运动慢,限制了姜黄素-乙醇溶液在OMTCS结构内部扩散,因此相较于27 ℃,温度在17 ℃时的吸附平衡时间后移,最大负载量减少。当吸附温度为37 ℃时,分子热运动虽然加快,但是由于吸附时放热,温度升高反而导致吸附平衡左移,造成最大负载量下降。3 组温度的负载测试几乎都在100 min时到最终平衡。结果表明,OMTCS负载姜黄素的最佳温度为27 ℃,最佳负载时间为40 min。
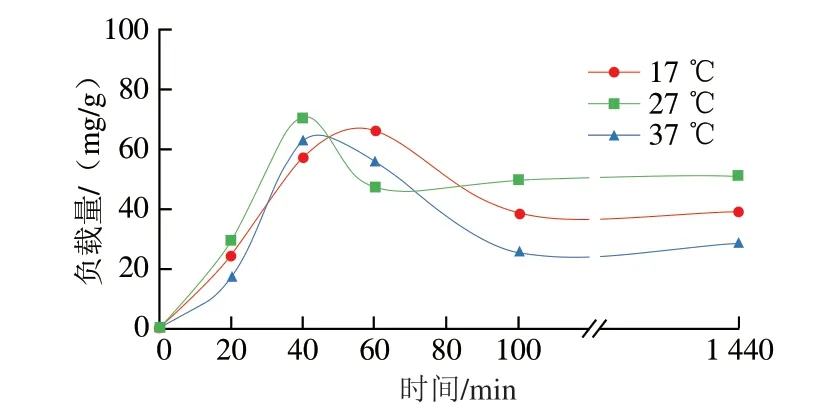
图7 OMTCS在不同温度下对姜黄素的吸附Fig.7 OMTCS loading of curcumin at different temperatures
2.8 姜黄素缓释及抗氧化性能
如图8A所示,姜黄素在肠液中7 h内持续缓慢释放,恰好是大多数食物在人体小肠内的停留时间[31]。缓释率在7 h达到最大值,直至24 h都趋于平缓,最大缓释率达到89.6%。姜黄素在胃液中缓释2.5 h达到平衡,最大缓释率为19.3%,较肠液中的缓释效率低。判断是由于胃液极酸的环境下加速了姜黄素的分解。图8B表明,OMTCS-姜黄素在24 h内持续具有自由基清除能力,自由基最大清除率为51.5%,而对照组中的姜黄素仅在40 min就基本反应完毕,达到自由基最大清除率87.54%。证明OMTCS-姜黄素具备良好的缓释性能。
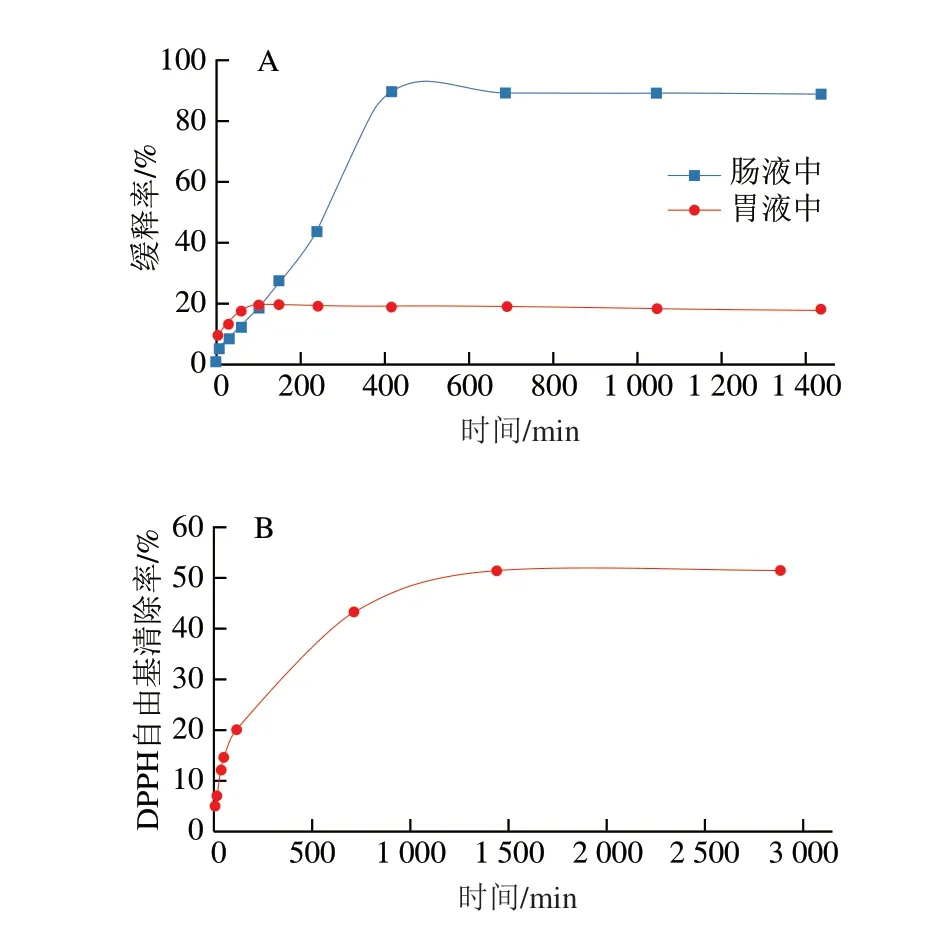
图8 姜黄素体外模拟缓释(A)和OMTCS-姜黄素抗氧化性测试(B)Fig.8 In vitro sustained release of curcumin (A) and antioxidant activity of OMTCS-curcumin (B)
3 结 论
利用离子交联法制备得到壳聚糖气凝胶的基础上,以甜瓜醛和正十八硫醇作为交联改性剂,最终制备得到OMTCS。通过傅里叶变换红外光谱和X射线光电子能谱分析,证明了甜瓜醛与壳聚糖发生了席夫碱反应而成功接枝得到MTCS。在后续实验中,发现了直链醛对于壳聚糖气凝胶的交联效果优于其他醛类。并且醛本身的热稳定性对于交联反应的结果也十分重要。之后利用正十八硫醇在MTCS上进一步加成,在X射线光电子能谱分析下测得OMTCS表面硫元素含量为1.17%。通过交联改性壳聚糖气凝胶的疏水性能得到极大改善,从接触角测试可以看到,OMTCS与水滴的接触角达到126°,体现了OMTCS良好的疏水特性。对姜黄素的负载研究结果表明,OMTCS对于脂溶性药物姜黄素有着良好的吸附效果。在室温27 ℃达到最大负载量70.5 mg/g。体外模拟缓释研究结果表明,OMTCS-姜黄素在肠液中有着良好的缓释效果,能够在7 h内持续缓释,最大缓释率达到89.6%,缓释率优于复合纳米颗粒-姜黄素的83.8%[32]。本研究为壳聚糖基载药材料对于亲脂性药物的负载和缓释提供了参考。
