整合教材内容 联系高考试题 促进深度学习
——以“相似相溶规律的复习”为例
2023-10-21刘德忠
刘德忠
(昆明市第一中学,云南 昆明 650031)
深度学习是学生对核心课程知识的深度理解,以及在真实的问题和情境中应用这种理解的能力。比格斯和柯利斯基于皮亚杰的认知发展理论,把学生对于某个问题的学习程度划分为五级水平:前结构层次、单点结构层次、多点结构层次、关联结构层次和拓展抽象结构层次,并认为后三级水平是深度学习的结果[1]。整合教材内容,融会贯通前后知识,重新归类和组合,使零散的知识变得有序,实现知识的系统性、综合性和应用性,即从学习结果看,实现多点结构层次、关联结构层次和拓展抽象结构层次。本文以“相似相溶”规律的复习为例,说明如何“整合教材内容,联系高考试题,促进深度学习”。
1 人教版教材中与溶解性相关内容
利用表格,梳理人教版九年级初中化学、高中化学必修和选择性必修教材中与溶解性相关的内容,如表1所示。
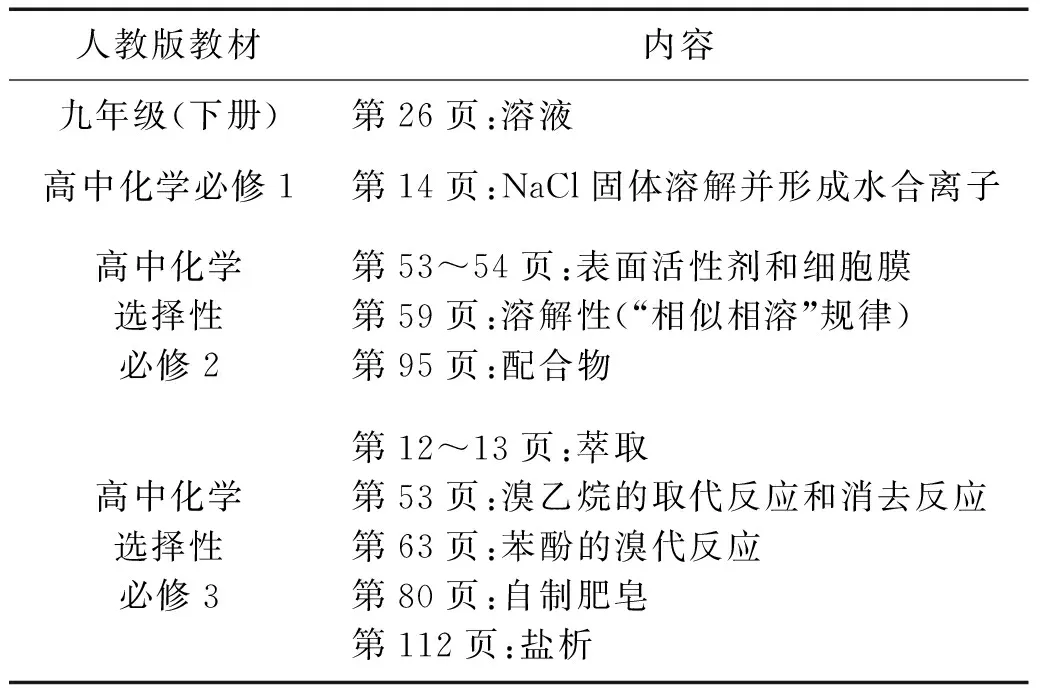
表1 人教版教材中与溶解性相关内容
2 回归教材,深度学习物质溶解于水的微观解释
“必修1”解释电解质的电离,依据“异种电荷相互吸引”,从微观的角度也解释了NaCl固体溶解于水的过程。将NaCl固体加入水中时,水分子中带部分负电荷的氧原子一端吸引Na+,带部分正电荷的氢原子一端吸引Cl-,在水分子的作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子,如图1所示。
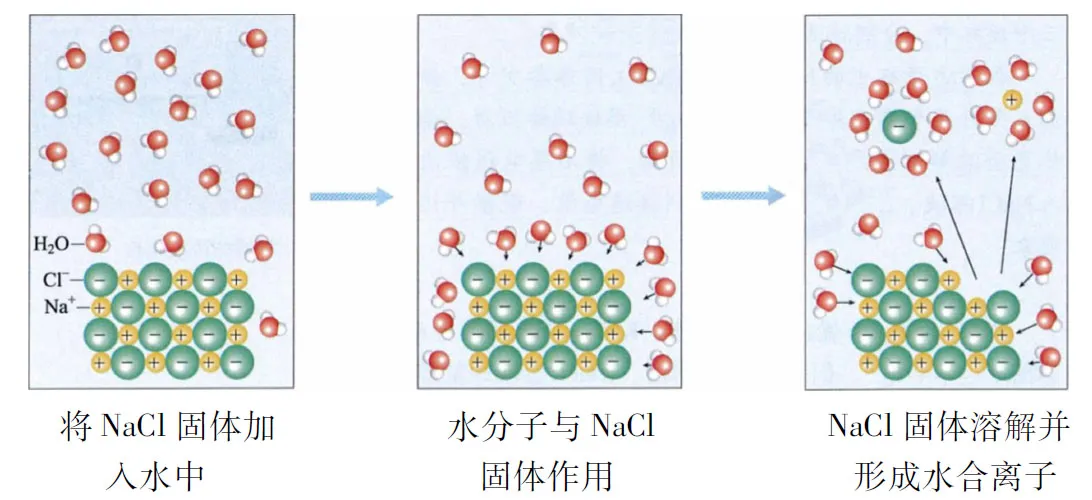
图1 NaCl固体在水中的溶解和形成水合离子示意图
与NaCl固体溶解于水的过程相类似,任何物质的溶解必定伴随着溶剂化,即溶质分子或离子通过静电作用、氢键、范德华引力,甚至配位键,与溶剂分子作用产生溶剂化的粒子,促进溶解过程[2]。例如,白色固体CuSO4溶解于水,溶液呈蓝色,是因为Cu2+被水溶剂化生成了水合离子[Cu(H2O)4]2+;CuCl2溶于水呈蓝绿色,是因为溶剂化过程生成了[Cu(H2O)4]2+(蓝色)和[CuCl4]2-(黄色)。

3 整理“相似相溶”规律的五大应用,促进深度学习
3.1 判断常见物质的溶解性
3.1.1 根据分子的极性判断
H2、N2、O2、CH4、C2H4、C2H6、CCl4、苯等是非极性分子,水是极性溶剂,根据“相似相溶”,它们都难溶于水。
HF、HCl、HBr、HI等是极性分子,水是极性溶剂,根据“相似相溶”,它们都极易溶于水。
已知白磷和硫是非极性分子,由此可推知二者都难溶于水,易溶于CS2。在实际工作中,常用CS2溶解白磷和硫。
已知NaCl、NaOH、KNO3等离子化合物有强极性,由此可推知它们易溶于水,不易溶于苯等有机溶剂。
3.1.2 根据分子结构的相似性判断
C2H5OH与H—OH任意比互溶,可理解为一个“C2H5—”取代水中的一个“H”,都含有“—OH”,结构相似,所以相溶。类似物质还有CH3OH和CH2OHCHOHCH2OH等。同时,因为“C2H5—”的存在,所以乙醇能溶解有机物。
苯酚与溴水反应生成白色沉淀,取适量的苯酚稀溶液,滴入过量的浓溴水。原因是若苯酚过量,根据“相似相溶”的规律,产物2,4,6—三溴苯酚将溶于苯酚中而不会出现明显的沉淀,不利于观察实验现象。
3.1.3 因溶质与水发生化学反应,溶解性增强
1)CO2、Cl2是非极性分子,但它们都能溶于水,原因是它们与水发生化学反应,可增大溶解度。例如,Cl2溶于水,溶剂化作用使部分Cl—Cl断裂,带部分负电荷的Clδ-结合H2O中带部分正电荷的Hδ+,形成 H—Cl,带部分正电荷的Clδ+结合H2O中带部分负电荷的HOδ-形成H—O—Cl。由于新生成的O—Cl不容易断裂,溶剂化作用则演变成化学反应[3]。
2)SO2是极性分子,且SO2能与水反应,所以SO2易溶于水。
3.1.4 溶质分子与水分子之间形成氢键,溶解性增强
NH3是极性分子,NH3能与水反应,且NH3与H2O分子间能形成氢键,所以NH3极易溶于水。
3.1.5 疏水基团和亲水基团共同影响有机物的溶解性
醇羟基、醛基、羧基和磺酸基等为亲水基团,而烃基、碳卤键、硝基和酯基等为疏水基团。
1)甲醇、甲酸、乙酸、乙醛、丙酮、乙二醇和丙三醇等以亲水基团影响为主,它们易溶于水;由于都为有机物,它们又易溶于乙醇。
2)在烃的含氧衍生物中,烃基中碳原子数越多,烃基的疏水性影响越大,含氧衍生物的溶解度越小。例如,醇在水中的溶解度一般随分子中碳原子数的增加而降低;又如,一元羧酸在水中的溶解度一般随分子中碳原子数的增加而迅速减小,甚至不溶于水。
3)烷基磺酸钠、十八酸钠和十八烯酸钠等表面活性剂,它们都同时含有亲水基团和疏水基团,亲水基团溶于水,而疏水基团包裹油渍,在搓洗下,油渍转移到水中而去污。
当然“相似相溶”仅为经验规律,不能解决所有的溶解问题。例如,溴乙烷、溴苯、硝基苯、乙酸乙酯等虽为极性分子,但溴乙烷和溴苯不溶于水,硝基苯几乎不溶于水,乙酸乙酯微溶于水;又如,NH4VO3为铵盐,却微溶于冷水,NaBiO3为钠盐,却不溶于冷水。
3.2 依据“相似相溶”规律,增大物质的溶解度
3.2.1 改变溶剂,增大溶解度
1)因为酚酞几乎不溶于水,而溶于乙醇,所以常用酚酞溶液的配制为:先将 1 g 酚酞溶于 60 mL 乙醇中,再用水稀释至 100 mL。
2)溶解钠、铝和金等金属,可选用汞做溶剂(广义的“相似相溶”)。
毛刷实验:把铝放入Hg(NO3)2溶液中,Hg(NO3)2可穿透致密氧化铝保护膜,与铝发生置换反应,生成液态金属汞。铝与汞形成“铝汞齐”(铝汞齐就是铝和汞形成的溶液)。由于铝汞齐的存在使铝片表面不易形成致密的氧化膜,生成的“白毛”(氧化铝)越来越多。
3.2.2 通过化学反应,改变溶质,增大溶解度
1)2019年全国Ⅲ卷第28题:实验室通过水杨酸进行乙酰化制备阿司匹林,实验过程将所得乙酰水杨酸结晶粗品加入到饱和碳酸氢钠溶液中,其目的是生成可溶的乙酰水杨酸钠,以便过滤除去难溶杂质。
2)2020年全国II卷第27题:实验室可通过甲苯氧化制苯甲酸,当回流液不再出现油珠即可判断反应已完成,理由是不溶于水的甲苯已经完全被氧化。
3)分离苯酚和苯的混合物。苯酚和苯两种物质互溶而形成混合物。二者的分离不能用浓溴水,因为2,4,6—三溴苯酚也溶于苯。二者的分离可用烧碱溶液。苯酚与烧碱溶液反应生成苯酚钠,苯酚钠溶于水,且苯不与烧碱反应,也不溶于水,则两者分层。由于苯的密度比水小,在溶液的上层,分液,上层液体即得苯,下层液体即苯酚钠溶液,向其中通入足量二氧化碳气体,生成苯酚。
3.2.3 I2难溶于水,如何增大碘水溶液的浓度
1)因为碘易溶于乙醇,乙醇与水互溶,所以可将碘溶于乙醇,再加水稀释,制得浓度较大的碘水。
3.3 依据“不相似不相溶”规律,减小物质溶解度
3.3.1 盐析
根据“相似相溶”的规律:无机盐溶解增加了水溶液的极性,使溶液中大部分自由水转变为离子化水,使有机物与水分子作用降低,故降低了有机物在水相中的溶解度,从而使有机物从溶液中析出。常见实验有:
1)使用饱和Na2CO3溶液接收乙酸乙酯制备实验中的有机蒸发液,其作用是吸收乙酸,溶解乙醇,降低乙酸乙酯在水中的溶解度,利于乙酸乙酯分层析出。
2)向蛋白质溶液中加入某些浓的无机盐[如(NH4)2SO4、Na2SO4等]溶液后,可以使蛋白质凝聚而从溶液中析出。
3.3.2 晶体的洗涤
“不相似不相溶”的规律还被广泛应用于过滤后晶体的洗涤。如2021年全国甲卷第27题:某小组用工业废铜制备胆矾。由于滤出的CuSO4·5H2O晶体易溶于水,难溶于乙醇,故必须使用乙醇洗涤除去杂质,既减少晶体的溶解损耗,又利于晶体快速干燥。
3.4 “相似相溶”规律的重要应用——萃取
萃取是利用待分离组分在两种不互溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程。萃取能够发生的原因是溶质在萃取剂中的溶解度比在原溶剂中大,且萃取剂与原溶剂互不相溶。中学阶段萃取的常见类型如表2。

表2 常见萃取剂及其应用范围[4]
3.4.1 萃取有机物
有机物在有机溶剂中的溶解度,一般比在水中的溶解度大,所以可用有机萃取剂将它们从水溶液中萃取出来。从表2可看出,也存在用无机试剂从有机混合物中萃取分离出目标有机物的情况。
3.4.2 萃取金属离子
金属离子亦可被萃取至有机相,已知磷酸三丁酯能将Ce3+从水溶液中萃取出来(2013年安徽卷),8-羟基喹啉被广泛用作金属离子的络合剂和萃取剂(2018年北京卷)。
3.4.3 萃取H2O2
2016年全国Ⅱ卷第36题:常采用蒽醌法生产双氧水。
①蒽醌法制备H2O2配制工作液时采用有机溶剂而不采用水的原因是乙基蒽醌(乙基氢蒽醌)不溶于水,易溶于有机溶剂。
②萃取塔中的萃取剂是水,选择其作萃取剂的原因是H2O2溶于水被水萃取,乙基蒽醌不溶于水。
另外还应特别关注两个问题:
第一,萃取时正确判断水相和有机相是十分重要的。当萃取分层难以判断时,为了弄清楚哪一层是水溶液,可任取其中一层的少量液体置于试管中,并滴加少量水,若分为两层,说明该液体为有机相。若加水后不分层,则是水溶液。
第二,深度思考反萃取原理。反萃取是将溶质从有机相转入水相的过程。反萃取一般与平衡移动有关。举例如下:
①萃取过程亦可发生相关化学反应。
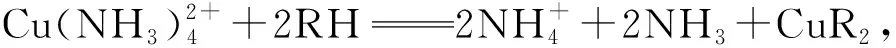
②调节溶液酸碱性,平衡移动,发生反萃取。如以低品位含钒金属共生矿制备V2O5的工艺流程,见图3,该矿中含有V2O3、VO2、SiO2、FeS2、Al2O3。
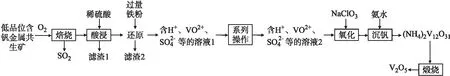
图3 以低品位含钒金属共生矿制备V2O5的工艺流程

3.5 “相似相溶”规律与自制肥皂
教材中自制肥皂的实验,能多角度帮助学生理解并应用“相似相溶”规律,高三复习,有必要再学习。①反应物中加入乙醇的原因:NaOH溶液溶于乙醇,且植物油也溶于乙醇,则植物油与NaOH溶液融为均一的液体,提高油脂的皂化反应速率。②皂化反应是否完全的判断方法:用玻璃棒蘸取水解溶液,点在水面上,若没有漂浮的油花,则皂化反应完全。③向皂化液中加入饱和食盐水的原因:溶液的极性增强,高级脂肪酸钠的溶解度减小,发生盐析效应,所以会析出大量固体。
4 绘制“相似相溶”规律应用的思维导图,促进深度学习
“相似相溶”规律应用的思维导图见图4。

图4 “相似相溶”规律应用的思维导图
5 结语
物质的溶解性与溶剂的种类有关,与是否形成氢键有关,还与是否发生反应等有关。“相似相溶”是一个经验规律,“极性相似”和“结构相似”是由经验形成的流行语。物质的溶解性繁琐零碎,充满“个性”,但“相似相溶”规律能帮助理解大量溶解性的问题。笔者认为,深度学习就是基于理解的学习,基于整合的学习,基于情境的学习。深度学习就是理解了“相似相溶”,帮助我们解决与溶解性相关的一系列实验问题的学习。有意义的学习需要整合新旧知识,形成系统的知识体系。单个知识点,学生容易忘记,且难以理解。只有将知识点置于情境中,整合于体系中,学生才容易接受,触发深度学习。本文复习模型简化为:分析教材→整合教材→应用拓展→绘制思维导图。
