C-TIRADS及BRAFV600E基因检测对细针穿刺细胞学难以定性的甲状腺结节的诊断价值*
2023-10-20董维露吴意赟周正国汪向前蔡婷孙卉娟
董维露 吴意赟 周正国 汪向前 蔡婷 孙卉娟
(南京中医药大学附属医院超声医学科,江苏 南京 210001)
我国通过甲状腺超声检查的甲状腺结节检出率有24.4%~61.9%[1-3]。2009年,智利学者受乳腺影像数据与报告系统(Breast Imaging Reporting and Data System, BIRADS)启发,率先提出了甲状腺影像数据与报告系统(Thyroid Imaging Reporting and Data System, TIRADS)[4],随后国内国际多个学者相继建立了各自TIRADS标准[5-7],导致目前国内TIRADS应用的混乱[8-9],不同医生对同一份超声报告的解读也出现困难。为解决这一问题,中华医学会超声医学分会2020年正式颁布基于中国国情和医疗状况的C-TIRADS(Chinese-TIRADS)[10]。
甲状腺结节细针穿刺抽吸(Fine Needle Aspiration,FNA)是术前确定甲状腺结节性质创伤最小、最可靠的检查,但仍有20%的甲状腺结节无法定性[11]。甲状腺FNA细胞学难以定性的诊断包括标本不满意或无法诊断、意义不明确的非典型病变或滤泡性病变、滤泡性肿瘤或可疑滤泡性肿瘤、可疑恶性肿瘤。联合丝/苏氨酸特异性激酶基因突变(BRAFV600E)是甲状腺乳头状癌的最常见的突变基因[12-14],目前BRAFV600E基因检测是FNA的重要补充方法。本研究旨在对细胞学难以定性的甲状腺结节展开研究,分析C-TIRADS及BRAFV600E基因检测对此类甲状腺结节的诊断效能,为甲状腺结节的临床管理提供理论依据。
1 资料与方法
1.1 一般资料 纳入我院2020年2月—2021年4月就诊的甲状腺手术患者53例行回顾性分析。纳入标准:①术前完成甲状腺超声检查、FNA、BRAFV600E基因检测。②甲状腺结节细胞学诊断结果为标本不满意或无法诊断、意义不明确的非典型病变或滤泡性病变、(可疑)滤泡性肿瘤及可疑恶性肿瘤。③完成甲状腺手术。排除标准:①甲状腺超声图像不全。②甲状腺FNA或手术病理资料不全。
1.2 仪器与方法 采用Philips iU Elite、Philips iU 22、Cannon Aplio i900超声诊断仪,线阵探头,频率7~12 MHz,观察并记录甲状腺结节位置、大小、是否实性成分、回声类型、边缘是否光整、是否钙化及钙化类型等形态学形态特征,依据2020年C-TIRADS指南[5]用计数法对每个结节进行评分,阳性指标有垂直位、实性、极低回声、点状强回声或可疑微钙化、边缘模糊(不规则)或甲状腺外侵犯,每个阳性指标计1分,阴性指标为彗星尾征,计-1分,最后计算总分值给每个甲状腺结节按分类规则[5]进行C-TIRADS分类(见表1)。本研究将C-TIRADS 4 A及以下归为良性,C-TIRADS 4 B及以上归为恶性。

表1 基于计数法的C-TIRADS
1.3 甲状腺结节FNA及BRAFV600E基因检测 所有患者术前均签署知情同意书。取平卧位,充分暴露颈部后消毒、铺无菌洞巾,在超声引导下使用多用途千叶针(德迈特,23G)穿刺甲状腺结节,穿刺针位于结节中央时拔出针芯,在甲状腺结节不同方位上反复提插,用注射器将细胞学标本置于载玻片上,推片后置于95%无水乙醇固定,标本送至病理科进行染色、阅片。完成甲状腺结节穿刺后,将穿刺针置于BRAFV600E基因检测液中冲洗,标本送至病理科检测BRAFV600E基因是否突变。FNA穿刺及病理细胞学阅片均由5年以上相应工作经验的医师完成。C-TIRADS联合BRAFV600E基因检测诊断甲状腺结节的方法:若C-TIRADS、BRAFV600E基因检测任一检查结果出现阳性,那么联合诊断结果即视为阳性,若两种检查结果均为阴性,那么联合诊断结果即视为阴性。
1.4 病理诊断 甲状腺结节细胞学诊断依据Bethesda分为6类[15]:Ⅰ为标本不满意或无诊断意义; Ⅱ为良性; Ⅲ为意义不明确的非典型病变或滤泡性病变; Ⅳ为滤泡性肿瘤或可疑滤泡性肿瘤; Ⅴ为可疑恶性肿瘤; Ⅵ为恶性肿瘤。本研究将Ⅰ、Ⅲ、Ⅳ及Ⅴ类归为细胞学难以定性甲状腺结节。甲状腺术后标本送至病理科石蜡包埋,由一名5年以上病理科医师依据2017版WHO甲状腺肿瘤分类标准[16]给出常规病理诊断。
1.5 统计学分析 采用SPSS 22.0统计软件进行统计分析,采用卡方检验比较C-TIRADS、BRAFV600E基因检测及二者联合诊断对甲状腺乳头状癌的诊断效能,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料 纳入的53例患者中62个结节,其中44例1个结节,9例2个结节;女47例,男6例。患者年龄23~70岁,平均(48.72±12.73)岁,中位年龄51.00岁。62个甲状腺结节中3个位于峡部、24个位于右叶、35个位于左叶,大小0.30~3.30 cm,平均(0.88±0.61)cm,中位大小0.70 cm。
2.2 病理结果 甲状腺结节细胞学诊断结果有7个标本不满意或无诊断意义,36个意义不明确的非典型病变或滤泡性病变,4个为滤泡性肿瘤或可疑滤泡性肿瘤,15个为可疑恶性肿瘤。62个结节术后常规病理结果中有22个良性40个恶性,良性结节中有16个结节性甲状腺肿、1个局灶性结节增生、1个桥本氏甲状腺炎、1个肉芽肿性甲状腺炎、2个腺瘤、1个非浸润性包裹性滤泡性肿瘤,恶性结节病理类型均为甲状腺乳头状癌。
2.3 C-TIRADS及BRAFV600E基因检测对细胞学难以定性的甲状腺结节诊断结果 62个甲状腺结节中,所有BRAFV600E基因检测出突变的甲状腺结节均为恶性,良性结节均未检出BRAFV600E基因突变,40个恶性结节22个检测出基因突变,约占55.00%。对于C-TIRADS 4 B及以上的甲状腺结节,无BRAFV600E基因突变恶性率与总体恶性率差异无统计学意义(χ2=0.223,P=0.637)。在40个BRAFV600E基因未突变的甲状腺结节中,C-TIRADS 3~4A类结节恶性率与C-TIRADS 4 B~5类差异均有统计学意义(χ2=6.825,P=0.009)。见表2。典型病例,见图1、图2。

图1 典型病例1

图2 典型病例2
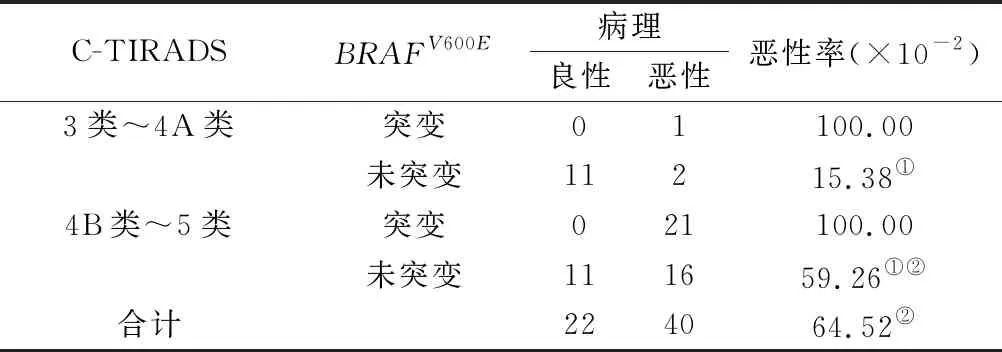
表2 C-TIRADS及BRAFV600E基因检测对甲状腺结节诊断结果
2.4 C-TIRADS、BRAFV600E基因检测及联合诊断对细胞学难以定性的甲状腺癌诊断效能 C-TIRADS和联合诊断的敏感性差异无统计学意义(χ2=0.000,P=1.000),两者敏感性均明显高于BRAFV600E基因检测(χ2=14.528,P<0.001;χ2=17.067,P<0.001)(典型病例,见图3)。C-TIRADS和联合诊断特异性均为50.00%,显著低于BRAFV600E基因检测(χ2=14.667,P<0.001)。C-TIRADS和联合诊断阳性预测值显著低于BRAFV600E基因检测(χ2=4.377,P=0.036;χ2=4.255,P=0.039),C-TIRADS和联合诊断阳性预测值差异无统计学意义(χ2=0.003,P=0.956)。C-TIRADS、BRAFV600E基因检测及联合诊断阴性预测值及准确性两两之间进行比较差异均无统计学意义(P>0.05)。见表3。
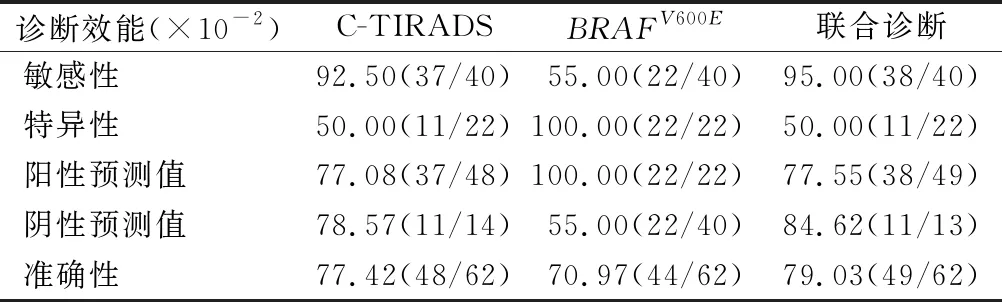
表3 C-TIRADS、BRAFV600E基因检测及联合诊断对细胞学难以定性的甲状腺癌诊断效能
3 讨论
甲状腺结节FNA是术前确定甲状腺可疑结节性质的关键手段,对甲状腺癌也有较好的诊断效能,其敏感性为68.5%~90.0%,特异性为70.0%~96.0%[17-19],但其诊断结果的准确性依赖标本的满意度,而标本的满意度又依赖操作者的技术水平。Wu等[20]对651例患者超声引导下甲状腺结节FNA的研究显示,所有结节均由细胞病理学专家阅片,其中 283例由细胞病理学专家穿刺,368例由非细胞病理学专家(非影像科医师、非内分泌科医师)穿刺,细胞病理学专家组标本不满意或无法诊断的发生率明显低于非细胞病理学专家组(2.8%vs21%)。本研究样本中有11.29%(7/62)的FNA穿刺标本不满意或无法诊断,此类结节存在5%~10%的恶性风险,按照甲状腺细胞病理学Bethesda分类系统指南,此类结节应在超声引导下重复穿刺[15]。甲状腺病理细胞学诊断为意义不明确的非典型病变或滤泡性病变、滤泡性肿瘤或可疑滤泡性肿瘤、可疑恶性肿瘤分别有6%~18%、10%~40%、45%~60%的恶性危险[15],其恶性危险跨度较大,给临床下一步的诊疗方向带来困惑。
2003年BRAFV600E基因首次被报道,与甲状腺乳头状癌的发生高度相关,近年来在临床的应用越来越广泛。根据以往文献[21-23]报道,BRAFV600E基因检测对甲状腺癌诊断的敏感性有65.4%~88.7%,本研究的敏感性为55.00%(22/40),与文献报道的结果差别较大,可能与本研究选择的样本仅仅为甲状腺细胞学难以定性有关系。另外,18个甲状腺癌BRAFV600E基因检测为假阴性,这可能与其他基因突变所导致甲状腺癌有关,未来多基因的检测可降低甲状腺癌BRAFV600E假阴性。62个甲状腺结节中共有22个BRAFV600E基因突变,对甲状腺癌诊断的特异性及阳性预测值均高达100.00%。Paek等[24]报道BRAFV600E基因突变对甲状腺癌诊断的特异性及阳性预测值与本研究结果基本一致。本研究中共有48个C-TIRADS 4B及以上的甲状腺结节,在27个未检测到BRAFV600E基因突变中有16个为恶性,与总体样本中的恶性率没有统计学差异,此结果意味着对于细胞学难以明确诊断的甲状腺结节,如果C-TIRADS分类为4 B及以上,即使BRAFV600E基因检测结果为阴性,并不能排除其恶性的可能性。
超声检查是甲状腺首选的影像学检查,2020年中华医学会超声医学分会根据我国医疗现况,正式推出甲状腺结节超声恶性危险分层的中国指南,统一国内甲状腺超声检查报告的分类体系。由表3可见,C-TIRADS对细胞学难以明确诊断的甲状腺癌敏感性明显高于BRAFV600E基因检测,但是其特异性明显低于于BRAFV600E基因检测,两者之间的准确性差异没有统计学意义,两种检查对于细胞学难以定性的甲状腺结节均具有重要诊断意义,两者联合应用将敏感性提高至95.00%,进一步减少了甲状腺癌的漏诊率。
本研究也存在不足之处:①本研究为单中心研究,样本量较小。②未纳入超声相关新技术的研究。③甲状腺癌的发生机制与多个基因相关,本研究仅涉及BRAFV600E单基因检测。
4 结论
本研究结果提示,对于细胞学难以定性的甲状腺结节,C-TIRADS及BRAFV600E基因检测均有良好的诊断效果,C-TIRADS对甲状腺癌诊断有较高的的敏感性,减少了漏诊率,而BRAFV600E基因检测的特异性及阳性预测值较高,避免了一部分不必要的重复穿刺,术前联合应用可以更好地评估甲状腺结节。
