土地利用类型对土壤氨氧化微生物丰度和群落结构的影响
2023-10-20朱飞李文波田磊沈洪伟季敬敬魏元甲王芸王欣丽
朱飞,李文波,田磊,沈洪伟,季敬敬,魏元甲,王芸,王欣丽
(1. 临沂市农业农村局,山东临沂 276000;2. 临沂市农业科学院,山东临沂 276000;3. 山东省水土保持与环境保育重点实验室/临沂大学资源环境学院,山东临沂 276005)
硝化作用是土壤氮转化的一个重要步骤,它不仅关系到矿化释放的铵态氮或外源铵态氮在土壤氮循环中的转化,还与土壤氮的损失有关;所涉及的过程关联着土壤酸化、水体富营养化以及温室气体N2O 排放等环境问题[1]。 因此,硝化作用一直是氮转化过程中一个备受关注的环节。 氨氧化是硝化作用的第一步也是限速步骤,氨氧化细菌(AOB)和氨氧化古菌(AOA)被认为是氨氧化作用的主要执行者[2]。 由于AOA、AOB 等功能群体对环境因子(如氧气和底物等)具有不同的响应特征,因此不同的土壤类型和土地利用类型下不同功能群的生态位会发生变化。
AOA 和AOB 在生理和代谢途径上存在很大差异[3-4],包括其对土壤pH 值[5]、土壤有机质含量[6]和氨浓度[7]等的适应,导致土壤中氨氧化微生物不同的群落结构和功能。 研究表明土壤pH值影响硝化作用底物的化学形态和生物可利用性,在AOA 和AOB 的生态位分异中起着重要作用[8]。 与AOB 相比,AOA 对底物NH3有更高的亲和力[9],高氮土壤更利于AOB 的增长[10]。 有机质含量也是影响AOA 和AOB 相对竞争优势的重要因素[6-7,10]。 土壤有机质一方面会刺激具有混合营养能力的AOA,另一方面其矿化释放的氨会促进AOA 丰度的增加[6]。
不同的土地利用和管理模式对土壤的属性和环境可产生剧烈影响,导致土壤理化性质和微生物活性发生改变[11-14]。 天然土地转化成农业用地后利用强度提高,尤以设施蔬菜地土壤的利用程度最高,具有无机和有机肥料投入量高、种植强度大等特点[15]。 不同利用方式土壤在pH 值、氮素状况等方面的差异必然影响AOB、AOA 的丰度和群落组成。 前人研究多数针对酸性土壤,关于原碱性土壤不同干扰程度下的土地利用氨氧化微生物是如何响应的研究很少。 本研究选取褐土林地、农田和设施蔬菜地3 种中国北方常见土地利用类型的土壤,代表不同的干扰程度(林地<农田<设施蔬菜地),采用荧光定量PCR 和Illumina MiSeq 高通量测序技术,研究不同土地利用类型土壤AOA 和AOB 的丰度、多样性和群落结构的变化,探讨土壤理化性质变化对氨氧化微生物群落组成的影响以及氨氧化微生物对环境的长期适应性,以期为土壤肥力提升和土地的合理利用提供依据。
1 材料与方法
1.1 研究区与土壤样品采集
土壤样品采集自山东省沂南县(35°36′28″N,118°22′4″E),属暖温带大陆性季风气候,全年平均气温13.7 ℃,年均降水量856 mm。 最冷月份为1 月,平均气温为-0.8 ℃;最热月份为7 月,平均气温为26.4 ℃。 土壤类型属于褐土,起源于石灰岩。 选取3 种邻近(相距1 km 内)但不同的土地利用类型土壤作为研究对象,分别是林地、农田和设施蔬菜地。 林地是人工林(大约20 年),主要树种是毛白杨(Populus tomentosaCarr.);农田种植时间大于30 年,主要是小麦(Triticum aesti-vumL.)和玉米(Zea maysL.)轮作,每年施氮量350~450 kg/hm2;设施蔬菜地主要种植黄瓜(Cucumis sativusL.),种植时间为10 年以上,每年施氮量800~900 kg/hm2。
土壤样本于2017 年5 月采集。 每个采样点设3 次重复,每个重复样本由5 份随机采集的0~20 cm 土壤混合而成。 采集的新鲜土样置于冰上运回实验室,去除植物根系和石块后过2 mm 筛,一部分储存在-80 ℃冰箱,用于amoA基因群落丰度和结构分析,另一部分用于理化性质分析。
1.2 土壤理化性质测定
理化性质测定参考鲁如坤[16]的方法。 土壤pH 值采用电极法测定,水土比为2.5∶1(v/m)。土壤有机碳(SOC)含量测定采用硫酸-重铬酸钾氧化法。 土壤全氮(TN)含量测定用半微量凯氏定氮法。 铵态氮和硝态氮含量测定时首先用2 mol/L KCl 溶液浸提,然后用SkalarplusSan 流动分析仪测定。
1.3 DNA 提取及荧光定量PCR
土壤总DNA 的提取采用FastDNA®SPIN Kit for soil (MP Biomedicals,USA)试剂盒进行,具体操作方法参照说明书。 将提取的土壤总DNA 溶解于100 μL TE buffer 中。 用Nanodrop (ND-1000 UV-Vis Spectrophotometer Therom,USA) 检测DNA 的纯度和浓度,用1%琼脂糖凝胶电泳检测其片段大小,置于-20 ℃冰箱保存。
以AOA 和AOBamoA基因的重组质粒作为标准DNA 模板,经10 倍连续稀释,制作标准曲线。用SYBRPremix Ex TaqTMKit(TaKaRa)试剂盒,分别以Arch-amoAF/Arch-amoAR[17]和amoA-1F/amoA-2R[18]为引物,在CFX96 Real-Time PCR System(Bio-Rad,USA)实时荧光定量PCR 仪上进行扩增,定量分析AOA 和AOB 的amoA基因拷贝数。 qPCR 反应体系(20 μL):2×SYBR Premix Ex PCR buffer 10 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA 模板1 μL。 qPCR 扩增程序:95 ℃预变性3 min;95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s;40 个循环。
1.4 Illumina MiSeq 测序
采用PCR 扩增AOA 和AOBamoA基因,扩增引物和反应体系同1.3,扩增条件为:94 ℃5 min;95 ℃30 s,55 ℃45 s,72 ℃45 s,35 个循环;72 ℃7 min。 以2%琼脂糖凝胶电泳检测PCR 产物。 样品送至上海美吉生物医药科技有限公司,运用Illumina MiSeq 测序平台进行测序。 序列用FLASH 合并,利用微生物生态学(Qiime)软件对所得序列进行过滤、拼接和去除嵌合体。 OTU 按照97%进行聚类分析。 利用RDP 分类器对每条序列进行物种分类注释,比对fgr/amoA 数据库,置信阈值为70%。 利用Mothur 1.30.1 软件在97%相似水平上对氨氧化微生物群落α 多样性指数进行分析。
1.5 数据处理与分析
采用SPSS 19.0 软件对土壤理化性质、氨氧化微生物丰度和群落α 多样性指数进行差异显著性分析(P<0.05)和Pearson 相关性分析。 采用CANOCO 4.5.1 软件(Microcomputer Power,Ithaca,USA) 开展CCA 分析,明确AOA 和AOB 群落结构和土壤理化因子间的关系。 利用Origin(OriginPro 9.0 for Windows)软件作图。
2 结果与分析
2.1 不同土地利用类型土壤理化性质
由表1 可知,林地土壤呈碱性,其pH 值在褐土的常见值范围内;农田和设施蔬菜地土壤呈酸性,其中设施蔬菜地的pH 值最低(5.32)。 林地土壤的有机碳和全氮含量最高,农田土壤最低。设施蔬菜地中铵态氮、硝态氮含量显著高于林地和农田,农田中的硝态氮含量显著高于林地土壤。

表1 不同土地利用类型土壤理化性质
2.2 不同土地利用类型土壤AOA 和AOB 的丰度
由图1 可以看出,林地土壤AOAamoA基因丰度显著高于农田和设施蔬菜地,农田和设施蔬菜地土壤间无显著差异。 AOBamoA基因丰度为4.99×106~2.81×107copies/g;农田土壤丰度显著高于设施蔬菜地和林地(P<0.05),林地土壤基因丰度最低。
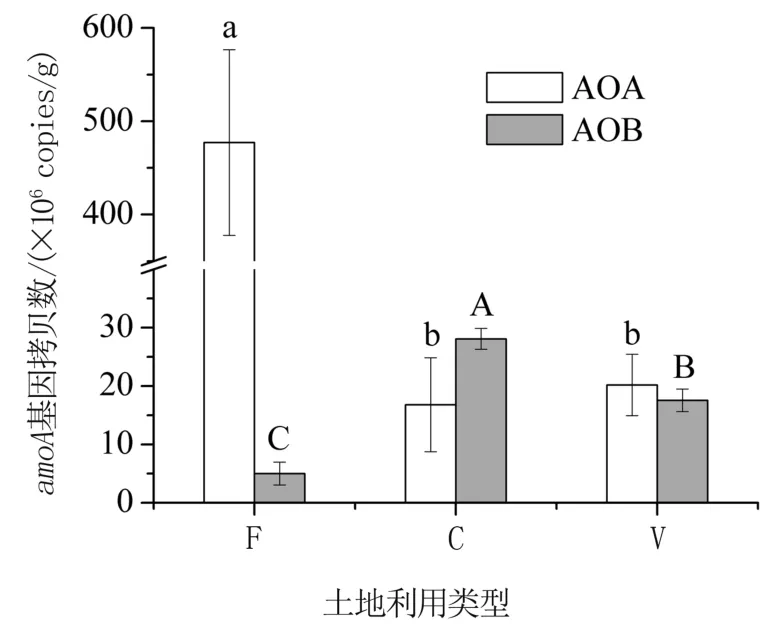
图1 不同土地利用类型土壤AOA 和AOB amoA 基因丰度
2.3 不同土地利用类型土壤AOA 和AOB 的α多样性指数
如表2 所示,所有样品AOA 和AOBamoA基因的测序覆盖度在0.9991 ~0.9996。 不同土地利用类型对AOA 和AOB Shannon 指数均有影响,农田土壤AOA 和AOB Shannon 指数均最高,设施蔬菜地AOA Shannon 指数最低,林地和设施蔬菜地AOB Shannon 指数较低,且两者无显著差异。 不同土地利用类型对AOA Simpson 指数无显著影响;林地和设施蔬菜地中AOB 的Simpson 指数显著高于农田土壤。 设施蔬菜地土壤AOA 的ACE 指数和Chao1 指数显著低于林地和农田,而AOB 的ACE指数和Chao1 指数在3 种土壤中无显著差异。

表2 不同土地利用类型土壤氨氧化微生物群落α 多样性指数
2.4 AOA 和AOB amoA 基因丰度和群落α 多样性指数与土壤理化性状的相关性分析
相关性分析结果(表3)表明,AOAamoA基因丰度与土壤有机碳含量、pH 值呈显著正相关(P<0.01),与硝态氮含量呈显著负相关(P<0.05);AOBamoA基因丰度与有机碳和全氮含量呈显著负相关(P<0.01)。

表3 土壤理化性状与amoA 基因丰度和α 多样性指数的相关性
AOA 群落的Shannon 指数与土壤全氮含量呈显著负相关(P<0.05);Simpson 指数与有机碳和全氮含量呈显著正相关(P<0.05);ACE 指数和Chao1 指数与硝态氮含量呈显著负相关(P<0.05,P<0.01),Chao1 指数与pH 值呈显著正相关(P<0.05)。 AOB 群落的Shannon 指数与有机碳和全氮含量呈显著负相关(P<0.01);Simpson 指数与有机碳和全氮含量均呈显著正相关(P<0.01);ACE 指数与pH 值呈显著正相关(P<0.05),和硝态氮含量呈显著负相关(P<0.05)。
2.5 不同土地利用类型对AOA 和AOB 群落的影响
在门水平上,AOA 群落由奇古菌门(Thaumarchaeota)、泉古菌门(Crenarchaeota)、 Unclassified_k_norank_d_Archaea 和Environmental_samples_k_norank_d_Archaea 组成(图2a)。 泉古菌门在林地和农田中为主要优势类群,相对丰度分别为79.94%和58.95%,在设施蔬菜地中仅占13.03%;奇古菌门在设施蔬菜地中为主要优势类群,相对丰度为66.80%,在林地和农田中分别为3.05%和31.19%。 在属水平上,共检测到5 个类群(图2b),分别为Environmental_samples_p_Crenarchaeota、亚硝化球菌属(Nitrososphaera)、Environmental_samples_p_Thaumarchaeota、Unclassified_k_norank_d_Archaea、Environmental_samples_k_norank。Nitrososphaera只分布在农田和设施蔬菜地中,相对丰度分别为19.54%和66.60%。

图2 不同土地利用类型土壤AOA 门(a)和属(b)水平的群落组成
3 种土地利用类型的AOB 在门水平上包括变形菌门(Proteobacteria)、Unclassified_k_norank_d_Bacteria、Environmental_samples_k_norank 和Ammonia_oxidsing_bacteria_ensemble(图3a)。 变形菌门在林地和农田中为主要优势类群,分别占83.52%和95.11%;在设施蔬菜地中占23.10%。设施蔬菜地中Unclassified_k_norank_d_Bacteria和Environmental_samples_k_norank 为优势类群,分别占44.20%和32.68%。 在属水平上检测到5个类群,分别是亚硝化螺菌属(Nitrosospira)、Norank_p_environmental_samples、Unclassified_k_norank_d_Bacteria、Unclassified_o_Nitrosomonadales和其他(图3b)。 已知属为Nitrosospira,在农田和设施蔬菜地中分别占83.47%和12.35%。
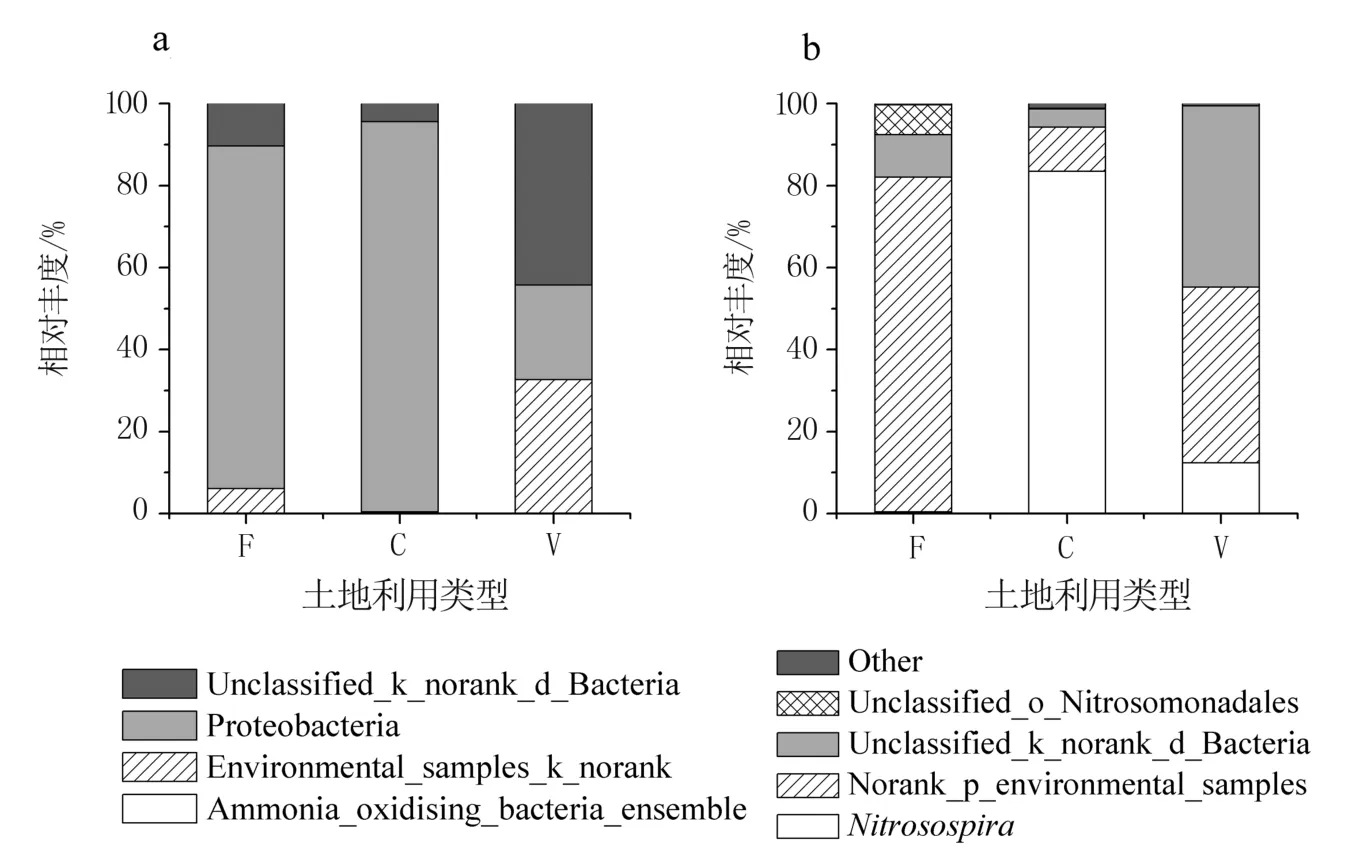
图3 不同土地利用类型土壤AOB 门(a)和属(b)水平的群落组成
2.6 AOA 和AOB 群落结构与土壤理化性质的关系
对AOA 和AOB 群落结构与环境变量进行典型对应分析(CCA),结果(图4)表明,AOA 的第一、二坐标轴(CCA1 和CCA2)分别解释了52.5%和22.2%的变异,全氮(TN)含量和土壤pH 值显著影响AOA 的群落结构。 AOB 的第一、二坐标轴分别解释了55.1%和21.1%的变异,土壤pH 值和SOC 含量显著影响AOB 的群落结构。不同土地利用类型土壤AOA 和AOB 群落均明显分开。

图4 AOA(a)和AOB(b)群落结构与土壤理化性质的CCA 分析
3 讨论与结论
不同土地利用类型显著影响AOA 和AOB 的群落丰度。 林地土壤AOA 丰度显著高于农田和设施蔬菜地,原因可能与森林土壤较高的有机质含量和低氨浓度有关。 研究表明根系分泌物[19]和凋落物[20]促进了AOA 的显著生长,证明了有机质对AOA 生长的重要性。 丰富的有机质一方面会促进AOA 的增长;另一方面,在自然条件下,通过有机物矿化,以持续的低速率产生的氨可利用性很低,有利于对氨亲和力较高的AOA 的生长[6,21]。 与之形成对比,农田和设施蔬菜地土壤中AOB 丰度显著高于林地。 AOB 对氨的亲和力较低,森林有机质矿化过程缓慢释放的并不足以支持其大量生长,因此其只在大量施肥的农田和设施蔬菜农地中具有较高丰度[7,22]。Zhong 等[23]也发现密集施肥的设施蔬菜地土壤中AOB 占优势。 大量研究表明,土壤pH 值是影响硝化微生物丰度和组成的关键因子之一[5,8],农田和设施蔬菜地由于长期施肥导致土壤pH 值下降。 Chen 等[24]研究认为,土壤pH 值与AOB 数量呈显著负相关,与AOA 数量没有显著相关关系。 然而,杨亚东等[25]研究认为,土壤pH 值与AOA 数量显著正相关,与AOB 数量没有显著相关关系,这与本研究结果相同。 因此,在复杂的土壤环境中,pH 值不总是影响AOA 和AOB 分异的决定性因子。
不同土地利用类型土壤AOA 和AOB 的α多样性不同,农田土壤AOA 和AOB 的Shannon 指数显著高于设施蔬菜地土壤,且与土壤全氮含量呈显著负相关,说明设施蔬菜地土壤由于施氮量增加而降低了土壤AOA 和AOB 的多样性。 该结果与Wang[26]、周晶[27]等的研究结论一致。 适量施用氮肥能提高AOA 和AOB 的多样性,但长期大量施用氮肥则不利于保持多样性。
在门分类水平上,林地和农田土壤AOA 主要优势类群是泉古菌门,设施蔬菜地土壤AOA 优势类群为奇古菌门。 赵辉等[28]研究发现,设施蔬菜地随着种植年限的增加,奇古菌门的相对丰度增大,说明长期大量施肥有利于奇古菌门AOA 的生长。 相比林地土壤,农田和设施蔬菜地土壤里的已知属Nitrososphaera在AOA 功能群中的占比更高,并在设施蔬菜地的AOA 类群中占据显著优势。 这一结果与早期研究结论[29]并不一致。 而近期研究发现,酸性土壤中主导硝化的AOA 类群属于Nitrososphaera viennensisEN76 相关类群,并且其活性源于对酸性环境的耐受性,而非对氨的高度亲和力(如在偏碱性森林土中)[30-31]。
AOB 中的变形菌门在林地和农田中为主要优势类群,而在设施蔬菜地中仅占23.10%,这可能与变形菌门适合的营养阈值有关[32]。 设施蔬菜地与农田相比,由于养分大量富集,超过了变形菌门的生态阈值,对其生长起到了抑制作用。 已知属Nitrosospira是农业施肥土壤中最常见的一类硝化细菌[33],Chu 等[34]的研究结果也表明施氮肥会导致NitrosospiraCluster 3 的竞争优势,但是Nitrosospira更喜欢低氨的环境[35],因此在施氮量高的设施蔬菜地中所占比例(12.35%)远低于农田(83.47%)。
CCA 分析表明土壤pH 值、全氮和铵态氮含量显著影响AOA 的群落结构,解释了不同土地利用类型中74.7%的AOA 群落组成差异。 土壤pH值、有机质含量显著影响了AOB 的群落结构,解释了不同土地利用类型中76.2%的AOB 群落组成差异。 说明林地转变为农业用地后,在作物种植和施肥管理过程中,土壤酸化、氮肥积累和有机肥使用等因素直接影响了土壤的理化性质,从而决定了AOA 和AOB 群落结构的变化[36-37]。
