红裸须摇蚊幼虫肠道可培养细菌多样性及耐受重金属功能初步研究
2023-10-20安佳婷徐海轩杨浩成闫春财孙泽阳
安佳婷,徐海轩,杨浩成,闫春财,孙泽阳
(天津师范大学生命科学学院天津市动物多样性保护与利用重点实验室,天津 300387)
摇蚊,隶属于双翅目Diptera摇蚊科Chironomidae,广泛分布于世界范围内各种水体中,是一类数量和种类极其庞大的水生昆虫,是淡水水域中底栖动物的主要类群之一,其生物量可占到底栖动物的70%~80%。摇蚊地理分布广泛,具有耐受极端条件的能力,可以生活于热带沼泽(Pinho and Andersen, 2021)、极地(Moubayed-Breil and Ashe, 2019)、海洋(Sugimaruetal., 2008)、冰川积水(Moubayed and Langton, 2019)等极端环境中。同时,大量研究表明,一些摇蚊幼虫可以在污染的水体环境中大量生存,体现出较强的耐污能力(Alhouetal., 2012)。例如,Chironomuskiiensis,Chironomusjavanus,Polypedilumtrigonus3种摇蚊的数量与底泥中高浓度有机物及重金属离子成正相关(Al-Shamietal., 2010)。相关报道称在受铜、铬和锌污染严重的河流区域,摇蚊生物量占总底栖动物的80%,而对比同一条河流中未受污染区域,摇蚊生物量仅占10%(Winneretal., 1980; Loayza-Muroetal., 2013)。因此,国内外环境学家普遍将摇蚊作为重要的水质评估的指示生物(Caoetal., 2019)和水生态毒理学实验模式生物,开展生物监测的应用研究也逐渐增多(周东等, 2018; White and Liber, 2020)。尽管摇蚊对环境污染能够产生较强的抗性这一事实已经被较多学者报道,但其对环境胁迫因子的响应机制仍不清晰。
昆虫肠道内微生物与宿主个体经过长期协同进化,形成了一种互利互惠的共生关系,能够直接或间接对宿主造成潜在影响,在促进个体消化、吸收利用营养、参与解毒过程、影响发育和寿命、抵抗外来病原的侵入、提高宿主免疫活性、合成生物信息素等方面体现出无可替代的作用(Jingetal., 2020)。昆虫肠道微生物群落主要包括病毒、古细菌、细菌、真菌和原生动物等(周帆等, 2020),而种类繁多的细菌是其优势种群,主要包含变形菌Proteobacteria、厚壁菌Firmicutes、放线菌Actinomycetes、拟杆菌Spirochetes等。
不同种类昆虫的肠道微生物群落组成存在差异,鳞翅目Lepidoptera家蚕Bombyxmori的肠道优势菌主要有变形菌门Proteobacteria、厚壁菌门Firmicutes、放线菌门Actinomycetes和拟杆菌门Bacteroidaceae(Chenetal., 2018);鳞翅目Lepidoptera稻纵卷叶螟Cnaphalocrocismedinalis的肠道优势细菌来自变形菌门Proteobacteria、厚壁菌门Firmicutes、放线菌门Actinomycetes、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi和拟杆菌门Bacteroidaceae(刘小改, 2016)。研究发现,即使是同一物种,肠道微生物群落结构也在个体的不同状态下表现出表型差异,并被证实高度依赖于栖息地生态环境(Youngetal., 2018; Evaristeetal., 2019; Wuetal., 2020)与食物种类(相辉和黄勇平, 2008),昆虫从食物或环境中获得微生物,并经过肠道选择后形成共生菌。
值得关注的是,近年来国内外研究发现昆虫肠道内微生物可以通过直接或间接途径帮助昆虫缓解甚至消除外源有毒物质对其带来的不利影响,是昆虫个体对抗外源有害因子的有效保护机制之一。例如,咖啡果小蠹Hypothenemushampei肠道微生物群落中的假单胞菌属Pseudomonas以咖啡因作为唯一的碳氮源,以此帮助虫体对有害物质咖啡因进行降解(Ceja-Navarroetal., 2015)。蜜蜂肠道微生物可以通过调控蜜蜂的内源性解毒酶表达量来帮助其抵御噻虫啉和氟缬氨酸两类杀虫剂,促进蜜蜂的健康(Wuetal., 2020)。
尽管如此,目前研究人员对昆虫肠道微生物的菌群结构探索只局限在极少数昆虫类群中,摇蚊肠道菌群结构及其参与个体抵御有害物质的潜在作用还未曾见报道。本研究以华北地区常见的耐污种红裸须摇蚊4龄幼虫为实验对象,探究铜离子及镍离子对红裸须摇蚊幼虫的急性毒理效应。重点采用传统分离培养法对其肠道内可培养细菌进行初步鉴定及分析,在了解摇蚊幼虫肠道细菌群落组成的基础上探究相关菌株对重金属铜离子及镍离子的耐受程度,为进一步研究这些共生菌对宿主抵御外源有害物质(如重金属)的潜在功能提供必要的理论基础。
1 材料与方法
1.1 红裸须摇蚊幼虫采集、饲养及处理
摇蚊幼虫于2021年5-7月采集于天津市北大港地区独流减河流域随机5个取样点,分别为S1(117°20′32″ N; 38°49′38″ E),S2(117°24′46″ N; 38°48′31″ E),S3(117°22′55″ N; 38°45′44″ E),S4(117°25′24″ N; 38°44′41″ E),S5(117°32′49″ E;38°46′17″ N),采样点均为淤泥底质。将采集的摇蚊幼虫用蒸馏水初步清洗后,在体视镜下依据头壳等形态学特征进行分析。将经过鉴定的红裸须摇蚊幼虫置于通氧且盛装脱氯自来水的塑料桶内混合培养,室内温度保持在22~24℃之间,每天早晚各换一次水。
在预实验的基础上,用蒸馏水配置梯度浓度为156.25、125.00、62.50、31.25、15.63、7.81、3.13 mmol/L的CuSO4溶液,以及浓度为168.07、84.03、42.02、21.01、10.5 mmol/L的NiCl2溶液。对照组为蒸馏水。随机挑选780头生理状态、外观形态无明显差异的幼虫分别放入各烧杯中进行实验,每个浓度设置3个重复,每个重复20头幼虫。实验期间不投喂任何食物,通入微氧,每24 h更换一次溶液。分别记录经24、48、72、96 h处理后幼虫的死亡数目(判断标准:用镊子轻轻夹幼虫腹部,若未蜷缩则认定为死亡),并利用IBM SPSS Statistics 26软件计算半数致死浓度(LC50)(贾春生, 2006)。
1.2 幼虫肠道内容物提取
幼虫在脱氯水,156.25 mmol/L CuSO4溶液以及84.03 mmol/L NiCl2溶液中培养96 h后,各随机选取5头生理状态较好的幼虫。在无菌环境下,将幼虫置于冰上3~5 min使其昏迷后进行虫体表面消毒,使用75%酒精棉片轻轻擦拭幼虫表面30 s,随后用0.25%无菌次氯酸钠溶液冲洗幼虫表面2次,每次1 min,用无菌生理盐水冲洗浸泡幼虫表面3次,每次1 min,最后用双蒸水冲洗幼虫表面3次,每次1 min,以去除虫体表面残留液体。将体表消毒好的幼虫放在置于培养皿中的载玻片上,使用灭菌后的解剖刀切开幼虫口器和尾部,用灭菌后的镊子从幼虫头部轻轻取出肠道,立即用灭菌PBS缓冲液漂洗肠道,去除其它内脏及其附属物,采集肠道及其内容物。在1.5 mL离心管中提前加入1 mL灭菌PBS缓冲液,将剖离的肠道装入无菌离心管后用匀浆器将肠道充分研磨形成匀浆后备用。
1.3 幼虫肠道可培养细菌分离
1.3.1实验所用培养基
每种培养基的体积为500 mL,4种培养基中的有效成分如下,于121℃下灭菌20 min,备用。
(1)普通肉汤培养基(LB):LB粉末12.5 g,琼脂7.5 g;
(2)牛肉膏蛋白胨培养基(NA):蛋白胨5 g,牛肉膏1.5 g,氯化钠2.5 g,琼脂7.5 g;
(3)脑心浸液培养基(BHI):脑心浸液粉末12.25 g,琼脂7.5 g;
(4)MC培养基(MC):MC粉末20 g,琼脂7.5 g。
1.3.2实验过程
将来自脱氯自来水中培养的普通幼虫的肠道匀浆液稀释为10-3、10-4、10-5三个梯度待用。分别取100 μL溶液均匀涂布于LB、NA、HBI、MC培养基上,每个浓度梯度设置3个重复,同时将完成体表消毒的幼虫在培养基上滚动做为参照,以保证体表消毒彻底。平板倒置放入人工气候箱中37℃培养72 h,观察参照是否有菌落长出,若无菌落长出,证明体表消毒合格,则选择菌落分散较好的培养皿,每24 h根据菌落特征,分别挑取形态、大小、颜色不同的单菌落在新的相应培养基上划线纯化培养(至少5次),直至得到形态稳定的单克隆菌株。
0.5 mmol/L CuSO4溶液、0.5 mmol/L NiCl2溶液经0.45 μm孔径滤膜过滤器去除细菌后,依次加入灭菌后的LB、NA、BHI、MC培养基中,分别配制成浓度为6.25、3.125、0.625、0.3125 mmol/L的CuSO4培养基和NiCl2培养基。将暴露于浓度为156.25 mmol/L的CuSO4溶液、84.03 mmol/L的NiCl2溶液中的幼虫肠道内容物匀浆液按照上述步骤均匀涂布并培养。
1.4 细菌的菌落形态观察及性质检测
肠道可培养细菌在固体培养基上进行纯化培养,分别观察细菌形状、菌落形态、颜色、隆起度、边缘形状、表面状态、光泽、干湿情况、透明度等菌落特征。将经分离纯化得到的纯菌株按照革兰氏染色法进行性质判断,并在显微镜下观察细菌的形态。
1.5 细菌DNA提取及16S rRNA基因片段的扩增
取5 mL塑料摇菌管分别加入3 mL LB、NA、HBI、MC液体培养基,将经分离纯化得到的纯菌株接入相应的培养基中,放入摇床36℃,220 rpm/min振荡培养,直至OD600达到0.7~1.0。采用DNA提取试剂盒提取各细菌基因组DNA,方法依据生工生物工程(上海)有限公司提供的Ezup柱式细菌基因组DNA抽提试剂盒。使用超微量紫外可见分光光度计(美国丹诺儿Denovix)检测所提DNA在260 nm、280 nm处的紫外吸光值,OD260/OD280在1.8~2.0范围内即为合格。以各细菌提取的DNA为模板,利用细菌通用引物27F(AGAGTTTGATCMTGGCTCAG)/1492R(TACGGYT ACCTTGTTACGACTT)进行PCR扩增。PCR反应体系共50 μL,其中包括:4.0 μL dNTPs(2.5 mmol/L),0.5 μL Taq酶(5 U/μL),5.0 μL 10×PCR buffer,上游引物27F及下游引物1492R(10 μmol/L)各2.0 μL,2.0 μL基因组DNA,其余用ddH2O补齐体系。PCR反应条件为:预变性94℃ 3 min;变性94℃ 30 s,退火54℃ 30 s,延伸72℃ 1.5 min(24个循环);最后延伸72℃ 10 min;4℃保存。PCR扩增产物用1%(质量体积比)琼脂糖凝胶电泳检测,将检测合格的样品送往生工生物工程(上海)股份有限公司测序。
1.6 幼虫肠道细菌系统发育树构建
双向测序测得的序列通过DNAMAN软件进行矫正及拼接,拼接完成后的16S rDNA序列提交到http://www.ncbi.nlm.nih.gov中与GenBank核酸数据库中的序列进行BLAST同源性比对,查找并选出与菌株相似度最高的序列作为参照菌株并下载核酸序列,使用Clustal W软件比对序列(Tamuraetal., 2013),运用软件MEGA X以邻位相连算法(Neighbor-Joining)构建系统发育树(Saitou and Nei, 1987),判定其亲缘关系。
2 结果与分析
2.1 重金属胁迫下红裸须摇蚊幼虫的半数致死浓度测定
幼虫在接触重金属溶液初期反应强烈,不断蜷缩和舒展虫体。暴露数小时后,实验组各浓度梯度幼虫活动情况与对照组无显著差异,在重金属溶液中暴露24~72 h时,实验组各浓度梯度摇蚊幼虫活力显著降低并出现死亡,在铜离子溶液中存活的幼虫虫体发黑,长度变长,在镍离子溶液中存活的幼虫虫体颜色变为棕色后变为黑色,长度变短,但刺激幼虫腹部,幼虫仍会蜷缩虫体,对照组幼虫活力基本不变,存活状态好。记录24、48、72、96 h红裸须摇蚊幼虫的在重金属下的存活数目,计算得出红裸须摇蚊幼虫在重金属铜暴露下的24 h-LC50、48 h-LC50、72 h-LC50及96 h-LC50分别为6304.86、403.59、29.33以及14.43 mmol/L(表1),幼虫在重金属镍暴露下的24 h-LC50、48 h-LC50、72 h-LC50及96 h-LC50分别为339.52、182.18、102.59以及60.94 mmol/L(表2)。
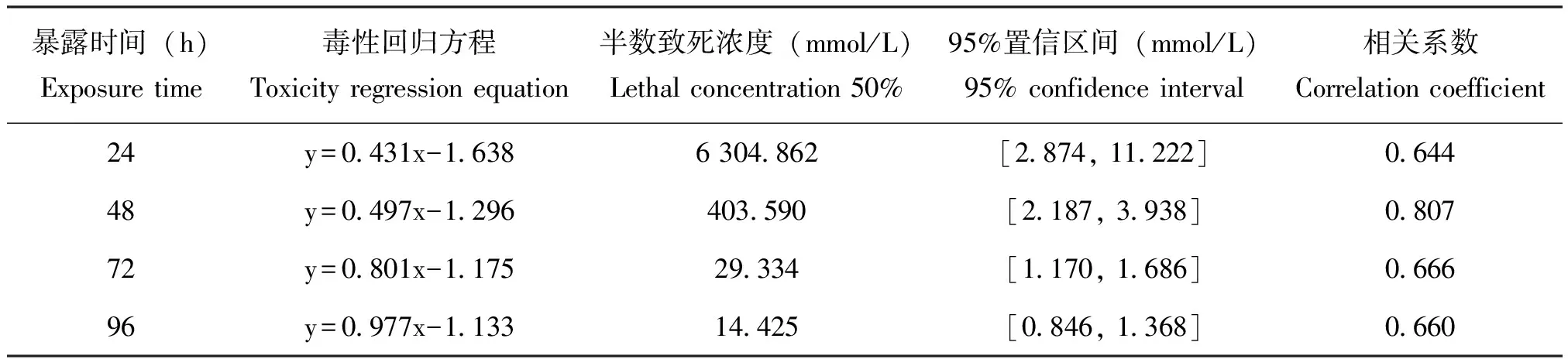
表1 重金属铜暴露不同时间红裸须摇蚊幼虫的半数致死浓度
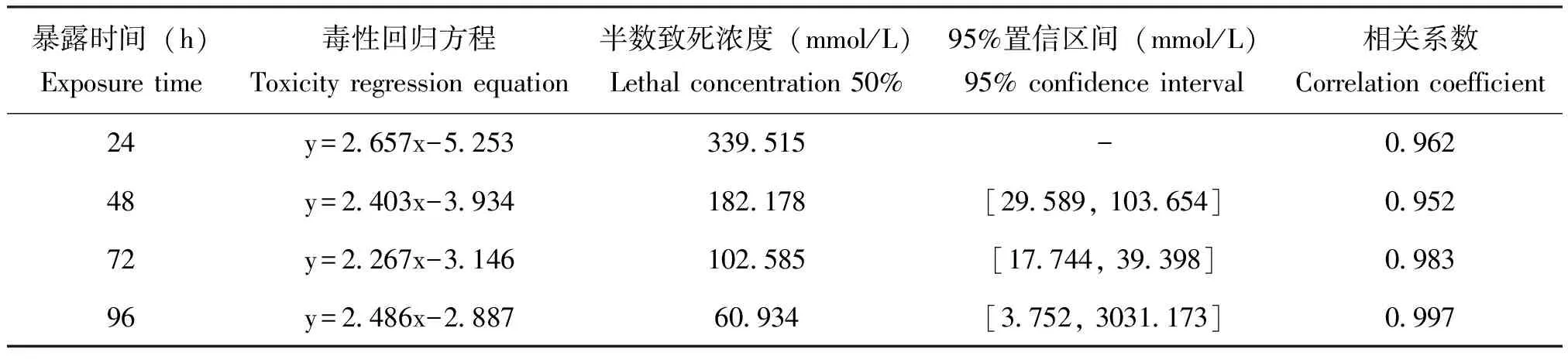
表2 重金属镍暴露不同时间红裸须摇蚊幼虫的半数致死浓度
2.2 幼虫肠道内细菌的种类
将5头于脱氯水中培养红裸须摇蚊幼虫的肠道内容物稀释为10-3、10-4、10-5三个梯度,分别涂布于LB、MC、NA、BHI 4种培养基上,经培养后获得肠道原始菌株。选择单菌落数目在30~300株的培养基,挑选生长时间、形态、大小、颜色不相同的菌落进行分离纯化。提取分离后的菌落基因组DNA,并以其为模板扩增16S rRNA基因片段。结果显示,从红裸须摇蚊幼虫肠道中共分离出16株不同的细菌(编号依次为N01-N16),其中从LB培养基中分离到4株,从MC培养基中分离出4株,从NA培养基中分离出6株,从BHI培养基中分离出2株。经NCBI Blast程序比对后,分离到的红裸须摇蚊幼虫肠道细菌与相应菌株的16S rRNA基因序列相似度在99%~100%之间。这16种可培养细菌分别属于变形菌门Proteobacteria和黄杆菌门Flavobacteria,共涉及9个科(表3)。

表3 红裸须摇蚊幼虫肠道微生物16S rRNA基因序列对比结果
2.3 幼虫肠道细菌的形态特征
对红裸须摇蚊幼虫肠道中分离得到的16株细菌的菌落特征与革兰氏染色结果进行观察,结果见附件增强出版材料。16株菌株中所有菌株的革兰氏染色结果均呈阴性,且除N06、N13为球状外,其余菌株均为杆状。分离的全部细菌均可以在37℃生长,培养24~48 h后菌落形态明显。
2.4 系统发育研究
将分离得到的红裸须摇蚊幼虫肠道可培养细菌16S rRNA基因序列进行系统发育进化分析,构建系统发育树(图1)。共有16株细菌,主要分为两类,即变形菌门:黄单胞菌科、丛毛单胞菌科、耶尔森菌科、弧菌科、肠杆菌科、摩根菌科、莫拉菌科、假单胞菌科和黄杆菌门:黄杆菌科。
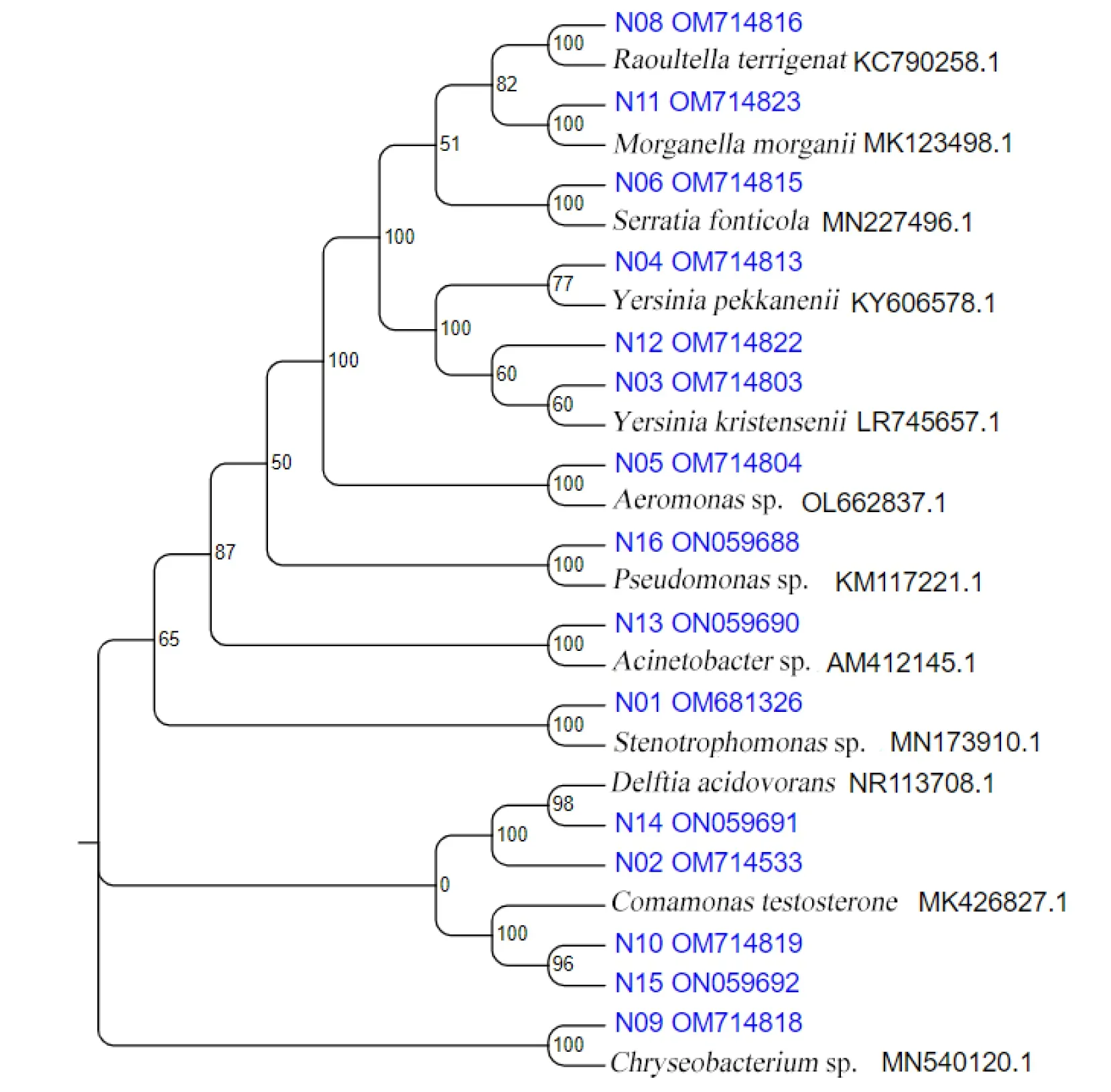
图1 16S rRNA基因序列系统发育进化分析Fig.1 Phylogenetic tree based on 16S rRNA sequences
系统发育树共分为3大支12小支,变形菌门中,N08拉乌尔菌属的R.terrigena与其模式菌株R.terrigena(KC790258.1)聚为一小支,N11摩根菌属的M.morganii与其模式菌株M.morganii(MK123498.1)聚为一支,N06沙雷氏菌属居泉沙雷氏菌与其模式菌株S.fonticola(MN227496.1)聚为一支,这三支聚为一小支,说明N08、N11、N06三个种的亲缘关系较近。耶尔森菌科耶尔森菌属的N04Y.pekkanenii与其模式菌株Y.pekkanenii(KY606578.1),N12Y.kristensenii、N03Y.intermedia与其模式菌株Yersiniakristensenii(LR745657.1)聚为一支。N05气单胞菌属气单胞菌与其模式菌株Aeromonassp.(MN540110.1)聚为一小支,N16假单胞菌属假单胞菌与其模式菌株Pseudomonassp.(KM117221.1)聚为一小支,N13不动杆菌属不动杆菌与其模式菌株Acinetobactersp.(AM412145.1)聚为一小支,N01窄食单胞菌属嗜麦芽孢子菌与其模式菌株S.pavanii(MN889300.1)聚为一小支,这六支聚为一大支,说明N08、N11、N06、N04、N12、N03、N05、N16、N13、N01的亲缘关系比较近。N14代尔夫特菌属的D.acidovorans、N02代尔夫特菌属代尔夫蒂亚菌与其模式菌株D.acidovorans(NR113708.1)聚为一小支,N10丛毛单胞菌属的C.testosleroni,N15丛毛单胞菌属丛毛单胞菌与其模式菌株C.testosteroni(MK426827.1)聚为一小支,这两小支又聚成一大支,说明N14、N02、N10、N15的亲缘关系较近。N09金黄杆菌属金黄杆菌与其模式菌株Chryseobacteriumsp.(MN540120.1)聚为一类,单独成为一大支。
2.5 幼虫肠道内细菌耐重金属的研究
按照相似方法对重金属铜、镍胁迫下的红裸须摇蚊幼虫在含有铜离子、镍离子的培养基中进行肠道细菌纯化分离,最终在含有铜离子、镍离子的培养基中均分离得到7株细菌,根据16S rRNA基因序列结果分别鉴定得到细菌,经过Blast比对后,在含有铜离子的培养基中分离得到7株细菌与无处理摇蚊肠道细菌中N01、N03、N06、N09、N10、N11、N12为同种菌,7株菌株均可以在含铜固体培养基上生长(≤ 3.125 mmol/L),并且N06(沙雷氏菌属)在含铜培养基上生长时,菌落周围Cu2+的蓝色明显减淡或消失(图2)。
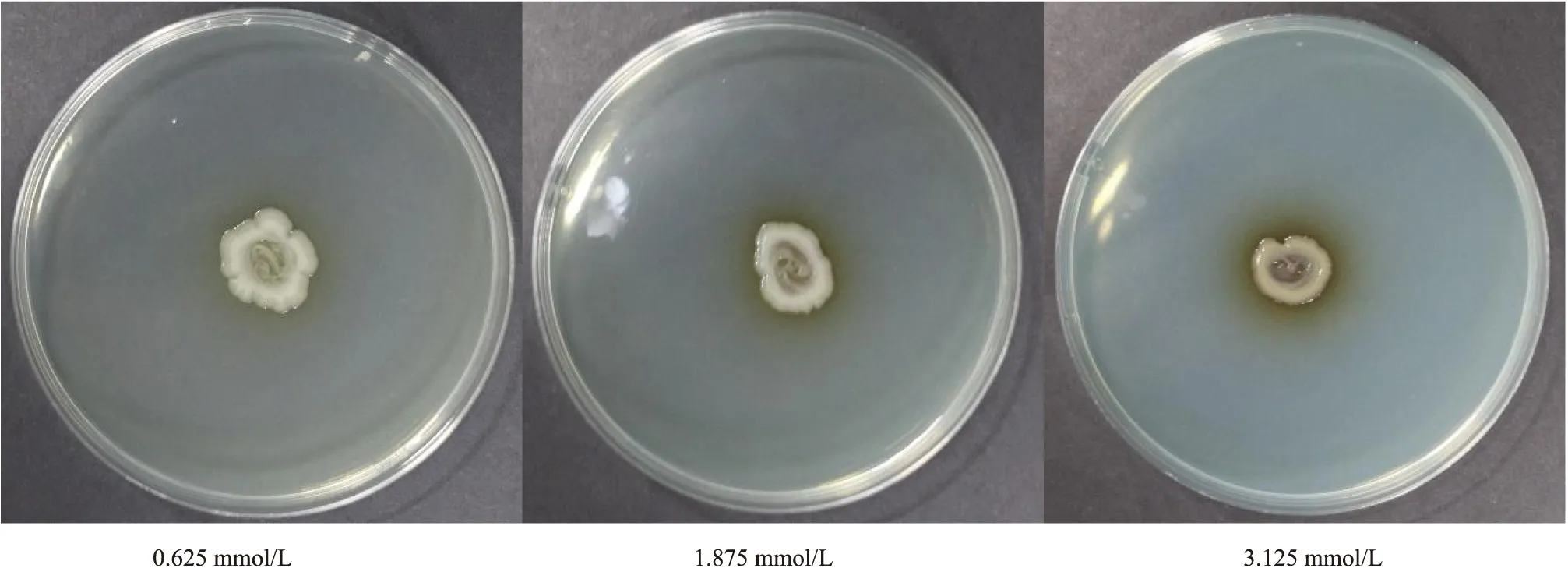
图2 N06(沙雷氏菌属)在含有不同浓度铜离子的固体培养基上生长情况Fig.2 Growth circumstances of the strain N06(Serratia sp.) exposed to distinct dosages of Cu2+
在含有镍离子的培养基中分离得到7株细菌与无处理摇蚊肠道细菌中分离的N05、N06、N10、N13、N14、N15、N16为同种菌,7株菌株均可以在含镍培养基上生长(≤ 2.101 mmol/L)。14株细菌均可以在37℃生长,培养24~48 h后菌落形态明显。
3 结论与讨论
摇蚊是一种分布广泛、种类繁多、数量众多的昆虫,其生命周期包括卵、幼虫、蛹、成虫4个阶段,属于完全变态昆虫,90%的生命周期以幼虫的状态在底泥中度过(田文龙等, 2021)。目前大量研究表明,昆虫肠道微生物能够帮助昆虫个体抵御外界不良因素(如重金属、有机农药等)的胁迫,例如蝇类、水虻等昆虫幼虫可以高效转化有机废物而自身不受到侵害,这与其肠道中的共生微生物有着密切联系(杨红和黄勇平, 2018)。也有研究表明,蚊科昆虫的肠道微生物群不仅可以影响幼虫的生长、成虫对生态环境的适应性以及繁殖能力,同时对蚊子免疫基因的表达也发挥了潜在作用(Strand, 2018)。当培养基中铅含量为500 mg/L时,家蝇肠道中的波氏杆菌Bordetellasp,海氏普罗威斯登菌Providenciaheimbachae和松鼠葡萄球菌Staphylococcussciuri可以吸附培养基中10%的铅,帮助家蝇耐受环境中的高浓度金属铅(王婉强, 2021)。目前许多研究人员都在探索昆虫肠道微生物,但仅在家蚕、蜜蜂等类群中有零星报道,本试验则以华北地区的优势耐污种红裸须摇蚊为研究对象,对其肠道内可培养微生物进行分离研究,将正常虫体与重金属离子(铜、镍)暴露下虫体内的肠道可培养细菌进行比较,分析其在种类、进化关系、耐受重金属能力等方面的不同。
在红裸须摇蚊幼虫肠道分离得到的16株不同遗传型的可培养细菌,分属于黄单胞菌科1种,黄杆菌科1种,摩根菌科1种,莫拉菌科1种,假单胞菌科1种,丛毛单胞菌科4种,弧菌科2种,肠杆菌科2种,耶尔森菌科3种。其中,15种属于变形菌门,1种属于黄杆菌门,表明变形菌门在红裸须摇蚊幼虫肠道可培养细菌中占据优势地位,同时意味着变形菌门可能对红裸须摇蚊幼虫的营养吸收、生长发育等方面有重要的作用。尽管每种昆虫的肠道微生物种类和丰富度存在巨大差异,但有研究表明棉铃虫肠道微生物主要由黄杆菌属、沙雷氏菌属、寡养单胞菌属以及肠杆菌属构成(赵晨晨, 2020),家蚕肠道微生物的优势菌群主要是假单胞菌属、肠球菌、代尔夫特菌(李莉等, 2021),羽化后的南亚实蝇肠道中金黄杆菌属、黄杆菌属、寡养单胞菌属Stenotrophomonas、肠杆菌属、普罗威登斯菌属Providencia、假单胞菌属以及沙雷氏菌属均为优势菌群(骆米娟, 2016)。结合本研究结果,认为昆虫肠道微生物群落存在一部分共有的核心菌群。
本研究首次利用传统微生物体外纯化培养技术从红裸须摇蚊幼虫肠道中分离到16株不同遗传型的可培养细菌,与其它昆虫肠道可培养微生物相比,多于孙博通等在斜纹夜蛾Spodopteralitura4龄幼虫肠道中分离到的10种细菌(孙博通等, 2017),但少于章雨璐等在椰心叶甲Brontispalongissimi肠道中分离得到的22种细菌(章雨璐等, 2021)。已有大量研究表明,昆虫肠道微生物的种类和数量与昆虫种类、发育阶段(李选文等, 2021)、生长环境、消化道形态、食性、食物喂养条件等因素有密切关系,伴随着昆虫取食、消化、排泄,肠道成为了一个可变的动态环境,肠道微生物的结构、种类、数量也被赋予动态的变化(鲁迎新等, 2016)。椰心叶甲等植食性昆虫食性广、食量大、个体大,肠道结构较为复杂,而红裸须摇蚊幼虫个体较小,栖息在水体底泥当中,食物来源极为局限,主要以水体中的有机碎屑和水体沉积物中的有机物为食,并且食量较小,肠道结构也较为简单,因而肠道可培养细菌的种类和数量也相对较少。另外,由于昆虫肠道这一特殊的半封闭环境有其复杂的理化性质和特有的营养结构,以及不同部位不同的微生态环境,故而生存着许多特化的菌群以及共生菌群等,经过长期的共同进化,绝大部分菌群高度适应肠道这个特殊环境,体外培养无法完全模拟肠道内的厌氧环境、菌群相互作用、氧化还原电位、pH值等条件,使得体外培养只能分离出极少一部分共生菌,绝大多数肠道微生物因为不适宜的环境条件而无法分离。尽管如此,传统的微生物体外分离纯化技术仍有其不可替代的作用,体外培养技术的培养方法和技术成熟,在适宜条件下微生物生长速度快,能够快速分离并且直观地观察到菌落特征、生理生化特征以及细菌形态,同时快速分析菌株的相关功能。
本研究从环境重金属角度出发,通过静水染毒法对红裸须摇蚊幼虫进行了急性毒性试验,重金属铜对红裸须摇蚊幼虫24、48、72、96 h的LC50分别为6304.86、403.59、29.33、14.43 mmol/L,与铜对其他种类摇蚊的急性毒理效应对比(李浩, 2012),红裸须摇蚊幼虫对重金属铜呈现更强的耐受性。从较高浓度重金属铜胁迫下仍健康存活的红裸须摇蚊幼虫肠道中分离得到7株可培养细菌,分别隶属于耶尔森菌属、金黄杆菌属、丛毛单胞菌属、沙雷氏菌属、窄食单胞菌属、摩根菌属,它们与正常饲养的红裸须摇蚊幼虫肠道可培养细菌重合,并能够在含铜固体培养基中正常生长,体现了菌株的耐金属性,可能与红裸须摇蚊幼虫耐受铜离子有关。值得关注的是肠杆菌科沙雷氏菌属居泉沙雷氏菌生长在含有铜离子的固体培养基时,菌落周围蓝色消失出现,表明该菌株可能具有利用或代谢铜离子的潜力。研究表明StenotrophomonasmaltophiliaPD2这一种具有耐铜性,且能够对水体环境中铜离子展现出一定的生物吸附力(Ghosh and Saha, 2013)。与此同时,研究组发现1.25 mM Cu暴露下红裸须摇蚊幼虫肠道内Stenotrophomonas的相对丰度从1.27%提升到25.76%(未发表数据),从侧面说明摇蚊幼虫肠道内存在的Stenotrophomonas对于摄入的铜离子有较高的响应机制,可能存在一定的铜代谢能力,以减少铜离子对幼虫的伤害。
幼虫在重金属镍下暴露24 h-LC50、48 h-LC50、72 h-LC50、96 h-LC50分别为339.52、182.18、102.59以及60.94 mmol/L,与闫宾萍(2006)研究的镍对羽摇蚊幼虫24 h-LC50和48 h-LC50分别为5.7 g/L、1.4 g/L相比,红裸须摇蚊对重金属镍的耐受能力明显更强。从重金属镍胁迫下的红裸须摇蚊幼虫肠道中分离到7株可培养细菌,分别隶属于沙雷氏菌属、代尔夫特菌属、气单胞菌属、假单胞菌属、不动杆菌属、丛毛单胞菌属,它们全部与正常饲养的红裸须摇蚊幼虫肠道可培养细菌重合,且能够在含镍培养基中正常生长。Weyens(2015)研究表明,一株假单胞菌属细菌Pseudomonasputida对镍离子有明显的生物吸附作用,杨树接种Pseudomonasputida后,使根系对镍的吸收增加了45%,Bhattacharya等(2013)也发现了一株新的不动杆菌对镍离子表现出一定的耐受性同时可以去除高浓度的镍离子。对比在铜离子和镍离子胁迫下的幼虫肠道微生物,均可发现丛毛单胞菌科细菌的存在,表明其对两种重金属均有较高的抵抗能力,同时Ghosh等(2020)研究发现一株水生丛毛单胞菌Comamonasaquatica有效地减少了铜和镍在鱼体内的积累,对铜和镍的生物富集有较好的控制作用,Staniland等(2010)的研究也表明Comamonastestosteroni对铜和镍有抗性。
综上所述,红裸须摇蚊幼虫肠道内可培养微生物在幼虫抵抗重金属的毒害方面发挥了不可替代的作用。红裸须摇蚊幼虫是重要的水质监测指示生物,探究摇蚊科昆虫肠道微生物群落结构及特定菌株在重金属胁迫下体现的耐受性,不仅可以为摇蚊肠道微生物资源库的开发及个体对抗环境中不利因素提供一定的思路,也可以为从昆虫肠道这一特殊环境中筛选出具备重金属代谢功能的细菌资源,为水体或沉积物重金属污染的防控奠定一定基础。
参考文献(Reference)
Alhou B, Micha JC, Goddeeris B. Diversity of the chironomidae(Diptera) of river Niger related to water pollution at Niamey (Niger) [J].AfricanNetworkofScientificandTechnicalInstitutions, 2012, 12 (1): 89-99.
Al-Shami SA, Che S, Hassanahmad A,etal.Distribution of Chironomidae (Insecta: Diptera) in polluted rivers of the Juru River Basin, Penang, Malaysia [J].JournalofEnvironmentalSciences, 2010, 22 (11): 1718-1727.
Bhattacharya A, Gupta A. Evaluation of Acinetobacter sp. B9 for Cr(VI) resistance and detoxification with potential application in bioremediation of heavy-metals-rich industrial wastewater [J].EnvironmentalScienceandPollutionResearch, 2013, 20 (9): 6628-6637.
Cao Y, Langdon PG, Yan Y,etal.Chironomid communities from subalpine peatlands in subtropical China as indicators of environmental change [J].JournalofPaleolimnology, 2019, 62 (4): 165-179.
Ceja-Navarro JA, Vega FE, Karaoz U,etal.Gut microbiota mediate caffeine detoxification in the primary insect pest of coffee [J].NatureCommunications, 2015, 6: 1-9.
Chen B, Du K, Sun C,etal.Gut bacterial and fungal communities of the domesticated silkworm (Bombyxmori) and wild mulberry-feeding relatives [J].TheISMEJournalEmultidisciplinaryJournalofMicrobialEcology, 2018, 12 (9): 2252-2262.
Evariste L, Barret M, Mottier A,etal.Gut microbiota of aquatic organisms: A key endpoint for ecotoxicological studies [J].EnvironmentalPollution, 2019, 248: 989-999.
Ghosh A, Saha PD. Optimization of copper bioremediation byStenotrophomonasmaltophiliaPD2 [J].JournalofEnvironmentalChemicalEngineering, 2013, 1 (3): 159-163.
Ghosh A, Ali S, Mukherjee SK,etal.Bioremediation of copper and nickel from freshwater fishCyprinuscarpiousing rhiozoplane bacteria isolated fromPistiastratiotes[J].EnvironmentalProcesses, 2020, 7 (1): 443-461.
Jia CS. Calulatiang the LC50 of insecticides with software SPSS [J].ChineseBulletinofEntomology, 2006, 43 (3): 414-417. [贾春生. 利用SPSS软件计算杀虫剂的LC50 [J]. 应用昆虫学报, 2006, 43 (3): 414-417]
Jing TZ, Qi FH, Wang ZY. Most dominant roles of insect gut bacteria: Digestion, detoxification, or essential nutrient provision? [J].Microbiome, 2020, 8 (1): 38.
Li H. Toxic Effects of Copper and Cadmium Exposure onChironomusplumosusandPropsilocerusakamusi[D]. Wuhan: Huazhong Agricultural University Master Thesis, 2012. [李浩. 铜和镉对羽摇蚊幼虫(Chironomusplumosus)和红裸须摇蚊幼虫(Propsilocerusakamusi)的毒性效应 [D]. 武汉:华中农业大学硕士论文, 2012]
Li L, Ma GH, Liu YH,etal.Research progress on the intestinal microorganisms of silkworm [J].GuangdongSericulture, 2021, 55 (4): 1-3, 11. [李莉, 马光皇, 刘语涵, 等. 家蚕肠道微生物的研究进展 [J]. 广东蚕业, 2021, 55 (4): 1-3, 11]
LI XW, Xiong Z, Huang YY,etal.Diversity of cultivable bacteria in intestine from key instar larvae ofDendrolimuskikuchii[J].JournalofWestChinaForestryScinece, 2021, 50: 40-47, 77. [李选文,熊忠平,张珊, 等. 思茅松毛虫关键龄期幼虫肠道可培养细菌多样性分析 [J]. 南方农业学报, 2021, 50: 40-47, 77]
Liu XG, Yang YJ, Liao QJ,etal. Analysis of bacterial community structure and diversity in the intestine ofCnaphalocrocismedinalis(Lepidoptera: Pyralidae) [J].ActaEntomologicaSinica, 2016, 59 (9): 965-976. [刘小改,杨亚军,廖秋菊,等. 稻纵卷叶螟肠道细菌群落结构与多样性分析 [J]. 昆虫学报, 2016, 59 (9): 965-976]
Loayza-Muro RA, Marticorena-Ruiz JK, Palomino EJ,etal.Persistence of chironomids in metal polluted andean high altitude streams: Does melanin play a role? [J].EnvironmentalScienceandTechnology, 2013, 47 (1): 601-607.
Lu YX, Liu YQ, Li Q,etal.Research progress on intestinal microbial diversity of insects [J].JournalofHenanAgriculturalSciences, 2016, 45 (11): 1-7. [鲁迎新,刘彦群,李群,等. 昆虫肠道微生物多样性研究进展 [J]. 河南农业科学, 2016, 45 (11): 1-7]
Luo MJ. Molecular Diversity Analysis of the Intestinal Bacterial Communities from AdultBactroceratau(Walker) and Their Trapping Effect [D]. Fuzhou: Fujian Agriculture and Forestry University Master Thesis, 2016. [骆米娟. 南亚实蝇成虫肠道微生物分子多样性分析及引诱效果 [D]. 福州:福建农林大学硕士论文, 2016]
Moubayed J, Langton PH.Chaetocladiusberythensissp. n.,C.callauensissp. n.,C.guardioleisp. n. andC.pareraisp. n., four relict species inhabiting glacial springs and streams in eastern Pyrenees and Lebanon (Diptera: Chironomidae) [J].NorwegianUniversityofScienceandTechnology(NTNU)Library, 2019, 39, 42-59.
Moubayed-Breil J, Ashe P.Rheocricotopus(s. str.)costaisp. n. andR. (s. str.)pyrenaeussp. n., two relict species from glacial rheocrenes and streams in corsica and the eastern pyrenees (Diptera: Chironomidae, Orthocladiinae) [J].TrakyaUniversityJournalofNaturalSciences, 2019, 20 (1): 35-46.
Pinho LC, Andersen T. NeotropicalNilothaumaKieffer, 1921 (Diptera, Chironomidae): Key, eleven new species, re-descriptions, new combination and new records [J].ZooKeys, 2021, 1033: 81-125.
Saitou N, Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees [J].MolecularBiologyandEvolution, 1987, 4 (4): 406-425.
Staniland S, Coppock M, Tuffin M,etal.Cobalt uptake and resistance to trace metals inComamonastestosteroniisolated from a heavy-metal contaminated site in the Zambian Copperbelt [J].GeomicrobiologyJournal, 2010, 27 (8): 656-668.
Strand MR. Composition and functional roles of the gut microbiota in mosquitoes [J].CurrentOpinioninInsectScience, 2018, 28: 59-65.
Sugimaru K, Kawai K, Imabayashi H. A new marine chironomid species of the genusTanytarsus(Diptera: Chironomidae) from Okinawa, Japan [J].ThePlanktonSocietyofJapan,TheJapaneseAssociationofBenthology, 2008, 3 (4): 240-242.
Sun BT, Lan BM, Wang Q,etal.Isolation and preliminary functional analysis of the larval gut bacteria fromSpodopteralitura[J].BioticResources, 2017, 39 (4): 264-271. [孙博通,蓝波妙,王倩,等. 斜纹夜蛾幼虫肠道细菌分离鉴定及其功能初步分析 [J]. 生物资源, 2017, 39 (4): 264-271]
Tamura K, Stecher G, Peterson D,etal.MEGA6: Molecular evolutionary genetics analysis version 6.0 [J].MolecularBiologyandEvolution, 2013, 30 (12): 2725-2729.
Tian WL, Hou GL, Zhang YL,etal. Research progress in morphological deformities of chironomid larvae induced by contaminants in water and sediments [J].ChineseJournalofEcology, 2021 ,40 (12): 4069-4080. [田文龙,侯桂林,张瑗玲,等. 水相及沉积物固相污染物作用下摇蚊幼虫口器畸形研究进展 [J]. 生态学杂志, 2021, 40 (12): 4069-4080]
Wang HM. The Regulatory Mechanism of Bacterial Heavy Metal and Antibiotic Resistance Mediated by Montmorillonite upon Cadmium Stress [D]. Guangzhou: South China University of Technology Master Thesis, 2020. [王慧敏. 镉胁迫下蒙脱石对细菌重金属及抗生素抗性机制调控研究 [D]. 广州:华南理工大学硕士论文,2020]
Wang WQ. Lead Tolerance and Transport Mechanism inMuscadomestica[D]. Wuhan: Huazhong Agricultural University Master Thesis, 2021. [王婉强. 家蝇对铅的耐受性及转运机制研究 [D]. 武汉:华中农业大学硕士论文,2021]
Weyens N, Beckers B, Schellingen K,etal.The potential of the Ni-Resistant TCE-degradingPseudomonasputidaW619-TCE to reduce phytotoxicity and improve phytoremediation efficiency of poplar cuttings on a Ni-TCE co-contamination [J].InternationalJournalofPhytoremediation, 2015, 17 (1-6): 40-8.
White KB, Liber K. Chronic toxicity of surface water from a canadian oil sands end pit lake to the freshwater invertebratesChironomusdilutusandCeriodaphniadubia[J].ArchivesofEnvironmentalContaminationandToxicology, 2020, 78 (3): 439-450.
Winner W, Boesel MW, Farrell MP. Insect community structure as an index of heavy-metal pollution in lotic ecosystems [J].CanadianJournalofFisheriesandAquaticSciences, 1980, 37 (4): 647-655.
Wu N, Wang X, Xu X,etal.Effects of heavy metals on the bioaccumulation, excretion and gut microbiome of black soldier fly larvae (Hermetiaillucens) [J].EcotoxicologyandEnvironmentalSafety, 2020, 192: 110323.
Wu Y, Zheng Y, Chen Y,etal.Honey bee (Apismellifera) gut microbiota promotes host endogenous detoxification capability via regulation of P450 gene expression in the digestive tract [J].MicrobialBiotechnology, 2020, 13 (4): 1201-1212.
Xiang H, Huang YP. Symbiosis between gut microbiota and insects [J].ChineseBulletinofEntomology, 2008, 45 (5): 687-693. [相辉, 黄勇平. 肠道微生物与昆虫的共生关系 [J]. 昆虫知识,2008,45 (5): 687-693]
Yan BP. The Toxicity Effect of Ni, Hg and PCP toChironomusLarva. [D]. Qingdao: Qingdao University of Science and Technology Master Thesis, 2006. [闫宾萍. 镍、汞和五氯酚对摇蚊幼虫的毒性作用 [D]. 青岛:青岛科技大学硕士论文,2006]
Yang H, Huang YP. Insect microbiome: As guardians of insect health and adaptation [J].ActaMicrobiologicaSinica, 2018, 58 (6): 961-963. [杨红, 黄勇平. 昆虫微生物组:昆虫健康和适应的守护者 [J]. 微生物学报, 2018, 58 (6): 961-963]
Young E, Carey M, Meharg AA,etal.Microbiome and ecotypic adaption ofHolcuslanatus(L.) to extremes of its soil pH range, investigated through transcriptome sequencing [J].Microbiome, 2018, 6 (1): 48.
Zhang YL, Lv BQ, Yang F,etal.Isolation, identification and functional analysis of intestinal micro-organisms ofBrontispalongissimiGestro [J].ChineseJournalofTropicalCrops, 2021, 42 (4): 1066-1070. [章雨璐,吕宝乾,杨帆,等. 椰心叶甲肠道微生物的分离鉴定及功能分析 [J]. 热带作物学报, 2021, 42 (4): 1066-1070]
Zhao CC. The Biodiversity of Helicoverpa Armigera Symbiotic Bacteria and Its Regulatory Effects on the Defense Response in Cotton [D]. Huazhong Agricultural University Master Thesis, 2020. [赵晨晨. 棉铃虫共生菌多样性及对棉花防御反应的调控作用 [D] 武汉:华中农业大学硕士论文,2020]
Zhou D, Zhang W, Zhu LM,etal.Community structure of Chironomid larvae and their indicative significance for water quality in streams of Xianju National Park,China [J].ChineseJournalofAppliedEcology, 2018, 29 (11): 3857-3866. [周东, 张玮, 朱利明,等. 仙居国家公园溪流摇蚊幼虫群落结构及其对水质的指示作用 [J]. 应用生态学报, 2018, 29 (11): 3857-3866]
Zhou F, Pang ZC, Yu XQ,etal. Insect gut microbiota research: Progress and applications [J].ChineseJournalofAppliedEntomology, 2020, 57 (3): 600-607. [周帆,庞志倡,余小强,等. 昆虫肠道微生物的研究进展和应用前景 [J]. 应用昆虫学报, 2020, 57 (3): 600-607]
附录图1 实验室驯化的红裸须摇蚊幼虫肠道可培养细菌菌落
图2 实验室驯化的红裸须摇蚊幼虫肠道可培养细菌革兰氏染色结果
表1 红裸须摇蚊幼虫肠道可培养细菌菌落特征
详细数据见网络版(http://hjkcxb.alljournals.net/)
